فحص عالي المحتوى لتحديد المركبات المعدلة للسمية الخلوية المعتمدة على الأجسام المضادة
Summary
يقدم هذا البروتوكول تقنية آلية عالية الإنتاجية قائمة على الصور لتحديد المركبات التي تعدل قتل خلايا سرطان الثدي بوساطة الخلايا القاتلة الطبيعية في وجود جسم مضاد علاجي مضاد ل HER-2.
Abstract
أحدث العلاج المناعي بالأجسام المضادة الخاصة بالمستضد أو مثبطات نقاط التفتيش المناعية ثورة في علاج سرطان الثدي. يمكن استهداف خلايا سرطان الثدي التي تعبر عن مستقبل عامل نمو البشرة HER2 بواسطة الجسم المضاد ل HER-2 تراستوزوماب. السمية الخلوية المعتمدة على الأجسام المضادة (ADCC) هي آلية مهمة متورطة في العمل المضاد للأورام ل HER-2. يمكن التعرف على Trastuzumab المرتبط بالخلايا السرطانية بواسطة مستقبلات Fc للخلايا المستجيبة ADCC (على سبيل المثال ، الخلايا القاتلة الطبيعية (NK) ، والبلاعم ، والخلايا المحببة) ، مما يؤدي إلى النشاط السام للخلايا لهذه الخلايا المناعية مما يؤدي إلى موت الخلايا السرطانية. شرعنا في تطوير مقايسة قائمة على الصور لقياس كمية ADCC لتحديد مركبات معدل ADCC الجديدة عن طريق فحص المحتوى العالي. في الفحص ، يتم زراعة خلايا سرطان الثدي HER2 JIMT-1 بشكل مفرط مع خلايا NK-92 في وجود تراستوزوماب ، ويتم قياس موت الخلايا المستهدفة عن طريق الفحص المجهري الآلي وتحليل الصور الكمي. تتميز الخلايا المستهدفة عن الخلايا المستجيبة بناء على مضان EGFP. نوضح كيف يمكن اختبار المكتبات المركبة في الفحص لتحديد أدوية ADCC المعدلة. لهذا الغرض ، تم إنشاء لوحة اختبار مكتبة مركبة باستخدام مواد كيميائية دقيقة تم اختيارها عشوائيا من رف المختبر. كما تم تضمين ثلاثة مركبات مزعزعة للاستقرار من الأنابيب الدقيقة (كولشيسين ، فينكريستين ، بودوفيلوتوكسين) من المتوقع أن تتداخل مع هجرة الخلايا القاتلة الطبيعية وتحللها في مكتبة الاختبار. حددت شاشة الاختبار جميع مركبات التحكم الإيجابية الثلاثة كنتائج تثبت مدى ملاءمة الطريقة لتحديد الأدوية المعدلة ل ADCC في مكتبة كيميائية. باستخدام هذا الفحص ، يمكن إجراء شاشات المكتبة المركبة لتحديد المركبات المعززة ل ADCC والتي يمكن استخدامها كعوامل علاجية مساعدة لعلاج المرضى الذين يتلقون علاجات مناعية مضادة للسرطان. بالإضافة إلى ذلك ، يمكن أيضا استخدام الطريقة لتحديد أي آثار جانبية غير مرغوب فيها مثبطة ل ADCC للأدوية العلاجية التي يتناولها مرضى السرطان لمؤشرات مختلفة.
Introduction
يمثل العلاج المناعي بالأجسام المضادة للسرطان أو مثبطات نقاط التفتيش المناعية أو الخلايا التائية المعبرة عن مستقبلات المستضد الخيمري (CAR-T) نهجا قويا لعلاج السرطان1،2،3. Trastuzumab هو جسم مضاد أحادي النسيلة متوافق مع البشر HER-2 (مستقبل عامل نمو البشرة البشري 2) يستخدم لعلاج المرحلة المبكرة الإيجابية HER-2 أو سرطان الثدي النقيلي ، وكذلك سرطان المعدة النقيلي الإيجابي HER-24،5،6. وهو يعمل في المقام الأول عن طريق تثبيط تأثير تحفيز الانتشار لعامل نمو البشرة4. ومع ذلك ، فقد تم الإبلاغ عن أن تراستوزوماب يؤدي بكفاءة إلى موت الخلايا السرطانية حتى لو فقدت الخلايا السرطانية استجابتها لتحفيز HER-27. يرجع هذا التأثير المتناقض للجسم المضاد إلى السمية الخلوية المعتمدة على الأجسام المضادة (ADCC)7. يمكن التوسط في ADCC بواسطة الخلايا القاتلة الطبيعية (NK) والخلايا المحببة والبلاعم المعروفة مجتمعة باسم الخلايا المستجيبة ل ADCC 8,9. إذا ارتبط جسم مضاد ، مثل تراستوزوماب ، بالخلايا السرطانية ، فإن هذه الخلايا المستجيبة تستخدم مستقبلات Fc الخاصة بها لربط المنطقة الثابتة (Fc) من الجسم المضاد. يربط الجسم المضاد الخلايا السرطانية والخلايا المستجيبة الحاملة للمستقبلات Fc ، مما يؤدي إلى إطلاق وسطاءها السامةللخلايا 10. تطلق الخلايا القاتلة الطبيعية الشحنة السامة للخلايا من حبيباتها التي تحتوي على البيرفورين لتوليد المسام في غشاء الخلية المستهدف والجرانزيم (مما يؤدي إلى مسارات إشارات موت الخلايا) في المشبك المناعي مما يؤدي إلى موت الخلايا المبرمج للخلايا السرطانية (انظر الشكل 1).
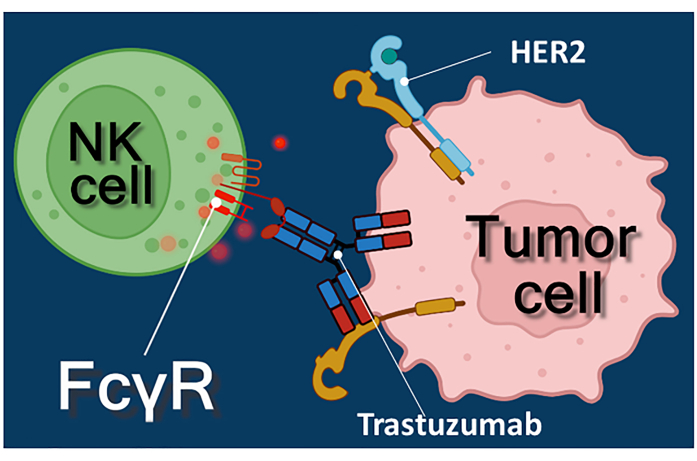
الشكل 1: تفاعلات المستجيب والخلية المستهدفة في ADCC . يتعرف مستقبل Fcγ لسطح الخلية لخلية NK المستجيبة على منطقة Fc للجسم المضاد ل HER2 trastuzumab المحدد لجزيء HER2 المعبر عنه على سطح الخلية السرطانية. وهكذا ، يتم إنشاء ما يسمى المشبك المناعي بين الخليتين ، مما يؤدي إلى الإخراج الموجه للحبيبات السامة للخلايا في الخلية المستجيبة. تؤدي جزيئات البيرفورين والجرانزيم المنبعثة في النهاية إلى موت الخلايا المبرمج للخلية المستهدفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم تطوير العديد من المقايسات سابقا لتحديد السمية الخلوية ، بما في ذلك ADCC. المعيار الذهبي هو طريقة إطلاق الكروم المشع ، حيث يتم تمييز الخلايا المستهدفة بنظير 51Cr المشع ، ويتم قياس ADCC عن طريق قياس النشاط الإشعاعي من طافية الخلايا المستهدفة المحللة11. بسبب المشاكل الواضحة بسبب المعالجة الصارمة للأدوية والنفايات المشعة وتخزينها والتخلص منها ، أصبحت هذه الطريقة غير شائعة بشكل متزايد بين علماء الحياة. بالإضافة إلى ذلك ، فهي غير قابلة للتطبيقات عالية الإنتاجية أيضا. يمكن أن يوفر قياس نشاط الإنزيمات (على سبيل المثال ، نازعة هيدروجين اللاكتات) المنبعثة من الخلايا المستهدفة المقتولة بديلا غير مشع لمقايسة 51Cr12. ومع ذلك ، تفشل هذه المقايسات في التمييز بين موت الخلايا المستهدفة والمستجيبة. أثبت استشعار مقاومة الخلايا الكهربائية (ECIS) أنه مناسب للقياس الكمي ل ADCC13 ، لكن معدات ECIS غير متوفرة في معظم المختبرات ، والتقنية غير متوافقة مع التطبيقات / الفحص عالي الإنتاجية. تمثل الخلايا ذات العلامات الفلورية بديلا شائعا في العديد من فحوصات بيولوجيا الخلية وغالبا ما تستخدم في قياس التدفق الخلوي أو التطبيقات القائمة على قارئ الألواح14،15،16. ومع ذلك ، غالبا ما تحتوي هذه المقايسات على خطوات غسيل أو لا تتوافق مع التطبيقات عالية الإنتاجية (على سبيل المثال ، التقنيات القائمة على قياس التدفق الخلوي). تفشل بعض مقايسات السمية الخلوية الشائعة ، والتي يجب أن تكون مناسبة من الناحية النظرية للقياس الكمي ل ADCC ، في تحديد كفاءة ADCC بشكل موثوق13. في الآونة الأخيرة ، مع انتشار المجهر الفلوري متحد البؤر ، أصبحت المقايسات القائمة على الصور والمحتوى العالي شائعة بشكل متزايد في مختلف مجالات علوم الحياة17. من ناحية ، أصبحت معدات التصوير الخلوي الآن في كل مكان ، بينما ، من ناحية أخرى ، يمكن جمع المعلمات المورفولوجية التي لا نهاية لها تقريبا من الصور المكتسبة. لذلك ، شرعنا في تطوير فحص ADCC متوافق مع فحص المحتوى العالي وإثبات ملاءمته لفحص المكتبة المركبة.
هنا ، نقدم مقايسة ADCC القائمة على الصور ونوضح كيف يمكن استخدام هذا الاختبار لفحص المحتوى العالي (HCS) لتحديد مركبات تعديل ADCC. يعتمد النموذج على الخلايا المستهدفة لسرطان الثدي JIMT-1 ، والخلايا المستجيبة CD16.176V.NK-92 والجسم المضاد أحادي النسيلة المضاد ل HER2 تراستوزوماب. باستخدام هذه الطريقة ، من الممكن تحديد الأدوية التي يمكن أن تعزز عمل قتل الورم للخلايا القاتلة الطبيعية أو الحصول على نظرة ثاقبة لآلية ADCC بوساطة الخلايا القاتلة الطبيعية من خلال تحديد الجزيئات الصغيرة التي تتداخل مع ADCC. نقترح أن علماء الحياة الذين يهدفون إلى قياس السمية الخلوية بوساطة الخلايا مع إيلاء اهتمام خاص ل ADCC قد يستفيدون من استخدام هذا الاختبار إما لعلم الاكتشاف أو تطوير الأدوية. قد يكون هذا الاختبار بديلا إذا كان لدى المختبر إمكانية الوصول إلى بعض الخبرة في التصوير الفلوري وتحليل الصور الكمية.
Protocol
Representative Results
Discussion
تم وصف رد فعل ADCC منذ وقت طويل نسبيا. كما تم وصف الأحداث الجزيئية الرئيسية للعملية19. تتراوح طرق قياس ADCC من مقايسة إطلاق الكروم المشع القياسي الذهبي ، ومقايسات إطلاق الإنزيم السيتوبلازمي إلى العديد من قياس التدفق الخلوي القائم على التألق أو مقايسات الصفائح الدقيقة20</su…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
تلقت LV تمويلا من منح المكتب الوطني للبحث والتطوير والابتكار GINOP-2.3.2-15-2016-00010 TUMORDNS “، GINOP-2.3.2-15-2016-00048-STAYALIVE و OTKA K132193 ، K147482. تم الحصول على خلايا CD16.176V.NK-92 من الدكتور كيري س. كامبل (مركز فوكس تشيس ، فيلابدلفيا ، بنسلفانيا ، نيابة عن برينك بيولوجيكس ، lnc. San Diego، CA) ، محمية ببراءات اختراع في جميع أنحاء العالم ، وتم ترخيصها من قبل Nantkwest، lnc. يعرب المؤلفون عن امتنانهم لجيورجي فيرب وأرباد زوور لمساعدتهم في استخدام خط الخلايا NK-92 وعلى المشورة الفنية.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

