High-Content screening assay voor de identificatie van antilichaam-afhankelijke cellulaire cytotoxiciteit modificerende verbindingen
Summary
Dit protocol presenteert een geautomatiseerde, op afbeeldingen gebaseerde high-throughput-techniek om verbindingen te identificeren die natural killer cel-gemedieerde borstkankerceldoding moduleren in de aanwezigheid van een therapeutisch anti-HER-2-antilichaam.
Abstract
Immunotherapie met antigeenspecifieke antilichamen of immuuncheckpointremmers heeft een revolutie teweeggebracht in de therapie van borstkanker. Borstkankercellen die de epidermale groeifactorreceptor HER2 tot expressie brengen, kunnen het doelwit zijn van het anti-HER-2-antilichaam trastuzumab. Antilichaamafhankelijke cellulaire cytotoxiciteit (ADCC) is een belangrijk mechanisme dat betrokken is bij de antitumorwerking van HER-2. Trastuzumab gebonden aan kankercellen kan worden herkend door de Fc-receptoren van ADCC-effectorcellen (bijv. Natural killer (NK) cellen, macrofagen en granulocyten), waardoor de cytotoxische activiteit van deze immuuncellen wordt geactiveerd die leidt tot kankerceldood. We wilden een op afbeeldingen gebaseerde test ontwikkelen voor de kwantificering van ADCC om nieuwe ADCC-modulatorverbindingen te identificeren door middel van screening met een hoog gehalte. In de test worden HER2-overexpressie van JIMT-1-borstkankercellen samen gekweekt met NK-92-cellen in aanwezigheid van trastuzumab en wordt de dood van doelcellen gekwantificeerd door geautomatiseerde microscopie en kwantitatieve beeldanalyse. Doelcellen worden onderscheiden van effectorcellen op basis van hun EGFP-fluorescentie. We laten zien hoe samengestelde bibliotheken kunnen worden getest in de test om ADCC-modulatorgeneesmiddelen te identificeren. Voor dit doel werd een samengestelde bibliotheektestplaat opgezet met behulp van willekeurig geselecteerde fijne chemicaliën van de laboratoriumplank. Drie microtubuli destabiliserende verbindingen (colchicine, vincristine, podofyllotoxine) waarvan verwacht wordt dat ze de NK-celmigratie en degranulatie verstoren, werden ook opgenomen in de testbibliotheek. Het testscherm identificeerde alle drie de positieve controleverbindingen als treffers die de geschiktheid van de methode bewijzen om ADCC-modificerende geneesmiddelen in een chemische bibliotheek te identificeren. Met deze test kunnen samengestelde bibliotheekschermen worden uitgevoerd om ADCC-verbeterende verbindingen te identificeren die kunnen worden gebruikt als adjuvante therapeutische middelen voor de behandeling van patiënten die immunotherapieën tegen kanker krijgen. Bovendien kan de methode ook worden gebruikt om ongewenste ADCC-remmende bijwerkingen van therapeutische geneesmiddelen die door kankerpatiënten voor verschillende indicaties worden ingenomen, te identificeren.
Introduction
Immunotherapie met antikankerantistoffen, immuuncheckpointremmers of chimere antigeenreceptor-expressie T (CAR-T) cellen vertegenwoordigt een krachtige benadering van kankerbehandeling 1,2,3. Trastuzumab is een gehumaniseerd monoklonaal anti-HER-2 (humane epidermale groeifactorreceptor 2) antilichaam dat wordt gebruikt voor de behandeling van HER-2-positieve vroege stadium of gemetastaseerde borstkanker, evenals HER-2-positieve gemetastaseerde maagkanker 4,5,6. Het werkt voornamelijk door het proliferatiestimulerende effect van de epidermale groeifactor4 te remmen. Er is echter gemeld dat trastuzumab efficiënt kankerceldood veroorzaakt, zelfs als de kankercellen hun reactievermogen op HER-2-stimulatie hebben verloren7. Dit paradoxale effect van het antilichaam is te wijten aan antilichaamafhankelijke celgemedieerde cytotoxiciteit (ADCC)7. ADCC kan worden gemedieerd door natural killer (NK) cellen, granulocyten en macrofagen gezamenlijk bekend als de effectorcellen van ADCC 8,9. Als een antilichaam, zoals trastuzumab, zich bindt aan tumorcellen, dan gebruiken deze effectorcellen hun Fc-receptoren om het constante (Fc) gebied van het antilichaam te binden. Het antilichaam overbrugt de tumorcellen en de Fc-receptordragende effectorcellen, waardoor de afgifte van hun cytotoxische mediatorenwordt geactiveerd 10. Natural killer-cellen geven de cytotoxische lading van hun korrels die perforine bevatten vrij om poriën in het doelcelmembraan en granzyme te genereren (waardoor celdoodsignaleringsroutes worden geactiveerd) in de immuunsynaps die leiden tot apoptose van de kankercellen (zie figuur 1).
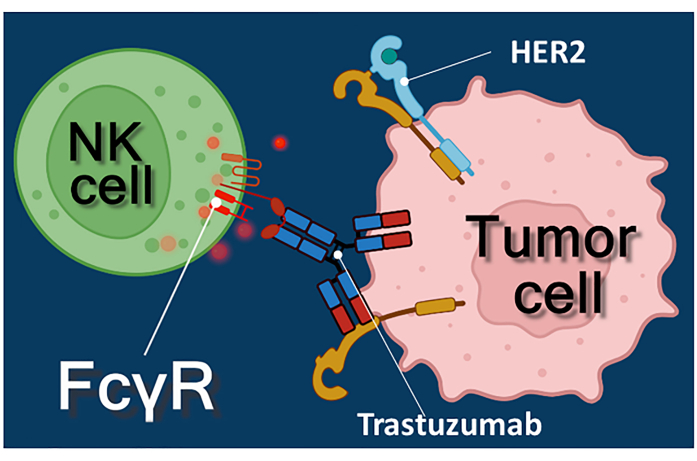
Figuur 1: Effector- en doelcelinteracties in ADCC. De Fcγ-receptor van het celoppervlak van de effector NK-cel herkent het Fc-gebied van het anti-HER2-trastuzumab-antilichaam dat specifiek is voor het HER2-molecuul dat tot expressie komt op het oppervlak van de tumorcel. Zo wordt de zogenaamde immunologische synaps tussen de twee cellen vastgesteld, waardoor de gerichte exocytose van cytotoxische korrels van de effectorcel wordt geïnduceerd. De vrijgekomen perforine- en granzymemoleculen resulteren uiteindelijk in apoptose van de doelcel. Klik hier om een grotere versie van deze figuur te bekijken.
Er zijn eerder verschillende testen ontwikkeld om cytotoxiciteit te kwantificeren, waaronder ADCC. De gouden standaard is de radioactieve chroomafgiftemethode, waarbij de doelcellen worden gelabeld met radioactief 51Cr-isotoop en ADCC wordt gekwantificeerd door radioactiviteit te meten van het supernatant van gelyseerde doelcellen11. Vanwege de voor de hand liggende problemen als gevolg van de strikt gereguleerde behandeling, opslag en verwijdering van radioactieve farmacons en afvalstoffen, is deze methode steeds minder populair geworden onder levenswetenschappers. Bovendien is het ook niet vatbaar voor toepassingen met een hoge doorvoer. Het meten van de activiteit van enzymen (bijv. lactaat-dehydrogenase) die vrijkomen uit de gedode doelcellen kan een niet-radioactief alternatief bieden voor de 51Cr-test12. Deze testen maken echter geen onderscheid tussen doel- en effectorceldood. Electric Cell-substrate Impedance Sensing (ECIS) bleek geschikt voor de kwantificering van ADCC13, maar de ECIS-apparatuur is niet beschikbaar in de meeste laboratoria en de techniek is niet compatibel met toepassingen met hoge doorvoer / screening. Fluorescerend gelabelde cellen vormen een populair alternatief in veel celbiologische assays en worden vaak gebruikt in flowcytometrie of op plaatlezers gebaseerde toepassingen14,15,16. Deze testen bevatten echter vaak wasstappen of zijn anderszins niet compatibel met toepassingen met een hoge doorvoer (bijv. Op flowcytometrie gebaseerde technieken). Sommige populaire cytotoxiciteitstests, die in theorie geschikt zouden moeten zijn voor ADCC-kwantificering, slagen er niet in om de ADCC-efficiëntie betrouwbaar te bepalen13. Onlangs, met de verspreiding van fluorescerende confocale microscopie, worden beeldgebaseerde, hoog-inhoudige assays steeds populairder in verschillende gebieden van de levenswetenschappen17. Aan de ene kant is celbeeldvormingsapparatuur nu vrij alomtegenwoordig, terwijl aan de andere kant vrijwel eindeloze morfologische parameters kunnen worden verzameld uit de verkregen beelden. Daarom zijn we begonnen met het ontwikkelen van een high-content screening compatibele ADCC-test en om de geschiktheid ervan voor samengestelde bibliotheekscreening aan te tonen.
Hier presenteren we een op afbeeldingen gebaseerde ADCC-test en laten we zien hoe deze test kan worden gebruikt voor High-Content Screening (HCS) om ADCC-modulerende verbindingen te identificeren. Het model is gebaseerd op JIMT-1 borstcarcinoom doelcellen, CD16.176V.NK-92 effectorcellen en het gehumaniseerde monoklonale anti-HER2 antilichaam trastuzumab. Met deze methode is het mogelijk om geneesmiddelen te identificeren die de tumordodende werking van NK-cellen kunnen verbeteren of om inzicht te krijgen in het mechanisme van NK-celgemedieerde ADCC door kleine moleculen te identificeren die interfereren met ADCC. We suggereren dat levenswetenschappers die celgemedieerde cytotoxiciteit willen kwantificeren met speciale aandacht voor ADCC, baat kunnen hebben bij het gebruik van deze test, hetzij voor de ontdekkingswetenschap of de ontwikkeling van geneesmiddelen. Deze test kan een alternatief zijn als een laboratorium toegang heeft tot en enige ervaring heeft met fluorescerende beeldvorming en kwantitatieve beeldanalyse.
Protocol
Representative Results
Discussion
De ADCC-reactie is relatief lang geleden beschreven. Belangrijke moleculaire gebeurtenissen van het proces zijn ook beschreven19. Methoden voor het meten van ADCC variëren van de gouden standaard radioactieve chroom release assay, cytoplasmatische enzym release assays tot verschillende fluorescentie-gebaseerde flowcytometrie of microplate assays20. Een veel voorkomende beperking van deze testen is echter dat ze niet vatbaar zijn voor toepassingen met een hoge doorvoer. Eer…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV ontving financiering van de subsidies van het National Research, Development and Innovation Office GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE en OTKA K132193, K147482. CD16.176V.NK-92 cellen werden verkregen van Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, namens Brink Biologics, lnc. San Diego, CA), worden wereldwijd beschermd door patenten en werden in licentie gegeven door Nantkwest, lnc. De auteurs zijn György Vereb en Árpád Szöőr dankbaar voor hun hulp bij het gebruik van de NK-92 cellijn en voor technisch advies.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

