Essai de criblage à haute teneur pour l’identification de composés modificateurs de la cytotoxicité cellulaire dépendants des anticorps
Summary
Ce protocole présente une technique automatisée à haut débit basée sur l’image pour identifier les composés modulant la destruction des cellules cancéreuses du sein médiée par les cellules tueuses naturelles en présence d’un anticorps thérapeutique anti-HER-2.
Abstract
L’immunothérapie avec des anticorps spécifiques de l’antigène ou des inhibiteurs du point de contrôle immunitaire a révolutionné le traitement du cancer du sein. Les cellules cancéreuses du sein exprimant le récepteur du facteur de croissance épidermique HER2 peuvent être ciblées par l’anticorps anti-HER-2 trastuzumab. La cytotoxicité cellulaire dépendante des anticorps (ADCC) est un mécanisme important impliqué dans l’action antitumorale de HER-2. Le trastuzumab lié aux cellules cancéreuses peut être reconnu par les récepteurs Fc des cellules effectrices ADCC (p. ex. cellules tueuses naturelles (NK), macrophages et granulocytes), déclenchant l’activité cytotoxique de ces cellules immunitaires conduisant à la mort des cellules cancéreuses. Nous avons entrepris de développer un test basé sur l’image pour la quantification de l’ADCC afin d’identifier de nouveaux composés modulateurs de l’ADCC par criblage à haute teneur. Dans le test, les cellules cancéreuses du sein JIMT-1 surexprimant HER2 sont co-cultivées avec des cellules NK-92 en présence de trastuzumab, et la mort cellulaire cible est quantifiée par microscopie automatisée et analyse quantitative d’images. Les cellules cibles sont distinguées des cellules effectrices en fonction de leur fluorescence EGFP. Nous montrons comment les banques de composés peuvent être testées dans le test pour identifier les médicaments modulateurs de l’ADCC. À cette fin, une plaque d’essai de bibliothèque de composés a été mise en place en utilisant des produits chimiques fins sélectionnés au hasard sur les étagères du laboratoire. Trois composés déstabilisants des microtubules (colchicine, vincristine, podophyllotoxine) susceptibles d’interférer avec la migration et la dégranulation des cellules NK ont également été inclus dans la bibliothèque de tests. Le criblage d’essai a identifié les trois composés témoins positifs comme des résultats prouvant la pertinence de la méthode pour identifier les médicaments modifiant l’ADCC dans une bibliothèque chimique. Avec ce test, des criblages de bibliothèques de composés peuvent être effectués pour identifier les composés améliorant l’ADCC qui pourraient être utilisés comme agents thérapeutiques adjuvants pour le traitement des patients recevant des immunothérapies anticancéreuses. En outre, la méthode peut également être utilisée pour identifier les effets secondaires indésirables inhibiteurs de l’ADCC des médicaments thérapeutiques pris par les patients cancéreux pour différentes indications.
Introduction
L’immunothérapie avec des anticorps anticancéreux, des inhibiteurs du point de contrôle immunitaire ou des lymphocytes T exprimant des récepteurs antigéniques chimériques (CAR-T) représente une approche puissante du traitement du cancer 1,2,3. Le trastuzumab est un anticorps monoclonal humanisé anti-HER-2 (récepteur 2 du facteur de croissance épidermique humain) utilisé pour traiter le cancer du sein à un stade précoce ou métastatique HER-2 positif, ainsi que le cancer gastrique métastatique HER-2 positif 4,5,6. Il agit principalement en inhibant l’effet stimulant la prolifération du facteur de croissance épidermique4. Il a été rapporté, cependant, que le trastuzumab déclenche efficacement la mort des cellules cancéreuses même si les cellules cancéreuses ont perdu leur réactivité à la stimulation HER-27. Cet effet paradoxal de l’anticorps est dû à la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC)7. L’ADCC peut être médiée par des cellules tueuses naturelles (NK), des granulocytes et des macrophages collectivement connus sous le nom de cellules effectrices de l’ADCC 8,9. Si un anticorps, tel que le trastuzumab, se lie aux cellules tumorales, ces cellules effectrices utilisent leurs récepteurs Fc pour se lier à la région constante (Fc) de l’anticorps. L’anticorps relie les cellules tumorales et les cellules effectrices porteuses du récepteur Fc, déclenchant la libération de leurs médiateurs cytotoxiques10. Les cellules tueuses naturelles libèrent la cargaison cytotoxique de leurs granules contenant de la perforine pour générer des pores dans la membrane cellulaire cible et du granzyme (déclenchant des voies de signalisation de la mort cellulaire) dans la synapse immunitaire conduisant à l’apoptose des cellules cancéreuses (voir Figure 1).
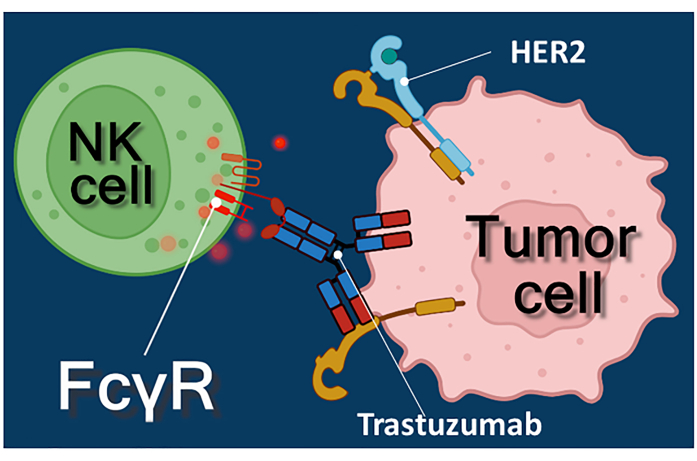
Figure 1 : Interactions entre l’effecteur et la cellule cible dans l’ADCC. Le récepteur Fcγ de surface cellulaire de la cellule NK effectrice reconnaît la région Fc de l’anticorps anti-HER2 trastuzumab spécifique de la molécule HER2 exprimée à la surface de la cellule tumorale. Ainsi, la synapse dite immunologique est établie entre les deux cellules, induisant l’exocytose dirigée des granules cytotoxiques de la cellule effectrice. Les molécules de perforine et de granzyme libérées finissent par entraîner l’apoptose de la cellule cible. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Plusieurs tests ont déjà été développés pour quantifier la cytotoxicité, y compris l’ADCC. L’étalon-or est la méthode de libération de chrome radioactif, où les cellules cibles sont marquées avec un isotope radioactif 51Cr, et l’ADCC est quantifié en mesurant la radioactivité du surnageant des cellules cibles lysées11. En raison des problèmes évidents dus à la manipulation, au stockage et à l’élimination strictement réglementés des pharmacons et des déchets radioactifs, cette méthode est devenue de moins en moins populaire parmi les scientifiques de la vie. En outre, il ne se prête pas non plus aux applications à haut débit. La mesure de l’activité des enzymes (p. ex. lactate-déshydrogénase) libérées par les cellules cibles tuées peut fournir une alternative non radioactive au test 51Cr12. Ces essais, cependant, ne font pas la distinction entre les morts cellulaires cibles et effectrices. La détection d’impédance électrique de substrat cellulaire (ECIS) s’est avérée appropriée pour la quantification de l’ADCC13, mais l’équipement ECIS n’est pas disponible dans la plupart des laboratoires et la technique n’est pas compatible avec les applications / criblage à haut débit. Les cellules marquées par fluorescence représentent une alternative populaire dans de nombreux tests de biologie cellulaire et sont souvent utilisées dans la cytométrie en flux ou les applications basées sur des lecteurs de plaques14,15,16. Cependant, ces tests contiennent souvent des étapes de lavage ou sont autrement incompatibles avec les applications à haut débit (par exemple, les techniques basées sur la cytométrie en flux). Certains tests de cytotoxicité populaires, qui en théorie devraient convenir à la quantification de l’ADCC, ne parviennent pas à déterminer de manière fiable l’efficacité de l’ADCC13. Récemment, avec la diffusion de la microscopie confocale fluorescente, les tests à haute teneur basés sur l’image sont devenus de plus en plus populaires dans divers domaines des sciences de la vie17. D’une part, les équipements d’imagerie cellulaire sont maintenant assez omniprésents, tandis que, d’autre part, des paramètres morphologiques pratiquement infinis peuvent être recueillis à partir des images acquises. Par conséquent, nous avons entrepris de développer un test ADCC compatible avec le criblage à haute teneur et de démontrer son adéquation au criblage par bibliothèque de composés.
Ici, nous présentons un test ADCC basé sur l’image et démontrons comment ce test peut être utilisé pour le criblage à haute teneur (HCS) afin d’identifier les composés modulateurs ADCC. Le modèle est basé sur des cellules cibles du carcinome du sein JIMT-1, des cellules effectrices CD16.176V.NK-92 et l’anticorps monoclonal humanisé anti-HER2 trastuzumab. Avec cette méthode, il est possible d’identifier des médicaments qui peuvent améliorer l’action tumorale des cellules NK ou de mieux comprendre le mécanisme de l’ADCC médié par les cellules NK en identifiant de petites molécules interférant avec l’ADCC. Nous suggérons que les scientifiques de la vie visant à quantifier la cytotoxicité à médiation cellulaire en accordant une attention particulière à l’ADCC puissent bénéficier de l’utilisation de ce test soit pour la science de la découverte, soit pour le développement de médicaments. Ce test peut être une alternative si un laboratoire a accès à l’imagerie fluorescente et à l’analyse quantitative d’images et possède une certaine expérience en la matière.
Protocol
Representative Results
Discussion
La réaction de l’ADCC a été décrite il y a relativement longtemps. Les événements moléculaires clés du processus ont également été décrits19. Les méthodes de mesure de l’ADCC vont du test de libération de chrome radioactif de référence, des tests de libération d’enzymes cytoplasmiques à plusieurs tests de cytométrie en flux ou de microplaques basés sur la fluorescence20. Cependant, une limitation commune de ces tests est qu’ils ne se prêtent pas…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV a reçu un financement de l’Office national de la recherche, du développement et de l’innovation subventions GINOP-2.3.2-15-2016-00010 TUMORDNS », GINOP-2.3.2-15-2016-00048-STAYALIVE et OTKA K132193, K147482. Les cellules CD16.176V.NK-92 ont été obtenues du Dr Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, pour le compte de Brink Biologics, lnc. San Diego, CA), sont protégés par des brevets dans le monde entier et ont été concédés sous licence par Nantkwest, lnc. Les auteurs remercient György Vereb et Árpád Szöőr pour leur aide dans l’utilisation de la lignée cellulaire NK-92 et pour leurs conseils techniques.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

