בדיקת סינון תוכן גבוהה לזיהוי תרכובות ציטוטוקסיות תאיות תלויות נוגדנים
Summary
פרוטוקול זה מציג טכניקה אוטומטית, מבוססת תמונה, בעלת תפוקה גבוהה לזיהוי תרכובות המווסתות הרג תאי סרטן שד בתיווך תאי הרג טבעיים בנוכחות נוגדן אנטי-HER-2 טיפולי.
Abstract
אימונותרפיה עם נוגדנים ספציפיים לאנטיגן או מעכבי בקרה חיסונית חוללה מהפכה בטיפול בסרטן השד. תאי סרטן השד המבטאים את קולטן גורם הגדילה האפידרמיס HER2 יכולים להיות ממוקדים על ידי נוגדן נגד HER-2 trastuzumab. ציטוטוקסיות תאית תלוית נוגדנים (ADCC) היא מנגנון חשוב המעורב בפעילות האנטי-סרטנית של HER-2. Trastuzumab הקשורים לתאים סרטניים יכול להיות מזוהה על ידי קולטני Fc של תאים משפיעים ADCC (למשל, תאי הרג טבעי (NK), מקרופאגים, גרנולוציטים), הפעלת הפעילות ציטוטוקסית של תאים חיסוניים אלה המוביל למוות תאים סרטניים. יצאנו לפתח בדיקה מבוססת תמונה לכימות ADCC כדי לזהות תרכובות אפנן ADCC חדשות על ידי סינון תוכן גבוה. בניסוי, תאי סרטן השד JIMT-1 בעלי ביטוי יתר של HER2 מתורבתים יחד עם תאי NK-92 בנוכחות טרסטוזומאב, ומוות תאי המטרה מכומת על ידי מיקרוסקופ אוטומטי וניתוח תמונה כמותי. תאי המטרה נבדלים מתאי אפקט בהתבסס על פלואורסצנטיות ה-EGFP שלהם. אנו מראים כיצד ניתן לבדוק ספריות מורכבות בבדיקה כדי לזהות תרופות אפנן ADCC. לשם כך הוצבה פלטת בדיקה של ספריית תרכובת באמצעות כימיקלים עדינים שנבחרו באופן אקראי ממדף המעבדה. שלוש תרכובות מערערות יציבות מיקרוטובולים (קולכיצין, וינקריסטין, פודופילוטוקסין) הצפויות להפריע לנדידת תאי NK ולפירוק תאי NK נכללו גם הן בספריית הבדיקה. מסך הבדיקה זיהה את כל שלוש תרכובות הבקרה החיוביות כפגיעות המוכיחות את התאמת השיטה לזיהוי תרופות משנות ADCC בספרייה כימית. באמצעות בדיקה זו, ניתן לבצע מסכי ספרייה מורכבים כדי לזהות תרכובות משפרות ADCC שיכולות לשמש כסוכני טיפול אדג’ובנטיים לטיפול בחולים המקבלים אימונותרפיה אנטי-סרטנית. בנוסף, השיטה יכולה לשמש גם לזיהוי תופעות לוואי בלתי רצויות מעכבות ADCC של תרופות טיפוליות הנלקחות על ידי חולי סרטן עבור אינדיקציות שונות.
Introduction
אימונותרפיה עם נוגדנים אנטי-סרטניים, מעכבי בקרה חיסונית, או תאי T (CAR-T) המבטאים קולטן אנטיגן כימרי מייצגת גישה רבת עוצמה לטיפול בסרטן 1,2,3. Trastuzumab הוא נוגדן חד שבטי אנושי anti-HER-2 (קולטן גורם גדילה אפידרמלי אנושי 2) המשמש לטיפול בסרטן שד חיובי HER-2 בשלב מוקדם או גרורתי, כמו גם סרטן קיבה גרורתי חיובי HER-2 4,5,6. זה פועל בעיקר על ידי עיכוב ההשפעה מגרה התפשטות של גורם גדילה אפידרמיס4. עם זאת, דווח כי trastuzumab גורם ביעילות למוות של תאים סרטניים גם אם התאים הסרטניים איבדו את תגובתם לגירוי HER-27. השפעה פרדוקסלית זו של הנוגדן נובעת מציטוטוקסיות תלויית תאים (ADCC)7. ADCC יכול להיות מתווך על ידי תאי הרג טבעי (NK), גרנולוציטים ומקרופאגים הידועים ביחד כתאי ההשפעה של ADCC 8,9. אם נוגדן, כגון trastuzumab, נקשר לתאי הגידול, אז תאים משפיעים אלה משתמשים בקולטני Fc שלהם כדי לקשור את האזור הקבוע (Fc) של הנוגדן. הנוגדן מגשר בין תאי הגידול לבין תאי ההשפעה נושאי קולטן Fc, וגורם לשחרור המתווכים ציטוטוקסיים שלהם10. תאי הרג טבעיים משחררים את המטען ציטוטוקסי של הגרגירים שלהם המכילים פרפורין כדי ליצור נקבוביות בקרום תא המטרה וגראנזים (המפעיל מסלולי איתות מוות תאי) לתוך סינפסת החיסון, מה שמוביל לאפופטוזיס של התאים הסרטניים (ראו איור 1).
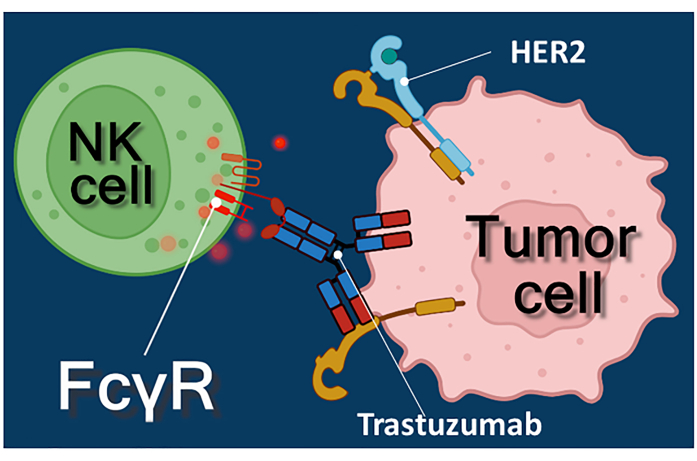
איור 1: אינטראקציות של אפקטור ותא יעד ב-ADCC. קולטן Fcγ משטח התא של תא ה- NK המשפיע מזהה את אזור Fc של נוגדן ה- trastuzumab נגד HER2 הספציפי למולקולת HER2 המבוטאת על פני השטח של התא הסרטני. לפיכך, מה שנקרא סינפסה אימונולוגית הוקמה בין שני התאים, גרימת exocytosis מכוונת של גרגירים ציטוטוקסיים של התא המשפיע. מולקולות הפרפורין והגרנזים המשתחררות גורמות בסופו של דבר לאפופטוזיס של תא המטרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מספר בדיקות פותחו בעבר כדי לכמת ציטוטוקסיות, כולל ADCC. תקן הזהב הוא שיטת שחרור כרום רדיואקטיבי, שבה תאי המטרה מסומנים באיזוטופ רדיואקטיבי 51Cr, ו-ADCC מכומת על ידי מדידת רדיואקטיביות מהסופרנאטנט של תאי המטרה11. בגלל הבעיות הברורות עקב טיפול, אחסון וסילוק מוסדרים בקפידה של תרופות רדיואקטיביות ופסולת, שיטה זו הפכה יותר ויותר לא פופולרית בקרב מדעני החיים. בנוסף, זה לא מקובל על יישומים תפוקה גבוהה גם. מדידת הפעילות של אנזימים (למשל, לקטט-דהידרוגנאז) המשתחררים מתאי המטרה המומתים יכולה לספק חלופה לא רדיואקטיבית לבדיקת 51Cr12. עם זאת, בדיקות אלה אינן מצליחות להבחין בין מוות של תאי מטרה למוות של תאי השפעה. חישת עכבה של מצע תא חשמלי (ECIS) הוכחה כמתאימה לכימות ADCC13, אך ציוד ECIS אינו זמין ברוב המעבדות, והטכניקה אינה תואמת ליישומים/סינון בעלי תפוקה גבוהה. תאים המסומנים באופן פלואורסצנטי מייצגים חלופה פופולרית בבדיקות ביולוגיה רבות של התא ומשמשים לעתים קרובות ביישומים מבוססי ציטומטריית זרימה או קורא לוחות14,15,16. עם זאת, בדיקות אלה מכילות לעתים קרובות שלבי שטיפה או שאינן תואמות בדרך אחרת ליישומים בעלי תפוקה גבוהה (למשל, טכניקות מבוססות ציטומטריית זרימה). כמה מבחני ציטוטוקסיות פופולריים, אשר בתיאוריה אמורים להתאים לכימות ADCC, אינם מצליחים לקבוע באופן מהימן יעילות ADCC13. לאחרונה, עם התפשטות המיקרוסקופ הקונפוקלי הפלואורסצנטי, מבדקים מבוססי תמונה, בעלי תוכן גבוה הופכים פופולריים יותר ויותר בתחומים שונים של מדעי החיים17. מצד אחד, ציוד הדמיה של תאים נמצא כיום בכל מקום, ומצד שני, ניתן לאסוף פרמטרים מורפולוגיים כמעט אינסופיים מהתמונות שנרכשו. לכן, יצאנו לפתח בדיקת ADCC תואמת סינון בתוכן גבוה ולהדגים את התאמתו לסינון ספריות מורכבות.
כאן, אנו מציגים בדיקת ADCC מבוססת תמונה ומדגימים כיצד ניתן להשתמש בבדיקה זו עבור סינון תוכן גבוה (HCS) לזיהוי תרכובות אפנון ADCC. המודל מבוסס על תאי מטרה של קרצינומה של השד JIMT-1, תאי השפעה CD16.176V.NK-92 ונוגדן חד שבטי אנושי נגד HER2 trastuzumab. בשיטה זו, ניתן לזהות תרופות שיכולות לשפר את פעולת הרג הגידול של תאי NK או לקבל תובנה לגבי המנגנון של ADCC בתיווך תאי NK על ידי זיהוי מולקולות קטנות המפריעות ל- ADCC. אנו מציעים כי מדעני חיים השואפים לכמת ציטוטוקסיות בתיווך תאים תוך התייחסות מיוחדת ל- ADCC עשויים להפיק תועלת משימוש בבדיקה זו למדע התגלית או לפיתוח תרופות. בדיקה זו עשויה להיות חלופה אם למעבדה יש גישה וניסיון כלשהו בהדמיה פלואורסצנטית וניתוח תמונה כמותי.
Protocol
Representative Results
Discussion
תגובת ADCC תוארה לפני זמן רב יחסית. אירועים מולקולריים מרכזיים של התהליך תוארו גם הם19. השיטות למדידת ADCC נעות בין בדיקת שחרור כרום רדיואקטיבי בתקן הזהב, מבחני שחרור אנזימים ציטופלזמיים למספר ציטומטריית זרימה מבוססת פלואורסצנטיות או מבחני מיקרו-לוחות20. עם זאת, מגבלה…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV קיבלה מימון ממענקי משרד המחקר, הפיתוח והחדשנות הלאומי GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE ו-OTKA K132193, K147482. תאי CD16.176V.NK-92 התקבלו מד”ר קרי ס. קמפבל (מרכז פוקס צ’ייס, Philapedlphia, PA, מטעם Brink Biologics, lnc. סן דייגו, קליפורניה), מוגנים על ידי פטנטים ברחבי העולם, וקיבלו רישיון על ידי Nantkwest, lnc. המחברים מודים לגיורגי ורב ולארפד שור על עזרתם בשימוש בקו התאים NK-92 ועל הייעוץ הטכני.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

