Test di screening ad alto contenuto per l'identificazione di composti modificanti la citotossicità cellulare anticorpo-dipendenti
Summary
Questo protocollo presenta una tecnica automatizzata ad alto rendimento basata su immagini per identificare i composti che modulano l’uccisione delle cellule di cancro al seno mediate da cellule natural killer in presenza di un anticorpo terapeutico anti-HER-2.
Abstract
L’immunoterapia con anticorpi antigene-specifici o inibitori del checkpoint immunitario ha rivoluzionato la terapia del cancro al seno. Le cellule del cancro al seno che esprimono il recettore del fattore di crescita epidermico HER2 possono essere prese di mira dall’anticorpo anti-HER-2 trastuzumab. La citotossicità cellulare anticorpo-dipendente (ADCC) è un importante meccanismo implicato nell’azione antitumorale di HER-2. Trastuzumab legato alle cellule tumorali può essere riconosciuto dai recettori Fc delle cellule effettrici ADCC (ad esempio, cellule natural killer (NK), macrofagi e granulociti), innescando l’attività citotossica di queste cellule immunitarie che portano alla morte delle cellule tumorali. Abbiamo deciso di sviluppare un saggio basato su immagini per la quantificazione dell’ADCC per identificare nuovi composti modulatori ADCC mediante screening ad alto contenuto. Nel test, le cellule di carcinoma mammario JIMT-1 che sovraesprimono HER2 sono co-coltivate con cellule NK-92 in presenza di trastuzumab e la morte delle cellule bersaglio viene quantificata mediante microscopia automatizzata e analisi quantitativa delle immagini. Le cellule bersaglio si distinguono dalle cellule effettrici in base alla loro fluorescenza EGFP. Mostriamo come le librerie di composti possono essere testate nel test per identificare i farmaci modulatori ADCC. A tale scopo, è stata allestita una piastra di prova per librerie composte utilizzando prodotti chimici fini selezionati a caso dallo scaffale del laboratorio. Nella libreria di test sono stati inclusi anche tre composti destabilizzanti per microtubuli (colchicina, vincristina, podofillotossina) che dovrebbero interferire con la migrazione e la degranulazione delle cellule NK. Lo screening del test ha identificato tutti e tre i composti di controllo positivi come risultati che dimostrano l’idoneità del metodo per identificare i farmaci modificanti l’ADCC in una libreria chimica. Con questo test, è possibile eseguire screening della libreria di composti per identificare composti che potenziano l’ADCC che potrebbero essere utilizzati come agenti terapeutici adiuvanti per il trattamento di pazienti sottoposti a immunoterapie antitumorali. Inoltre, il metodo può anche essere utilizzato per identificare eventuali effetti collaterali indesiderati che inibiscono l’ADCC dei farmaci terapeutici assunti dai pazienti oncologici per diverse indicazioni.
Introduction
L’immunoterapia con anticorpi antitumorali, inibitori del checkpoint immunitario o cellule T (CAR-T) che esprimono il recettore dell’antigene chimerico rappresenta un potente approccio al trattamento del cancro 1,2,3. Trastuzumab è un anticorpo monoclonale umanizzato anti-HER-2 (recettore 2 del fattore di crescita epidermico umano) utilizzato per il trattamento del carcinoma mammario HER-2 positivo allo stadio iniziale o metastatico, nonché del carcinoma gastrico metastatico HER-2 positivo 4,5,6. Agisce principalmente inibendo l’effetto stimolante della proliferazione del fattore di crescita epidermico4. È stato riportato, tuttavia, che trastuzumab innesca efficacemente la morte delle cellule tumorali anche se le cellule tumorali hanno perso la loro reattività alla stimolazione di HER-27. Questo effetto paradossale dell’anticorpo è dovuto alla citotossicità cellulo-mediata anticorpo-dipendente (ADCC)7. L’ADCC può essere mediato da cellule natural killer (NK), granulociti e macrofagi noti collettivamente come cellule effettrici di ADCC 8,9. Se un anticorpo, come trastuzumab, si lega alle cellule tumorali, allora queste cellule effettrici usano i loro recettori Fc per legare la regione costante (Fc) dell’anticorpo. L’anticorpo collega le cellule tumorali e le cellule effettrici portatrici del recettore Fc, innescando il rilascio dei loro mediatori citotossici10. Le cellule natural killer rilasciano il carico citotossico dei loro granuli contenenti perforina per generare pori nella membrana cellulare bersaglio e granzima (innescando le vie di segnalazione della morte cellulare) nella sinapsi immunitaria che porta all’apoptosi delle cellule tumorali (vedi Figura 1).
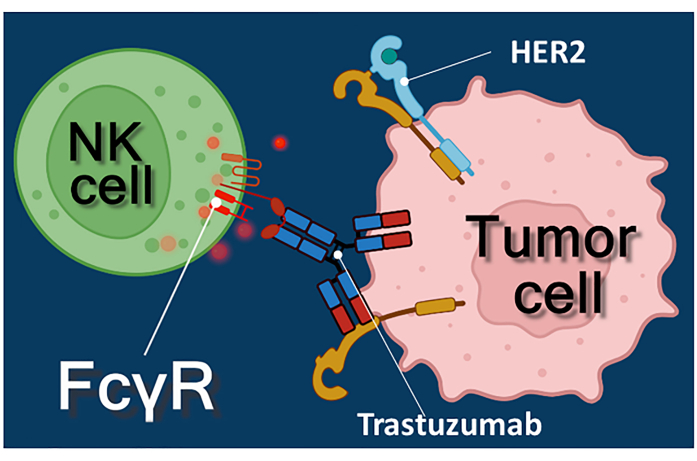
Figura 1: Interazioni effettore e cellula bersaglio nell’ADCC. Il recettore Fcγ della superficie cellulare della cellula effettrice NK riconosce la regione Fc dell’anticorpo anti-HER2 trastuzumab specifico per la molecola HER2 espressa sulla superficie della cellula tumorale. Pertanto, la cosiddetta sinapsi immunologica si stabilisce tra le due cellule, inducendo l’esocitosi diretta dei granuli citotossici della cellula effettrice. Le molecole di perforina e granzima rilasciate alla fine provocano l’apoptosi della cellula bersaglio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Diversi saggi sono stati precedentemente sviluppati per quantificare la citotossicità, incluso l’ADCC. Il gold standard è il metodo di rilascio del cromo radioattivo, in cui le cellule bersaglio sono etichettate con isotopo radioattivo 51Cr e l’ADCC è quantificato misurando la radioattività dal surnatante delle cellule bersaglio lisate11. A causa degli ovvi problemi dovuti alla manipolazione, allo stoccaggio e allo smaltimento strettamente regolamentati di farmaci e rifiuti radioattivi, questo metodo è diventato sempre meno popolare tra gli scienziati della vita. Inoltre, non è nemmeno suscettibile di applicazioni ad alta produttività. La misurazione dell’attività degli enzimi (ad esempio, lattato-deidrogenasi) rilasciati dalle cellule bersaglio uccise può fornire un’alternativa non radioattiva al test 51Cr12. Questi test, tuttavia, non riescono a distinguere tra morte delle cellule bersaglio e cellule effettrici. L’Electric Cell-substrate Impedance Sensing (ECIS) si è dimostrato adatto per la quantificazione dell’ADCC13, ma l’apparecchiatura ECIS non è disponibile nella maggior parte dei laboratori e la tecnica non è compatibile con applicazioni/screening ad alto rendimento. Le cellule marcate con fluorescenza rappresentano un’alternativa popolare in molti saggi di biologia cellulare e sono spesso utilizzate nella citometria a flusso o nelle applicazioni basate su lettori di piastre14,15,16. Tuttavia, questi test spesso contengono fasi di lavaggio o sono altrimenti incompatibili con applicazioni ad alta produttività (ad esempio, tecniche basate sulla citometria a flusso). Alcuni test di citotossicità popolari, che in teoria dovrebbero essere adatti per la quantificazione dell’ADCC, non riescono a determinare in modo affidabile l’efficienza dell’ADCC13. Recentemente, con la diffusione della microscopia confocale fluorescente, i saggi basati su immagini e ad alto contenuto stanno diventando sempre più popolari in vari settori delle scienze della vita17. Da un lato, le apparecchiature di imaging cellulare sono ora piuttosto onnipresenti, mentre, d’altra parte, i parametri morfologici virtualmente infiniti possono essere raccolti dalle immagini acquisite. Pertanto, abbiamo deciso di sviluppare un test ADCC compatibile con lo screening ad alto contenuto e di dimostrare la sua idoneità per lo screening delle librerie composte.
Qui, presentiamo un test ADCC basato su immagini e dimostriamo come questo test può essere utilizzato per lo screening ad alto contenuto (HCS) per identificare i composti modulanti ADCC. Il modello si basa sulle cellule bersaglio del carcinoma mammario JIMT-1, sulle cellule effettrici CD16.176V.NK-92 e sull’anticorpo monoclonale umanizzato anti-HER2 trastuzumab. Con questo metodo, è possibile identificare farmaci che possono migliorare l’azione di uccisione del tumore delle cellule NK o ottenere informazioni sul meccanismo dell’ADCC mediato dalle cellule NK identificando piccole molecole che interferiscono con l’ADCC. Suggeriamo che gli scienziati della vita che mirano a quantificare la citotossicità cellulo-mediata con particolare riguardo all’ADCC possono trarre beneficio dall’uso di questo test sia per la scienza della scoperta che per lo sviluppo di farmaci. Questo test può essere un’alternativa se un laboratorio ha accesso e una certa esperienza nell’imaging fluorescente e nell’analisi quantitativa delle immagini.
Protocol
Representative Results
Discussion
La reazione ADCC è stata descritta relativamente molto tempo fa. Sono stati descritti anche eventi molecolari chiave del processo19. I metodi per misurare l’ADCC vanno dal saggio di rilascio di cromo radioattivo gold standard, ai saggi di rilascio di enzimi citoplasmatici a diversi test di citometria a flusso o micropiastre basati sulla fluorescenza20. Tuttavia, una limitazione comune di questi test è che non sono suscettibili di applicazioni ad alta produttività. In pre…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV ha ricevuto finanziamenti dall’Ufficio nazionale per la ricerca, lo sviluppo e l’innovazione sovvenzioni GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE e OTKA K132193, K147482. Le cellule CD16.176V.NK-92 sono state ottenute dal Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, per conto di Brink Biologics, lnc. San Diego, CA), sono protetti da brevetti in tutto il mondo e sono stati concessi in licenza da Nantkwest, lnc. Gli autori sono grati a György Vereb e Árpád Szöőr per il loro aiuto nell’uso della linea cellulare NK-92 e per i consigli tecnici.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

