Screeninganalys med högt innehåll för identifiering av antikroppsberoende cellulära cytotoxicitetsmodifierande föreningar
Summary
Detta protokoll presenterar en automatiserad, bildbaserad teknik med hög genomströmning för att identifiera föreningar som modulerar dödande av naturliga mördarcellmedierade bröstcancerceller i närvaro av en terapeutisk anti-HER-2-antikropp.
Abstract
Immunterapi med antigenspecifika antikroppar eller immuncheckpointhämmare har revolutionerat behandlingen av bröstcancer. Bröstcancerceller som uttrycker den epidermala tillväxtfaktorreceptorn HER2 kan riktas mot anti-HER-2-antikroppen trastuzumab. Antikroppsberoende cellulär cytotoxicitet (ADCC) är en viktig mekanism som är inblandad i antitumörverkan av HER-2. Trastuzumab bundet till cancerceller kan kännas igen av Fc-receptorerna i ADCC-effektorceller (t.ex. naturliga mördarceller (NK), makrofager och granulocyter), vilket utlöser den cytotoxiska aktiviteten hos dessa immunceller som leder till cancercelldöd. Vi bestämde oss för att utveckla en bildbaserad analys för kvantifiering av ADCC för att identifiera nya ADCC-modulatorföreningar genom screening med högt innehåll. I analysen samodlas HER2-överuttryckande JIMT-1-bröstcancerceller med NK-92-celler i närvaro av trastuzumab, och målcelldöd kvantifieras genom automatiserad mikroskopi och kvantitativ bildanalys. Målceller skiljer sig från effektorceller baserat på deras EGFP-fluorescens. Vi visar hur föreningsbibliotek kan testas i analysen för att identifiera ADCC-modulatorläkemedel. För detta ändamål sattes en sammansatt bibliotekstestplatta upp med slumpmässigt utvalda finkemikalier från laboratoriehyllan. Tre mikrotubulidestabiliserande föreningar (kolkicin, vinkristin, podofyllotoxin) som förväntas störa NK-cellmigration och degranulering inkluderades också i testbiblioteket. Testskärmen identifierade alla tre positiva kontrollföreningar som träffar som bevisar metodens lämplighet för att identifiera ADCC-modifierande läkemedel i ett kemiskt bibliotek. Med denna analys kan föreningsbiblioteksskärmar utföras för att identifiera ADCC-förbättrande föreningar som kan användas som adjuvansterapeutiska medel för behandling av patienter som får immunterapier mot cancer. Dessutom kan metoden också användas för att identifiera eventuella oönskade ADCC-hämmande biverkningar av terapeutiska läkemedel som tas av cancerpatienter för olika indikationer.
Introduction
Immunterapi med antikroppar mot cancer, immunkontrollpunktshämmare eller chimära antigenreceptoruttryckande T (CAR-T) -celler representerar ett kraftfullt tillvägagångssätt för cancerbehandling 1,2,3. Trastuzumab är en humaniserad monoklonal anti-HER-2 (human epidermal tillväxtfaktorreceptor 2) antikropp som används för behandling av HER-2-positiv tidig stadium eller metastaserande bröstcancer, liksom HER-2-positiv metastaserad magcancer 4,5,6. Det verkar främst genom att hämma den proliferationsstimulerande effekten av epidermal tillväxtfaktor4. Det har dock rapporterats att trastuzumab effektivt utlöser cancercellsdöd även om cancercellerna har förlorat sin respons på HER-2-stimulering7. Denna paradoxala effekt av antikroppen beror på antikroppsberoende cellmedierad cytotoxicitet (ADCC)7. ADCC kan förmedlas av naturliga mördarceller (NK), granulocyter och makrofager som tillsammans kallas effektorcellerna i ADCC 8,9. Om en antikropp, såsom trastuzumab, binder till tumörceller, använder dessa effektorceller sina Fc-receptorer för att binda antikroppens konstanta (Fc) region. Antikroppen överbryggar tumörcellerna och Fc-receptorbärande effektorceller, vilket utlöser frisättningen av deras cytotoxiska mediatorer10. Naturliga mördarceller frigör den cytotoxiska lasten av sina granuler som innehåller perforin för att generera porer i målcellmembranet och granzym (utlöser celldödssignalvägar) i immunsynapsen vilket leder till apoptos av cancercellerna (se figur 1).
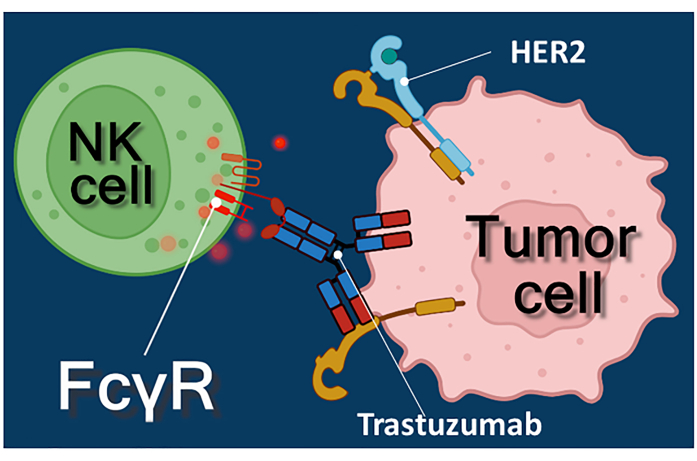
Figur 1: Effektor- och målcellinteraktioner i ADCC. Cellytan Fcγ-receptorn för effektorn NK-cellen känner igen Fc-regionen för anti-HER2-trastuzumab-antikroppen som är specifik för HER2-molekylen uttryckt på tumörcellens yta. Således etableras den så kallade immunologiska synapsen mellan de två cellerna, vilket inducerar den riktade exocytosen av cytotoxiska granuler av effektorcellen. De frisatta perforin- och granzymmolekylerna resulterar så småningom i apoptos av målcellen. Klicka här för att se en större version av denna figur.
Flera analyser har tidigare utvecklats för att kvantifiera cytotoxicitet, inklusive ADCC. Guldstandarden är den radioaktiva kromfrisättningsmetoden, där målcellerna märks med radioaktiv 51Cr-isotop, och ADCC kvantifieras genom att mäta radioaktivitet från supernatanten i lyserade målceller11. På grund av de uppenbara problemen på grund av strikt reglerad hantering, lagring och bortskaffande av radioaktiva farmakokoner och avfall har denna metod blivit alltmer icke-populär bland livsforskare. Dessutom är det inte heller mottagligt för applikationer med hög genomströmning. Mätning av aktiviteten hos enzymer (t.ex. laktat-dehydrogenas) som frigörs från de dödade målcellerna kan ge ett icke-radioaktivt alternativ till 51Cr-analysen12. Dessa analyser misslyckas dock med att skilja mellan mål- och effektorcelldöd. ECIS (Electric Cell-Substrate Impedance Sensing) visade sig vara lämplig för kvantifiering av ADCC13, men ECIS-utrustningen är inte tillgänglig i de flesta laboratorier och tekniken är inte kompatibel med applikationer / screening med hög genomströmning. Fluorescerande märkta celler representerar ett populärt alternativ i många cellbiologiska analyser och används ofta i flödescytometri eller plattläsarbaserade applikationer14,15,16. Dessa analyser innehåller emellertid ofta tvättsteg eller är på annat sätt inkompatibla med applikationer med hög genomströmning (t.ex. flödescytometribaserade tekniker). Vissa populära cytotoxicitetsanalyser, som i teorin bör vara lämpliga för ADCC-kvantifiering, misslyckas med att på ett tillförlitligt sätt bestämma ADCC-effektivitet13. Nyligen, med spridningen av fluorescerande konfokalmikroskopi, har bildbaserade analyser med högt innehåll blivit alltmer populära inom olika områden av biovetenskap17. Å ena sidan är cellavbildningsutrustning nu ganska allestädes närvarande, medan å andra sidan praktiskt taget oändliga morfologiska parametrar kan samlas in från de förvärvade bilderna. Därför bestämde vi oss för att utveckla en ADCC-analys med högt innehåll och visa dess lämplighet för sammansatt biblioteksscreening.
Här presenterar vi en bildbaserad ADCC-analys och demonstrerar hur denna analys kan användas för High-Content Screening (HCS) för att identifiera ADCC-modulerande föreningar. Modellen är baserad på JIMT-1 bröstkarcinommålceller, CD16.176V.NK-92 effektorceller och den humaniserade monoklonala anti-HER2-antikroppen trastuzumab. Med denna metod är det möjligt att identifiera läkemedel som kan förstärka NK-cellernas tumördödande verkan eller att få insikt i mekanismen hos NK-cellmedierad ADCC genom att identifiera små molekyler som stör ADCC. Vi föreslår att livsforskare som syftar till att kvantifiera cellmedierad cytotoxicitet med särskild hänsyn till ADCC kan dra nytta av att använda denna analys antingen för upptäcktsvetenskap eller läkemedelsutveckling. Denna analys kan vara ett alternativ om ett laboratorium har tillgång till och viss erfarenhet av fluorescerande avbildning och kvantitativ bildanalys.
Protocol
Representative Results
Discussion
ADCC-reaktionen har beskrivits för relativt länge sedan. Viktiga molekylära händelser i processen har också beskrivits19. Metoder för mätning av ADCC sträcker sig från guldstandarden radioaktivt kromfrisättningsanalys, cytoplasmatiska enzymfrisättningsanalyser till flera fluorescensbaserade flödescytometri- eller mikroplattanalyser20. En vanlig begränsning för dessa analyser är dock att de inte är mottagliga för applikationer med hög genomströmning. Tidig…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
LV fick finansiering från National Research, Development and Innovation Office-bidrag GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE och OTKA K132193, K147482. CD16.176V.NK-92 celler erhölls från Dr. Kerry S. Campbell (Fox Chase Center, Philapedlphia, PA, på uppdrag av Brink Biologics, lnc. San Diego, CA), skyddas av patent över hela världen och licensierades av Nantkwest, lnc. Författarna är tacksamma för György Vereb och Árpád Szöőr för deras hjälp med användningen av NK-92-cellinjen och för teknisk rådgivning.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
Riferimenti
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

