Brintproduktion og -udnyttelse i en membranreaktor
Summary
Membranreaktorer muliggør hydrogenering under omgivende forhold uden direkteH2-input . Vi kan spore brintproduktionen og udnyttelsen i disse systemer ved hjælp af atmosfærisk massespektrometri (atm-MS) og gaskromatografi massespektrometri (GC-MS).
Abstract
Industriel hydrogenering forbruger ~ 11 Mt fossilafledtH2-gas årligt. Vores gruppe opfandt en membranreaktor for at omgå behovet for at brugeH2-gas til hydrogeneringskemi. Membranreaktoren kilder brint fra vand og driver reaktioner ved hjælp af vedvarende elektricitet. I denne reaktor adskiller et tyndt stykke Pd et elektrokemisk brintproduktionsrum fra et kemisk hydrogeneringsrum. Pd i membranreaktoren fungerer som (i) en hydrogenselektiv membran, (ii) en katode og (iii) en katalysator for hydrogenering. Heri rapporterer vi brugen af atmosfærisk massespektrometri (atm-MS) og gaskromatografi massespektrometri (GC-MS) for at demonstrere, at en anvendt elektrokemisk bias over en Pd-membran muliggør effektiv hydrogenering udendirekte H2-indgang i en membranreaktor. Med atm-MS målte vi en hydrogengennemtrængning på 73%, hvilket muliggjorde hydrogenering af propiophenon til propylbenzen med 100% selektivitet, målt ved GC-MS. I modsætning til konventionel elektrokemisk hydrogenering, som er begrænset til lave koncentrationer af udgangsmateriale opløst i en protisk elektrolyt, muliggør den fysiske adskillelse af hydrogenproduktion fra udnyttelse i membranreaktoren hydrogenering i ethvert opløsningsmiddel eller ved enhver koncentration. Anvendelsen af høje koncentrationer og en lang række opløsningsmidler er særlig vigtig for reaktorskalerbarhed og fremtidig kommercialisering.
Introduction
Termokemiske hydrogeneringsreaktioner anvendes i ~ 20% af al kemisk syntese1. Disse reaktioner kræver store mængderH2-gas , som normalt stammer fra fossile brændstoffer, temperaturer mellem 150 °C og 600 °C og tryk op til 200 atm2. Elektrokemisk hydrogenering er en tiltalende måde at omgå disse krav og drive hydrogeneringsreaktioner ved hjælp af vand og vedvarende elektricitet3. Til konventionel elektrokemisk hydrogenering opløses et umættet råmateriale i en protisk elektrolyt i en elektrokemisk celle. Når et potentiale påføres cellen, forekommer vandoxidation ved anoden, mens hydrogenering sker ved katoden. I denne reaktionsopsætning forekommer både elektrokemisk vandoxidation og kemisk hydrogenering i det samme reaktionsmiljø. Det organiske substrat opløses i en protisk elektrolyt for at muliggøre både elektrokemisk vandopdeling og hydrogenering af råmaterialet. Nærheden af disse reaktioner kan føre til biproduktdannelse og elektrodeforurening, når reaktanten er modtagelig for nukleofile angreb, eller hvis reaktantkoncentrationen er for høj (>0,25 M)4.
Disse udfordringer fik vores gruppe til at undersøge alternative måder at elektrokemisk drive hydrogeneringsreaktioner 5,6,7. Denne søgning resulterede i brugen af en Pd-membran, som traditionelt anvendes til hydrogengasseparation8. Vi bruger det som elektrode til vandelektrolyse på den elektrokemiske reaktorside. Denne nye anvendelse af en palladiummembran muliggør fysisk adskillelse af stedet for elektrokemisk vandoxidation fra stedet for kemisk hydrogenering. Den resulterende reaktorkonfiguration har to rum: 1) et elektrokemisk rum til brintproduktion; og 2) et kemisk rum til hydrogenering (figur 1). Protoner genereres i det elektrokemiske rum ved at anvende et potentiale over Pt-anoden og Pd-membranen, som også fungerer som katoden. Disse protoner migrerer derefter til Pd-membranen, hvor de reduceres til overfladeadsorberede hydrogenatomer. Det elektrokemiske rum kan opdeles for at inkludere en valgfri kationudvekslingsmembran for at lette denne protonmigration. De overfladeadsorberede hydrogenatomer gennemsyrer gennem de interstitielle oktaedriske steder i Pd fcc-gitteret9 og dukker op på den modsatte side af membranen i hydrogeneringsrummet, hvor de reagerer med de umættede bindinger af et givet råmateriale til dannelse af hydrogenerede produkter 7,10,11,12,13,14,15,16. Pd i membranreaktoren fungerer derfor som (i) en hydrogenselektiv membran, (ii) en katode og (iii) en katalysator for hydrogenering.
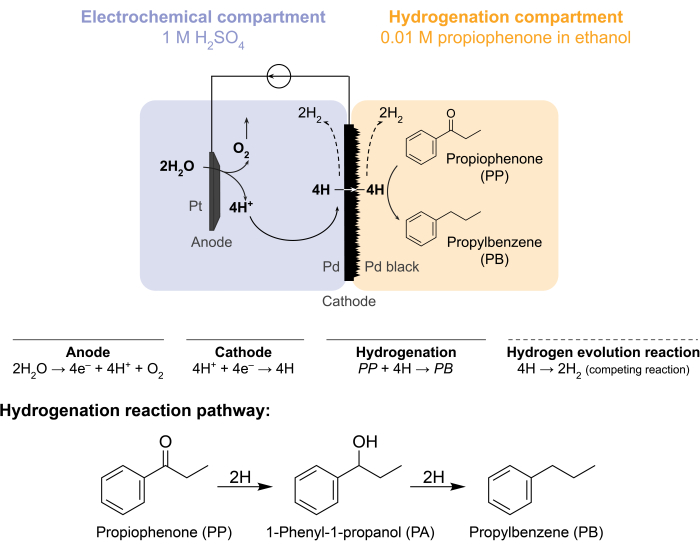
Figur 1: Hydrogenering i en membranreaktor. Vandoxidation ved anoden producerer protoner, som reduceres på palladiumkatoden. H trænger gennem Pd-membranen og reagerer med propiophen til dannelse af propylbenzen. Hydrogenevolution er en konkurrerende reaktion, der kan forekomme på begge sider af palladiummembranen. Til atmosfærisk massespektrometri anvendes der ingen kemiske råmaterialer, hvilket nødvendiggør, at H forlader reaktoren i form afH2-gas i enten det elektrokemiske rum eller hydrogeneringsrummet. Klik her for at se en større version af denne figur.
Membranreaktoren samles ved at klemme en Pd-membran mellem anode- og katoderummet i en elektrokemisk H-celle12. Kemikalieresistente O-ringe bruges til at fastgøre membranen på plads og sikre en lækagefri tætning. Det elektrokemiske rum i membranreaktoren indeholder en hydrogenrig vandig opløsning. I denne undersøgelse bruger vi 1 M H 2 SO4 og en anode, der består af en Pt-tråd indhyllet i et 5 cm2stykke platinnet. Anoden nedsænkes i elektrolytopløsningen gennem et hul i toppen af det elektrokemiske rum. Det kemiske hydrogeneringsrum indeholder et opløsningsmiddel- og hydrogeneringsråmateriale 7,10,11,12,16,17. Hullet øverst i H-cellerummet bruges til prøveudtagning. De her viste forsøg bruger 0,01 M propiophenon i ethanol som hydrogeneringsfoder. Udgangsmaterialet (og koncentrationen) kan dog varieres, så det passer til de eksperimentelle behov. For eksempel kan et udgangsmateriale, der indeholder en lang carbonhydridkæde og en alkynfunktionel gruppe, opløses i pentan for at forbedre opløseligheden11. Den tilførte strøm til reaktionen kan være mellem 5 mA / cm 2 og 300 mA / cm2. Alle reaktioner udføres under omgivelsestemperatur og tryk.
Atmosfærisk massespektrometri (atm-MS) bruges til at måle procentdelen af hydrogen i det elektrokemiske rum, der gennemsyrer hydrogeneringsrummet11,12. Denne måling er vigtig for at forstå de energitilførsler, der kræves til membranreaktoren, fordi den afslører den maksimalt mulige brintudnyttelse (dvs. hvor meget af det brint, der produceres, der faktisk kan bruges til hydrogeneringsreaktioner). Hydrogengennemtrængning gennem Pd-membranen beregnes ved at måle mængden af H2, der udvikler sig fra både det elektrokemiske rum og hydrogeneringsrummet11,12. En gennemtrængningsværdi på 100% betyder, at alt brint, der produceres i det elektrokemiske rum, transporteres gennem Pd-membranen til hydrogeneringsrummet og derefter kombineres til dannelse af hydrogengas. En gennemtrængningsværdi på <100% betyder, at hydrogenudvikling sker i det elektrokemiske rum, før det gennemsyrer membranen. DaH2 fremstilles fra enten det elektrokemiske rum eller hydrogeneringsrummet, kommer det ind i instrumentet og ioniseres tilH2+. Quadrupol vælger fragmenter af m / z = +2, og den tilsvarende ladning måles af detektoren. Plottet opnået ved denne teknik er den ioniske ladning over tid. Den ioniske ladning måles først for hydrogeneringsrummet, og når signalet stabiliseres, ændres kanalerne for at måle det elektrokemiske rum. Hydrogengennemtrængning beregnes ved at dividere den gennemsnitlige ioniske ladning i hydrogeneringsrummet med den samlede ioniske ladning målt i reaktoren (ligning 1)11,12. For at beregne hydrogengennemtrængning målesH2 fra hydrogenerings- og elektrokemiske rum separat ved anvendelse af atm-MS.
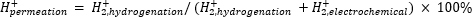 (Eq. 1)
(Eq. 1)
Gaskromatografi massespektrometri (GC-MS) bruges til at overvåge udviklingen af hydrogeneringsreaktionen12,14,15,16. For at indsamle data for eksemplet fyldes reaktorens hydrogeneringsrum med 0, 01 M propiophenon i ethanol. Ved at anvende et potentiale på tværs af Pt-anoden og Pd-katoden tilføres reaktivt hydrogen til hydrogeneringsrummet. De reaktive hydrogenatomer hydrogenerer derefter det umættede råmateriale, og produkterne kvantificeres ved hjælp af GC-MS, hvor prøven fragmenteres og ioniseres. Ved at analysere massen af disse fragmenter kan sammensætningen af hydrogeneringsopløsningen bestemmes, og reaktionshastigheder kan beregnes12,14,15,16.
Protocol
Representative Results
Discussion
PD-membranen muliggør hydrogengennemtrængning og kemisk hydrogenering. Fremstillingen af denne membran er derfor vigtig for membranreaktorens effektivitet. Pd-membranstørrelsen, krystallografien og overfladen er indstillet til at forbedre de eksperimentelle resultater. Selvom Pd-metal kan udvikle brint i enhver tykkelse, rulles Pd-membranerne til 25 μm. Denne standardisering af membrantykkelse sikrer, at den tid, det tager for brint at trænge gennem membranen, er konstant for alle eksperimenterne. Desuden er jo tynd…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Vi er taknemmelige for Canadian Natural Sciences and Engineering Research Council (RGPIN-2018-06748), Canadian Foundation for Innovation (229288), Canadian Institute for Advanced Research (BSE-BERL-162173) og Canada Research Chairs for økonomisk støtte. Denne forskning blev gennemført delvis takket være finansiering fra Canada First Research Excellence Fund, Quantum Materials and Future Technologies Program. Vi takker Ben Herring på UBC Shared Instrument Facility for hjælp med GC-MS instrument- og metodeudvikling. Vi takker Dr. Monika Stolar for bidrag til udviklingen og redigeringen af dette manuskript. Endelig takker vi hele Berlinguette-gruppen ved University of British Columbia for deres fortsatte støtte og samarbejde i studiet af membranreaktoren.
Materials
| Ag/AgCl Reference Electrode | BASi research products | MW-2021 | Reference electrode |
| Analytical Balance | Cole-Parmer | RK-11219-03 | Instrument |
| Atmospheric Mass Spectrometer | ESS CatalySys | NA | Instrument |
| Bench Power Supply | Newark | 1550 | Instrument |
| Conductive Copper Foil Electrical Tape | McMaster Carr | 76555A711 | Electrochemical cell assembly |
| Dichloromethane | Sigma Aldrich | 270997 | Reagent |
| Electric Rolling Press with Dual Micrometer | MTI Corporation | MR100A | Equipment |
| Electrochemical glass H-cell | University of British Columbia glass blowing | NA | Electrochemical cell assembly |
| ESS catalysis QUADSTAR | ESS CatalySys | NA | Software |
| Ethanol | Sigma Aldrich | 493511 | Reagent |
| Flat Rolling Mill | Pepetolls | 18700A | Equipment |
| Gas Chromatography Mass Spectrometer | Agilent | NA | Instrument |
| GC-MS vial | Agilent | 5067-0205 | Vial for GC-MS |
| Hexanes | Sigma Aldrich | 1.0706 | Reagent |
| Hydrochloric Acid | Sigma Aldrich | 258148 | Reagent |
| Hydrogen peroxide solution (30% v/v) | Sigma Aldrich | H1009 | Reagent |
| Isopropyl Alcohol | Sigma Aldrich | W292907 | Reagent |
| Masshunter Aquisition Software | Agilent | G1617FA | Software |
| Micropipette (100 µL – 1000 µL) | Gilson | F123602 | instrument |
| Micropipette (20 µL – 200 µL) | Gilson | F123601 | Instrument |
| Mitutoyo Digital Micrometer | Uline | H-2780 | Instrument |
| Muffle Furnace | MTI Corporation | KSL-1100X | Equipment |
| Nitric acid | Sigma Aldrich | 438073 | Reagent |
| Nitrogen gas | Sigma Aldrich | 608661 | Reagent |
| Palladium (II) Chloride | Sigma Aldrich | 520659 | Reagent |
| Pd wafer bar, 1 oz, 99.95% | Silver Gold Bull. | NA | Reagent |
| Platinum Auxiliary Electrode | BASi research products | MW-1032 | Anode |
| Potentiostat | Metrohm | PGSTAT302N | Instrument |
| Propiophenone | Sigma Aldrich | P51605 | Reagent |
| Proton Exchange Membrane, Nafion 212 | Fuel cell store | NA | Electrochemical cell assembly |
| Sulfuric acid | Sigma Aldrich | 258105 | Reagent |
Riferimenti
- Rytter, E., Hillestad, M., Austbø, B., Lamb, J. J., Sarker, S., Lamb, J. J., Pollet, B. G. Chapter six – Thermochemical production of fuels. Hydrogen, Biomass and Bioenergy. , 89-117 (2020).
- Arpe, H. -. J. . Industrial Organic Chemistry. , (2017).
- Orella, M. J., Román-Leshkov, Y., Brushett, F. R. Emerging opportunities for electrochemical processing to enable sustainable chemical manufacturing. Current Opinion in Chemical Engineering. 20, 159-167 (2018).
- May, A. S., Biddinger, E. J. Strategies to control electrochemical hydrogenation and hydrogenolysis of furfural and minimize undesired side reactions. ACS Catalysis. 10 (5), 3212-3221 (2020).
- Tang, B. Y., Bisbey, R. P., Lodaya, K. M., Toh, W. L., Surendranath, Y. Reaction environment impacts charge transfer but not chemical reaction steps in hydrogen evolution catalysis. ChemRxiv. , (2022).
- Iwakura, C., Yoshida, Y., Inoue, H. A new hydrogenation system of 4-methylstyrene using a palladinized palladium sheet electrode. Journal of Electroanalytical Chemistry. 431 (1), 43-45 (1997).
- Inoue, H., Abe, T., Iwakura, C. Successive hydrogenation of styrene at a palladium sheet electrode combined with electrochemical supply of hydrogen. Chemical Communications. , 55-56 (1996).
- Conde, J. J., Maroño, M., Sánchez-Hervás, J. M. Pd-based membranes for hydrogen separation: Review of alloying elements and their influence on membrane properties. Separation and Purification Reviews. 46 (2), 152-177 (2017).
- Wicke, E., Brodowsky, H., Züchner, H., Alefeld, G., VÖlkl, J. Hydrogen in palladium and palladium alloys. Hydrogen in Metals II. Topics in Applied Physics., edited by Alefeld, G., Völkl, J. 29, (1978).
- Sato, T., Sato, S., Itoh, N. Using a hydrogen-permeable palladium membrane electrode to produce hydrogen from water and hydrogenate toluene. International Journal Hydrogen Energy. 41 (12), 5419-5427 (2016).
- Sherbo, R. S., Delima, R. S., Chiykowski, V. A., MacLeod, B. P., Berlinguette, C. P. Complete electron economy by pairing electrolysis with hydrogenation. Nature Catalysis. 1, 501-507 (2018).
- Sherbo, R. S., Kurimoto, A., Brown, C. M., Berlinguette, C. P. Efficient electrocatalytic hydrogenation with a palladium membrane reactor. Journal of American Chemical Society. 141 (19), 7815-7821 (2019).
- Kurimoto, A., Sherbo, R. S., Cao, Y., Loo, N. W. X., Berlinguette, C. P. Electrolytic deuteration of unsaturated bonds without using D2. Nature Catalysis. 3, 719-726 (2020).
- Jansonius, R. P., et al. Hydrogenation without H2 using a palladium membrane flow cell. Cell Reports Physical Science. 1 (7), 100105 (2020).
- Huang, A., et al. Electrolysis can be used to resolve hydrogenation pathways at palladium surfaces in a membrane reactor. Journal of American Chemical Society Au. 1 (3), 336-343 (2021).
- Delima, R. S., et al. Selective hydrogenation of furfural using a membrane reactor. Energy and Environmental Science. 15 (1), 215-224 (2021).
- Sato, T., Takada, A., Itoh, N. Low-temperature hydrogenation of toluene by electrolysis of water with hydrogen permeable palladium membrane electrode. Chemistry Letters. 46 (4), 477-480 (2017).
- Maoka, T., Enyo, M. Overpotential decay transients and the reaction mechanism on the Pd-H2 electrode. Surface Technology. 8 (5), 441-450 (1979).
- Kurimoto, A., et al. Physical separation of H2 activation from hydrogenation chemistry reveals the specific role of secondary metal catalysts. Angewandte Chemie International Edition. 60 (21), 11937-11942 (2021).

