Выделение, характеристика и выделение общей ДНК для идентификации эндофитных грибов в микогетеротрофных растениях
Summary
Целью настоящей статьи является предоставление подробных и адекватных протоколов выделения растительно-ассоциированных эндофитных грибов, долговременной консервации изолятов, морфологической характеристики и экстракции общей ДНК для последующей молекулярной идентификации и метагеномного анализа.
Abstract
Микогетеротрофные растения представляют собой одну из самых крайних форм микоризной зависимости, полностью утратив свою автотрофную способность. Так же важны, как и любой другой жизненно важный ресурс, грибы, с которыми эти растения тесно связаны, необходимы для них. Таким образом, некоторые из наиболее актуальных методов в изучении микогетеротрофных видов позволяют исследовать ассоциированные грибы, особенно те, которые обитают в корнях и подземных органах. В этом контексте обычно применяются методы идентификации культурально-зависимых и культурально-независимых эндофитных грибов. Изоляция эндофитов грибов обеспечивает средства для их морфологической идентификации, анализа их разнообразия и сохранения инокулатуры для применения в симбиотическом проращивании семян орхидей. Однако известно, что существует большое разнообразие некультивируемых грибов, населяющих ткани растений. Таким образом, методы молекулярной идентификации, не зависящие от культуры, обеспечивают более широкий охват видового разнообразия и численности. Целью данной статьи является методологическое сопровождение, необходимое для запуска двух процедур исследования: культурно-зависимой и независимой. Что касается культурально-зависимого протокола, то подробно описаны процессы сбора и хранения образцов растений от мест сбора до лабораторных помещений, а также выделение нитчатых грибов из подземных и надземных органов микогетеротрофных растений, ведение коллекции изолятов, морфологически охарактеризовать гифы методом культивирования на предметных стеклах и молекулярная идентификация грибов методом тотальной экстракции ДНК. Детальные процедуры, включающие в себя независимые от культуры методики, включают сбор образцов растений для метагеномного анализа и извлечение общей ДНК из органов ахлорофилловых растений с использованием коммерческого набора. Наконец, протоколы непрерывности (например, полимеразная цепная реакция [ПЦР], секвенирование) также предлагаются для анализа, и здесь представлены методы.
Introduction
Эндофитные грибы – это, по определению, те, которые обитают внутри органов и тканей растений при незаметных инфекциях (т.е. не причиняя вреда своему хозяину)1,2. Эти грибы могут нейтрально или благотворно взаимодействовать с растениями-хозяевами, могут обеспечивать устойчивость к патогенам и неблагоприятным условиям окружающей среды, а также могут способствовать синтезу полезных для растения соединений (например, факторов роста и других фитогормонов)1,3. Микоризные эндофиты – это грибы, которые устанавливают микоризные ассоциации с растением, принимая участие в переносе питательных веществ4. У Orchidaceae взаимодействие с микоризными эндофитами имеет основополагающее значение для прорастания семян у подавляющего большинства видов и укоренения проростков у всех растений семейства5. В таких условиях микогетеротрофные орхидеи представляют собой случай полной зависимости от своих микоризных партнеров, поскольку они зависят от переноса минеральных питательных веществ и углеродных соединений этими грибами в течение всего своегожизненного цикла. Поэтому выделение и идентификация ассоциативных грибов является фундаментальной базой при исследовании микогетеротрофных жизненных стратегий. Более того, мало что известно о роли грибных эндофитов в микогетеротрофных растениях или даже о реальном разнообразии этих грибов 7,8.
Исследование эндофитных грибов может проводиться с помощью различных методов, традиционно описываемых как независимые от культуры или зависимые, например: (а) прямое наблюдение, (б) выделение грибов и морфологическая и/или молекулярная идентификация, и (в) полная экстракция ДНК растительных тканей и молекулярная идентификация9. При непосредственном наблюдении (а) эндофитные грибы могут быть исследованы еще в недрах растительных клеток и тканей с помощью световой или электронной микроскопии9, поскольку различные протоколы микроскопии подробно описаны Pena-Passos et al.10. С помощью методов выделения (b) эндофиты грибов могут быть охарактеризованы в соответствии с их колониями, гифами и морфологией репродуктивной структуры или структуры резистентности. Кроме того, с помощью методов выделения можно проводить молекулярную идентификацию изолятов путем экстракции ДНК, амплификации молекулярных идентификационных последовательностей (штрих-кодов или отпечатков пальцев) и секвенирования11. Последний метод (c) позволяет проводить молекулярную идентификацию эндофитных грибов с помощью экстракции ДНК во внутренней части растительных тканей (метабаркодирование) с последующей подготовкой библиотеки и секвенированием12.
Кроме того, грибные изоляты могут быть применены в симбиотических испытаниях проращивания с использованием семян автотрофных или микогетеротрофных орхидей. Примером такого применения является исследование, проведенное Sisti et al.13, описывающее прорастание и начальные стадии развития протокорма у микогетеротрофной орхидеи Pogoniopsis schenckii в ассоциации с некоторыми из ее изолятов, включающих немикоризные эндофитные грибы. Применяемый протокол проращивания симбиоза подробно описан и представлен в видео Pena-Passos et al.10. Выделение грибов в ассоциации с различными органами растений позволяет по-разному исследовать природу взаимодействия растений и грибов (например, понять экологические или физиологические аспекты ассоциации, а также исследовать перенос питательных веществ от грибов к растению)9.
Методики, представленные в разделе 1, основаны на сборе образцов подземных органов, поскольку эти органы представляют наибольшие трудности при сборе и представляют большой интерес, поскольку их колонизируют микоризные эндофиты. Тем не менее, оба включенных протокола (шаги 1.1 и 1.2) могут быть применены к другим микогетеротрофным органам растений (например, корневищам, цветочным стеблям и плодам). Методика сбора, описанная на шаге 1.1, предназначена для выделения эндофитных грибов (раздел 2) для морфологической характеристики (разделы 4 и 5) и/или выделения общей ДНК для идентификации изолятов (раздел 6). С другой стороны, методология сбора, описанная в шаге 1.2, предназначена исключительно для тотальной экстракции ДНК растительных тканей для методов метабаркодирования (раздел 7). В разделе 3 представлены четыре способа хранения и консервации нитчатых грибов: два для кратковременного хранения (3-6 месяцев) и два других для длительного хранения (>1 год). Морфологическая характеристика (разделы 4 и 5) может быть связана с молекулярной идентификацией для ее усиления и получения важной информации о макро- и микроморфологии грибов. На рисунке 1 обобщены коллективные методологии, описанные ниже.
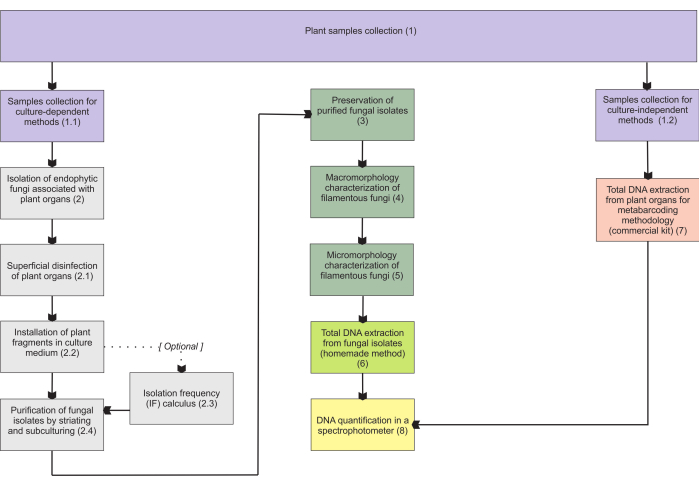
Рисунок 1: Схематическое обобщение представленных методов. Сбор растений и выделение, консервация и молекулярная идентификация растений с помощью культурно-зависимых и независимых методологий. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Поверхностная дезинсекция образцов растений является одним из наиболее ответственных этапов в представленном протоколе. Крайне желательно отсутствие загрязнений в посуде КПК каплями от последней стирки. Бактерии часто наблюдаются в качестве загрязняющих веществ в изоляционных чаш?…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Мы благодарим FAPESP (2015/26479-6) и CNPq (447453/2014-9). JLSM благодарит CNPq за гранты на повышение производительности (303664/2020-7). MPP благодарит Capes (стипендия магистратуры, процесс 88887.600591/2021-00) и CNPq.
Materials
| Adhesive tape | (from any company, for adhesive tape mount in micromorphological analyses) | ||
| Ampicillin | Sigma-Aldrich | A5354 | (for installation of plant fragments; other antibiotics may be used – check step 2.2.1) |
| Autoclave | (from any company, for materials sterilization in many steps) | ||
| Bacteriological agar | Sigma-Aldrich | A1296 | (for many steps) |
| C1, C2, C3, C4, C5, and C6 solutions | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Centrifuge | Merck/Eppendorf | 5810 G | (for total DNA extraction from fungal isolates) |
| Centrifuge tubes | Merck | CLS430828 | (for samples collection) |
| Chloroform | Sigma-Aldrich | C2432 | (for total DNA extraction from fungal isolates) |
| Congo red | Supelco | 75768 | (for hyphae staining) |
| Cryotubes | Merck | BR114831 | (for many steps) |
| Ethanol | Supelco | 100983 | It will be necessary to carry out the appropriate dilutions (for many steps) |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich | 3609 | (for total DNA extraction from fungal isolates) |
| Filter paper | Merck | WHA10010155 | (for many steps) |
| Glass test tubes | Merck | CLS7082516 | (for cryopreservation in unhulled rice grains) |
| Glass wool | Supelco | 20411 | (for cryopreservation in unhulled rice grains) |
| Glucose | Sigma-Aldrich | G8270 | Or dextrose (for cryopreservation in vermiculite) |
| Glycerol | Sigma-Aldrich | G5516 | Or glycerin (for cryopreservation in vermiculite, for preparing LPCB) |
| Isopropanol | Sigma-Aldrich | 563935 | (for total DNA extraction from fungal isolates) |
| Lactic acid | Sigma-Aldrich | 252476 | (for preparing LPCB – hyphae staining) |
| Lactophenol blue solution (LPCB) | Sigma-Aldrich | 61335 | (for hyphae staining) |
| Laminar flow hood | (class I, from any company, for many steps) | ||
| Light microscope | (from any company, for hyphae observation) | ||
| MB Spin Columns | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Methyl blue (cotton blue) | Sigma-Aldrich | M5528 | (for preparing LPCB – hyphae staining) |
| Microcentrifuge tube (1.5 mL) | Merck | HS4323 | (for total DNA extraction from fungal isolates) |
| Microcentrifuge tube (2 mL) | Merck | BR780546 | (for many steps) |
| Mineral oil | (for preservation of fungal isolates) | ||
| Paper bags | Average size 150 mm x 200 mm (for samples collection) | ||
| Petri dish (Glass, 120 mm x 20 mm) | Merck/Pyrex | SLW1480/10D | (autoclavable, for fungi slide culture, prefer higher ones) |
| Petri dish (Glass, 50 mm x 17 mm) | Merck/Aldrich | Z740618 | (for purification of fungal isolates); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Petri dish (Glass, 80 mm x 15 mm) | Merck/Brand | BR455732 | (for installation of plant fragments); alternatively: polystyrene petri dishes (sterile, γ-irradiated, non-autoclavable) |
| Phenol | Sigma-Aldrich | P1037 | (for total DNA extraction from fungal isolates, for preparing LPCB) |
| Porcelain mortar | Sigma-Aldrich | Z247464 | (for total DNA extraction from fungal isolates) |
| Porcelain pestle | Sigma-Aldrich | Z247502 | (for total DNA extraction from fungal isolates) |
| Potato dextrose agar (PDA) | Millipore | P2182 | (for many steps) |
| PowerBead tubes | Qiagen | 12888-50 | (purchased with DNeasy PowerSoil kit) |
| Rapid mounting medium (Entellan) | Sigma-Aldrich | 1.0796 | (for fungi slide culture) |
| Silica gel | Supelco | 717185 | (for cryopreservation in unhulled rice grains) |
| Sodium chloride (NaCl) | Sigma-Aldrich | S9888 | (for total DNA extraction from fungal isolates) |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771 | Lauryl sulfate sodium salt (for total DNA extraction from fungal isolates) |
| Sodium hypochlorite (w/ 2% active chlorine) | (commercial product, for superficial desinfestation) | ||
| Soil DNA extraction kit (DNeasy PowerSoil kit) | Qiagen | 12888-50 | (for total DNA extraction from plant organs) |
| Spectrophotometer – Nanodrop 2000/2000c | ThermoFisher Scientific | ND2000CLAPTOP | (for total DNA extraction from plant organs) |
| Stereomicroscope | (=dissecting microscope, from any company, for macromorphological analyses) | ||
| Tetracycline | Sigma-Aldrich | T7660 | (for installation of plant fragments) |
| Thermoblock | Merck/Eppendorf | EP5362000035 | (or from other companies) |
| Tissue homogenizer and cell lyzer | SPEX SamplePrep | 2010 Geno/Grinder – Automated Tissue Homogenizer and Cell Lyzer (for total DNA extraction from plant organs) | |
| Toluidine blue O | Sigma-Aldrich/Harleco | 364-M | (for hyphae staining) |
| Trehalose | Sigma-Aldrich | T9531 | (for cryopreservation in vermiculite) |
| Tris Base Solution (Tris) | Sigma-Aldrich | T1699 | (for total DNA extraction from fungal isolates) |
| Unhulled rice grains | (for cryopreservation) | ||
| U-shaped glass rod | (or an adaptation – check step 5.4.1, for fungi slide culture) | ||
| Vermiculite | Fine granulometry (for cryopreservation in vermiculite) | ||
| Vortexer | Sigma-Aldrich/BenchMixer | BMSBV1000 | (for total DNA extraction from fungal isolates) |
| Yeast extract | Sigma-Aldrich | Y1625 | (for cryopreservation in vermiculite) |
Riferimenti
- de Azevedo, J. L. Endophytic microorganisms. Ecologia Microbiana. , 117-137 (1998).
- Stone, J. K., Bacon, C. W., White, J. F. An overview of endophytic microbes: endophytism defined. Microbial Endophytes. , 17-44 (2000).
- Schulz, B., Boyle, C. What are Endophytes. Microbial Root Endophytes. , 1-13 (2006).
- Smith, S. E., Read, D. J. . Mycorrhizal Symbiosis. , (2008).
- Rasmussen, H. N., Dixon, K. W., Jersáková, J., Těšitelová, T. Germination and seedling establishment in orchids: a complex of requirements. Annals of Botany. 116 (3), 391-402 (2015).
- Rasmussen, H. N., Rasmussen, F. N. Orchid mycorrhiza: implications of a mycophagous life style. Oikos. 118 (3), 334-345 (2009).
- Ma, X., Kang, J., Nontachaiyapoom, S., Wen, T., Hyde, K. D. Non-mycorrhizal endophytic fungi from orchids. Current Science. 109 (1), 72-87 (2015).
- Favre-Godal, Q., Gourguillon, L., Lordel-Madeleine, S., Gindro, K., Choisy, P. Orchids and their mycorrhizal fungi: an insufficiently explored relationship. Mycorrhiza. 30 (1), 5-22 (2020).
- Sun, X., Guo, L. -. D. Endophytic fungal diversity: review of traditional and molecular techniques. Mycology. 3 (1), 65-76 (2012).
- Pena-Passos, M., Sisti, L. S., Mayer, J. L. S. Microscopy techniques for interpreting fungal colonization in mycoheterotrophic plants tissues and symbiotic germination of seeds. Journal of Visualized Experiments. (183), e63777 (2022).
- Araújo, W. L., et al. . Endophytic microorganisms: Theoretical and Practical Aspects of Isolation and Characterization. 1st ed. 1, 257 (2014).
- de Souza, R. S. C., et al. Unlocking the bacterial and fungal communities assemblages of sugarcane microbiome. Scientific Reports. 6, 28774 (2016).
- Sisti, L. S., et al. The role of non-mycorrhizal fungi in germination of the mycoheterotrophic orchid Pogoniopsis schenckii Cogn. Frontiers in Plant Science. 10, 1589 (2019).
- Araújo, W. L., et al. Variability and interactions between endophytic bacteria and fungi isolated from leaf tissues of citrus rootstocks. Canadian Journal of Microbiology. 47 (3), 229-236 (2001).
- Castellani, A. Further researches on the long viability and growth of many pathogenic fungi and some bacteria in sterile distilled water. Mycopathologia. 20 (1-2), 1-6 (1963).
- Currah, R. S., Zelmer, C. D., Hambleton, S., Richardson, K. A. Fungi from orchid mycorrhizas. Orchid Biology: Reviews and Perspectives, VII. , 117-170 (1997).
- Freitas, E. F. S., et al. Diversity of mycorrhizal Tulasnella associated with epiphytic and rupicolous orchids from the Brazilian Atlantic Forest, including four new species. Scientific Reports. 10 (1), 7069 (2020).
- Sato, M., Inaba, S., Noguchi, M., Nakagiri, A. Vermiculite as a culture substrate greatly improves the viability of frozen cultures of ectomycorrhizal basidiomycetes. Fungal Biology. 124 (8), 742-751 (2020).
- Pereira, O. L., Kasuya, M. C. M., Borges, A. C., Araújo, E. F. D. Morphological and molecular characterization of mycorrhizal fungi isolated from neotropical orchids in Brazil. Canadian Journal of Botany. 83 (1), 54-65 (2005).
- Riddell, R. W. Permanent stained mycological preparations obtained by slide culture. Mycologia. 42 (2), 265-270 (1950).
- Walsh, T. J., Hayden, R. T., Larone, D. H. . Larone’s Medically Important Fungi: A Guide to Identification. , (2018).
- Microscopy: Chemical Reagents. British Mycological Society Available from: https://www.britmycolsoc.org.uk/field_mycology/microscopy/reagents (2022)
- Senanayake, I. C., et al. Morphological approaches in studying fungi: Collection, examination, isolation, sporulation and preservation. Mycosphere. 11 (1), 2678-2754 (2020).
- Slifkin, M., Cumbie, R. Congo red as a fluorochrome for the rapid detection of fungi. Journal of Clinical Microbiology. 26 (5), 827-830 (1988).
- Raeder, U., Broda, P. Rapid preparation of DNA from filamentous fungi. Letters in Applied Microbiology. 1 (1), 17-20 (1985).
- Martins, M. K., et al. Molecular characterization of endophytic microorganisms. Endophytic microorganisms: theoretical and practical aspects of isolation and characterization. 1st edition. , 189-211 (2014).
- Rayner, R. W. A Mycological Colour Chart. Commonwealth Mycological Institute. , (1970).
- Kornerup, A., Wanscher, J. H. . Methuen Handbook of Colour. Methuen handbook of colour. , (1967).
- Ridgway, R. . Color Standards and Color Nomenclature. , (1912).
- McGinnis, M. R. . Laboratory Handbook of Medical Mycology. , (2012).
- Webster, J., Weber, R. . Introduction to Fungi. , (2007).
- Sridharan, G., Shankar, A. A. Toluidine blue: A review of its chemistry and clinical utility. Journal of Oral and Maxillofacial Pathology. 16 (2), 251-255 (2012).
- Smith, D., Onions, A. H. S. A comparison of some preservation techniques for fungi. Transactions of the British Mycological Society. 81 (3), 535-540 (1983).
- Ryan, M. J., Smith, D., Jeffries, P. A decision-based key to determine the most appropriate protocol for the preservation of fungi. World Journal of Microbiology and Biotechnology. 16 (2), 183-186 (2000).
- Lalaymia, I., Cranenbrouck, S., Declerck, S. Maintenance and preservation of ectomycorrhizal and arbuscular mycorrhizal fungi. Mycorrhiza. 24 (5), 323-337 (2014).
- Zettler, L. W., Corey, L. L. Orchid mycorrhizal fungi: isolation and identification techniques. Orchid Propagation: From Laboratories to Greenhouses-Methods and Protocols. , 27-59 (2018).
- Yu, S., Wang, Y., Li, X., Yu, F., Li, W. The factors affecting the reproducibility of micro-volume DNA mass quantification in Nanodrop 2000 spectrophotometer. Optik. 145, 555-560 (2017).
- Martos, F., et al. Independent recruitment of saprotrophic fungi as mycorrhizal partners by tropical achlorophyllous orchids. New Phytologist. 184 (3), 668-681 (2009).
- Schoch, C. L., et al. Nuclear ribosomal internal transcribed spacer (ITS) region as a universal DNA barcode marker for Fungi. Proceedings of the National Academy of Sciences. 109 (16), 6241-6246 (2012).
- White, T. J., Bruns, T., Lee, S., Taylor, J. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols: A Guide to Methods and Applications. 18 (1), 315-322 (1990).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proceedings of the National Academy of Sciences. 74 (12), 5463-5467 (1977).
- Ranjard, L., et al. Characterization of bacterial and fungal soil communities by automated ribosomal intergenic spacer analysis fingerprints: biological and methodological variability. Applied and Environmental Microbiology. 67 (10), 4479-4487 (2001).
- Metzker, M. L. Sequencing technologies-the next generation. Nature Reviews Genetics. 11 (1), 31-46 (2010).

