土壌生物の活性による鉱物風化促進実験装置の設計と構築
Summary
本稿では、土壌生物の活動を通じて鉱物風化を促進すると同時に、風化を刺激することが知られている非生物的変数を操作する実験装置の構築と運用について紹介する。セットアップとサンプル分析の機能から得られた代表的な結果と、改善点について説明します。
Abstract
強化耐候性(EW)は、気候変動の緩和に貢献できる新しい二酸化炭素(CO2)除去技術です。この技術は、このプロセスを支配する非生物的変数、特に鉱物の粒径と水に溶解した酸への曝露を操作することにより、土壌中の鉱物風化の自然なプロセスを加速することに依存しています。EWは、主に無機炭素隔離を強化することにより、大気中のCO2 濃度を低減することを目的としています。これまでEWの知識は、主に鉱物の風化を刺激することが知られている非生物的変数に焦点を当てた実験を通じて得られ、生物的成分の潜在的な影響を無視してきました。バクテリア、菌類、ミミズはミネラルの風化速度を高めることが知られているが、EWの文脈での土壌生物の使用は未だに十分に研究されていない。
このプロトコルは、非生物的条件を同時に制御しながら、土壌生物による鉱物風化速度を高めるために開発された実験装置の設計と構築について説明します。このセットアップは、土壌生物の活動を維持しながら、風化速度を最大化するように設計されています。これは、岩石粉末と有機物で満たされた多数のカラムで構成され、気候チャンバーに配置され、ダウンフロー灌漑システムを介して水が適用されます。ジェリカンが入った冷蔵庫の上にカラムを配置し、浸出水を収集します。代表的な結果は、この装置が土壌生物の活性を確保し、無機炭素隔離への影響を定量化するのに適していることを示しています。浸出水の損失を最小限に抑え、恒温槽内の換気を均一に確保し、カラムの浸水を回避するという課題が残っています。この設定により、土壌生物相の活動を通じて鉱物の風化速度を高め、EWのドライバーとしての生物的および非生物的要因の影響を解きほぐすための革新的で有望なアプローチが提案されています。
Introduction
強化耐候性(EW)は、比較的新しくローテクな二酸化炭素除去(CDR)技術であり、気候変動を緩和する大きな可能性を秘めています1,2,3。この技術の原理は、土壌中の天然鉱物風化プロセスを加速し、二酸化炭素(CO2)を無機炭素(IC)3として隔離することに依存しています。強化風化は、鉱物の風化を支配する要因を人為的に最適化することにより、ICの隔離を増加させ、それによって風化が人間に関連する時間スケールで発生する速度を高めることを目的としています3。EWを最も効果的にするためには、速風化ケイ酸塩鉱物をマイクロメートルからミリメートルの範囲の粒度分布の粉末に粉砕して、~1 m2·g-1の範囲3,4の高い反応表面積に到達します。
これまでのところ、EWに関する知識は、主に鉱物が溶解する速度を支配する非生物的要因に焦点を当てた実験によって提供されてきました5。これらには、ミネラルの反応性と表面積、温度、溶液組成、水の滞留時間、および酸性度4,6,7が含まれますが、この文脈で研究を行う必要があります。非生物的要因の影響を受けるだけでなく、特に自然システム、特に土壌は、微生物からミミズなどのマクロ動物に至るまで、膨大な数の生物によって形成されています。いくつかの研究は、鉱物溶解の生物活性の影響をほとんどまたはまったく示していませんが8,9,10、他の研究では、バクテリア11,12、真菌13,14、ミミズ15,16などの土壌生物が証拠を提供しています鉱物の風化速度を高めることができます。したがって、生物的成分は、EW5の実際のIC隔離の可能性を理解するための鍵となる可能性があります。
土壌生物がミネラルの溶解を加速できる最初の一般的なメカニズムは、呼吸中のCO2放出を介してであり、土壌の酸性化を増加させます17。さらに、バクテリアや真菌は、プロトン、キレート、有機酸、酵素を滲み出させることでミネラルの風化を増加させる可能性があり、これらはすべてミネラルの溶解を促進します18,19,20,21。例えば、カルボキシル基とヒドロキシル基によるキレート化は、イオンの不均衡を引き起こし、元素を鉱物の表面から輸送し、飽和状態を低下させる可能性があります20,22。これにより、二次鉱物の生成が少なくなり、EWの効率が高まる可能性があります。さらに、土壌粒子を餌とすることで、ミミズの体壁の強い作用により、ミネラル粒子をより細かい粒子に分解し、利用可能な反応表面積を増やすことができる23。ミミズの腸や新鮮な糞に生息する微生物は、これらの小さな粒子をさらに攻撃し、有機酸や酵素をさらに滲出させる可能性があります24,25。ミミズは、その穴掘り活動を通じて、有機粒子とミネラル粒子の混合に寄与することに加えて、水流が飽和した細孔空間を迂回することを可能にするマクロ孔も作り出す17。これにより、水がさまざまな鉱物表面と相互作用し、水と岩石の接触率を高めることができます。
これまで、土壌生物を用いたEW率、ひいてはIC隔離を研究するための装置は構築されておらず、水投入量、温度、鉱物の種類、鉱物粒径など、関連するさまざまな非生物的条件を最適化する可能性を確保していました。ここでは、小さなメソコスモスにおける土壌生物の活動を通じてEW率を高めることを目的とした革新的なセットアップの設計と構築ステップの説明が提示されます。実験装置は、203本のカラム(長さ15 cm、直径7 cm)を25°Cの気候チャンバー(4.54 m x 2.72 m)に8週間置いたものです。203本のカラムは、18本ずつの10グループと10本ずつの2つのグループに分けられ、恒温室に収まります。10 桁の 2 つのグループのうちの 1 つを使用して、さらに 3 つの列を挿入し、ブランクとして使用します。各グループは冷蔵庫の上に置かれ、遠隔操作可能な灌漑システムによって上部に置かれ、冷蔵庫内および冷蔵庫間でさまざまな灌漑速度が可能です。各カラムの浸出水は、冷蔵庫で一定温度に保たれたジェリカンに集められます(図1)。1台の冷蔵庫でカラム群の浸出水を回収するため、1台の冷蔵庫を18本または10本のカラムからなる1つのシステムと見なすことができます。したがって、この実験セットアップの列数は、最大203列の実験要件に応じて調整できます。
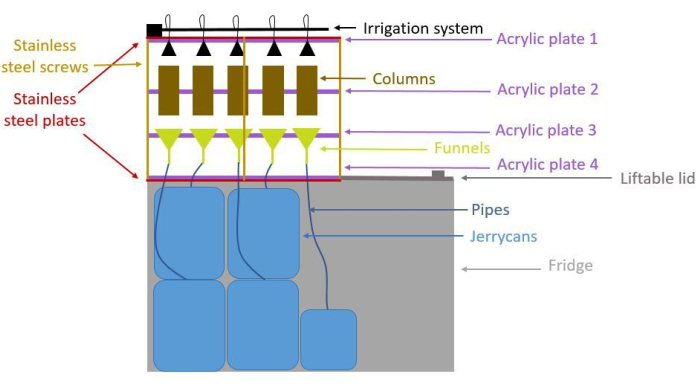
図1:5カラムを示すが、18カラムのシステムを考慮したセットアップの概略側面図。柱を固定するフレームは、ステンレス鋼板、ステンレス鋼ネジ、アクリル板でできています。柱はフレームの中央に配置され、その上に灌漑システムが置かれています。カラムの下では、漏斗がパイプを介してジェリカンに接続され、浸出水が収集されます。ジェリカンは、システム全体を保持する冷蔵庫に入っています。冷蔵庫は蓋を持ち上げることで開けることができます。この図の拡大版をご覧になるには、ここをクリックしてください。
このセットアップでは、特定の粒径のケイ酸塩岩石粉末を使用することで、高い風化速度を達成でき、特別に選択されたバクテリア、真菌、ミミズを接種することで、この人工システムでの生物活性が得られます。このセットアップでは、溶存 IC と固体 IC の両方、および全アルカリ度 (TA) を測定することにより、固体サンプルと液体サンプル中に隔離された炭素を同時に定量できます。さらに、浸出水中のpH、電気伝導率(EC)、イオンなどの他のパラメータを風化の指標として測定できます。このセットアップにより、土壌生物の生存と活動の影響を評価することもできます。代表的な結果は、風化速度の増加が非生物的要因だけでなく生物的要因にも由来するセットアップを構築するためのこのプロトコルの適合性を証明することが示されています。
Protocol
Representative Results
Discussion
現在の研究の文脈の中で、このセットアップは、土壌生物相の活動を通じて鉱物の風化を促進すると同時に、風化を刺激することで知られる非生物的要因を操作することで、無機炭素隔離を最適化するように独自に設計されています。このセットアップでは、固形処理された材料と浸出液の両方を収集できるため、両方の画分の完全な特性評価が可能になります。膨大な量のカラムにもかかわらず、サンプルの収集と実行された分析により、高品質のデータ収集が保証されます。さらに、1回の実験で多数の組み合わせを持つことは、機械学習などの最新かつ高度な統計手法で収集されたデータを分析するために非常に重要です。これらの方法を使用して、高い風化速度とさらなる炭素隔離につながる主な変数を決定できます。したがって、このセットアップは、土壌生物がEWおよびIC隔離に及ぼす影響の理解を深める機会を提供します。これは、EWの境界と大気中のCO2 濃度を低減する効率について、より現実的な制約を確立するための基本です。このセットアップは、EWと土壌生物の影響を調査した既存の研究と比較して、いくつかの独創性を示しています。
非生物的要因がEWに及ぼす影響については、以前の研究ですでに調査されています4,29,30,31,32,33,34。これらの研究のいくつかは、異なる量、種類、粒径の岩石を比較したが、そのセットアップはポット実験32,33で構成されていたか、岩粉と土壌34を混合することを含んでいた。他の実験では、灌漑速度の異なる1つの岩石タイプに焦点を当てたが、自動化されたシステムで頻繁に灌漑する可能性がなかったり、複数の灌漑速度と頻度に焦点を当てたりした35。他の研究では、現在のプロトコルで提示されているものと同様のセットアップが提示されており、岩石粒のサイズとタイプを変化させることに加えて、灌漑速度を調整し、温度を一定に保つ可能性があります29,30。さらに、これらのセットアップの設計は、本稿で提案されているものに匹敵し、さらなる分析のために浸出水を収集するように設計されました29,30。さらに、CO2濃度は、風化を促進する別の要因として、これらの研究で変化しました29。しかし、これらの先行研究はいずれも、EWの促進に対する生物的要因の影響に焦点を当てていませんでした。このセットアップでは、特定のバクテリア、真菌、ミミズに接種し、それらがEWをどの程度加速できるかを決定することにより、風化プロセスを強化し、さらにIC隔離を強化することを目的としています。
EWに対する生物的要因の影響に関連して、EWに特化していないが、土壌生物が鉱物の風化に影響を与えることができるかどうかを調査した研究はほとんどない。これらの研究は、主に、培地19,21、ペトリ皿36、土壌に埋められたナイロン袋14、または他の基質と混合された少量の岩粉36,37を使用して、土壌生物によって風化がどのように影響を受けるかを調査しました。このような小さなシステムやセットアップを使用すると、生物の影響を他の変数から切り離すことが困難になります。いくつかの実験では、ここで提案されているものと同様の設定を使用しましたが、規模は小さく、岩粉で満たされた柱に土壌生物38、39、40を接種しました。しかし、これらの実験は植物を同時に生やし、特定の土壌生物の排他的な効果に焦点を当てていなかったか13,35、または浸出水36を収集しませんでした。さらに、バクテリア、真菌、ミミズがミネラルの風化を増加させることを示した研究のほとんどは、IC隔離ではなく、風化の指標として栄養素の放出に対するこれらの生物の影響に焦点を当てています11,13,14,19,36,37,38.とりわけ、これらの初期の研究のどれもEWを促進することを目的としておらず、実験期間を通じて非生物的要因を調整し維持する可能性を提示していませんでした。このセットアップでは、すべての非生物的要因を一定に保つ代わりに、土壌生物の活動を通じてEWを促進することを目的として、水の灌漑速度と頻度、岩石粉末の種類、粒径などの4つの非生物的要因について多数の組み合わせがテストされます。
さらに、非生物的要因または生物的要因がEWに及ぼす影響に焦点を当てた以前の研究では、1回の実験実行で非常に多くの列と変数が存在する可能性を提示していませんでした。このセットアップでは、セットアップが設計されているカラム数が非常に多いため、1回の実験でさまざまな変数の複数の異なる組み合わせをテストできますが、高品質の結果が得られます。セットアップの斬新さを考慮して、将来の同様のセットアップを設計する際に考慮できるいくつかの可能な改善点と残りの課題を以下に示します。
インキュベーションチャンバー内の空気条件は均質にする必要があります。恒温槽内に設置することで、温度と相対湿度を一定に保ちました。換気の制約(例えば、空気の流れ)は、大気条件に空間的な変動性を生み出し、したがって、この種のセットアップ35で一般的な現象である、特定の場所での柱からの不均衡な蒸発につながった可能性があります。この欠点に対処するために、複製とランダム化が不可能な場合は、チャンバー全体のさまざまな場所に配置されたカラムの水収支を計算することをお勧めします。
浸出水の損失を防ぐために、アクリル板に挿入したら、カラムを漏斗と慎重に位置合わせする必要があります。検討した実験期間中、漏斗の誤った位置またはメッシュの目詰まりにより、カラムの底部から浸出水の損失が発生しました。蒸発と合わせて、これは、収集された浸出水が予想と比較して少なかった理由を部分的に説明できます(図13)。これらの損失を最小限に抑えるには、漏斗がカラムの下に最適に配置されていることを確認することが重要です。より幅の広い漏斗を使用することも実行可能なオプションです。この場合、アクリル板の施工時の穴の直径とアクリル板間の距離に注意する必要があります。
水が頻繁に適用される土壌柱実験では、水の流れが遅くなることが繰り返し問題になります7,30,40。提示されたセットアップで実施された実験では、場合によっては、かなり高い灌漑速度と非常に細かい鉱物粒径が使用され、最初は土壌で通常観察されるような構造を欠いていました。これにより、実験の実行中に、微細なミネラルのみを含むカラムの下部にあるメッシュの細孔が詰まった可能性があります。そのため、水がカラム内を流れる速度が十分でなかったため、カラムが浸水し、水の浸透と浸出水の収集が減少し、カラム内の無酸素状態になり、生物地球化学的プロセスに影響を与えました。この問題を軽減するには、常に一定の割合の粗い鉱物粒径と細かい鉱物粒径を混合し、100%非常に細かい鉱物粒径の混合物を避けることが重要です。別のオプションは、カラムが土壌構造の形成を開始するために一定数の湿潤/乾燥サイクルを経験できるようにし、したがって水の浸透を改善することです。また、実験開始前に、飽和・不飽和流動や保水曲線などの基本的な土壌水分動態をいくつかのメソコスモスで決定することは、ガスの流れ、ミネラル飽和状態、生物の活動の要因をよりよく理解するために有用です。
提示された実験装置は、使いやすく、簡単な設置が可能で、研究ニーズに応じて調整することができます。鉱物風化の文脈では、必要な調整を行うことで、ガスチャンバーと組み合わせて、固相および水相の炭素を特徴付けるだけでなく、気相中の炭素のダイナミクスも調べることができます。さらに、この設定は、これらの時間的ダイナミクスが風化に強く影響する可能性があるため、乾湿シーケンスによる現実的な水浸透率を研究するために使用できます41。このセットアップは、ケイ酸塩鉱物のみに焦点を当てた実験に限定されるものではなく、異なる基質を使用するカラム実験で実装できます。また、実験の必要性に応じて実験期間を短縮または延長したり、列数を変更したりできます。固体処理材料と浸出水の両方からサンプルを収集できるため、2つの成分の1つまたは両方に焦点を当てたさまざまな分析を実行できます。知識を提示するために、これは、ケイ酸塩鉱物と有機材料のみで作られたシステムで、土壌生物を使用して鉱物の風化を促進しながら、同時に非生物的条件を制御することを目的とした、並外れた数の柱でこれまでに構築された唯一のセットアップです。
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
灌漑システムの開発に尽力したトゥポラのトン・ファン・デル・ザルム氏に感謝します。さらに、TupolaのJaco Baars氏には、このセットアップの構築中に笑いと精神的なサポートをしてくれたことに感謝します。灌漑システムが機能していないときに、手動で柱に水をまくのを手伝ってくれたPeter GaramszegiとÁngel Velasco Sánchezに感謝します。また、サンプリング中に提供された協力してくれた Steven Heesterman 氏、Xuming Li 氏、Karen Morán Rivera 氏、Jonna van den Berg 氏、Kangying Xie 氏にも感謝します。Peggy Bartsch氏、Tom Jäppinen氏、Peter Nobels氏、Brent Rotgans氏、Andre van Leeuwen氏、Gerlinde Vink氏には、ラボでのご協力、サンプルの分析、実りある議論に感謝いたします。最後に、Unifarm の Jeroen Zonneveld 氏には、気候室の提供とメンテナンスに感謝します。この施設は、助成金契約964545に基づき、研究とイノベーションのための欧州連合のホライズン2020フレームワークプログラムによって資金提供されているBio-Accelerated Mineral Weathering(BAM!)プロジェクトの一環として構築されました。
Materials
| Acryl sheet plates | WSV kunststoffen BV | N/A | Used for holding columns, funnels, irrigation tubes and pipes. |
| Adapter ring | Tameson | FL2S-FM-B-014G-034G | Used ot make the system to connect the PU hose to the tap. |
| Cable ties | Gamma | 456196 | Used for holding the mesh system. |
| Citric acid | Nortembio (amazon.nl) | B01BDLOGW2 | Used for cleaning pipes and funnels. |
| CytoFLEX flow cytometer | Beckam Coulter | CytoFLEX | |
| Dishwasher soap | BOOM | 77000307.9010 | Used for cleaning the jerrycans. |
| Eight relay expansion module | Control by web | X-12s | Used to control the valves of hte irrigation system. |
| End cap | Wildkamp | 819906 | Used to close one end of the main tube of the irrigation system. |
| Fridges | HorecaGemak | DIA-BVL031/6P | Used for storing the jerrycans. |
| Funnels | Praxisdienst | 135864 | Used for directing the leachate from the columns to the jerrycans. 75 mm diamater. |
| Hand punch | Wildkamp | 719928 | Used to cut holes for small tubes in the main tube of the irrigation tube. |
| HDPE Jerrycan 10 L | Glas-shop.be | 105157 | Come with lid. Used to collect the leachate. |
| HDPE Jerrycan 5 L | Glas-shop.be | 105156 | Come with lid. Used to collect the leachate. |
| Hexagon nut | Fabory | 51080.100.001 | Used to block acryl sheets on metal screws. |
| Label printer | Brother | PT-H107B | Used for printing labels to stick on acryl sheets. |
| Ldpe irrigation pipe | Wildkamp | 15382585 | Used to make main tube of the irrigation system. |
| Luggage scale | United Entertainment | 8718274546996 | Used to weigh jerrycans. |
| Mesh 10 μm | Franz Eckert | PES-10/2 | Used for the mesh system. |
| Mesh 20 μm | Franz Eckert | PES-20/13 | Used for the mesh system. |
| Metal screws | Schroeven goothandel.nl | 100975401010 | Used to install acryl sheets. |
| Micro hose for drip irrigation | Wildkamp | 15119128 | Used to make small tubes of the irrigation system. |
| Middle ring | self-made with 3D printer | self-made with 3D printer | Used for holding the columns a few centimeters above the funnels. |
| Nosepiece | Wildkamp | 15045986 | Used to connect the solenoid valve to the irrigation pipe. |
| Nylon mesh | Sefar | N/A | 1 mm mesh used for the top of the columns to prevent earthworms' escape. |
| Plastic beads | lyondelbasell | TRC 352N C12507 | Used for the mesh system. |
| Plug-in fitting with 2 connections | Tameson | F24V5 | Used at the end of the system to end the PU hose. |
| Polycarbonate enclosure | RS | 498-5387 | Used to house the electronical compontents of the irrigation system. |
| Power cable | RS | 775-6075 | Used to connect the valves. |
| pp coupling | Wildkamp | 719780 | Used to make the system to connect the PU hose to the tap. |
| Pressure regulator | Wildkamp | 719943 | Used to make sure all small tubes were releasing same amount of water. |
| PTFE tape | GAMMA | 237001 | Used ot wrap the end of hte irrigation pipe. |
| PU hose | Tameson | PU-8-1198-50-1 | Used to connect all the valves with eath other and to the tap. |
| PVC pipes | Rubbermagazijn | 99001230 | Used for connecting the funnels to the jerrycans. |
| PVC tubes | Wildkamp | 91700 | Used to make the columns. |
| Rail power supply | RS | 145-7873 | Used to supply power to the eight relay expansion module. |
| Rubber bands | PasschierTerpo | 8714603820621 | Used to hold the mesh for earthworms. |
| Solenoid valve | Tameson | CM-DA014B020E-024DC | Used for opening and closing of the waterflow. |
| Sprinklers | self-made with 3D printer | self-made with 3D printer | Used for evenly distribute the water over the columns. |
| Stainless steel plates | 24/7 tailor steel | N/A | Used as a frame for the set-up above the fridge. |
| T-piece plug in fitting | Tameson | F25DT | Used to connect the solenoid valve to the PU hose. |
| TPU 95A material | MakerPoint | 1756 | Used to print components with 3D printer. |
| Washer carriers | Fabory | 50095.100.001 | Used to put below hexagon nut. |
| Web Enabled Controller | Control by web | X-400-I(9-28 VDC) | Used for allowing online control of the irrigation settings. |
Riferimenti
- Beerling, D. J., et al. Potential for large-scale CO2 removal via enhanced rock weathering with croplands. Nature. 583 (7815), 242-248 (2020).
- Fuss, S., et al. Negative emissions – Part 2: Costs, potentials and side effects. Environmental Research Letters. 13, 063002 (2018).
- Goll, D. S., et al. Potential CO2 removal from enhanced weathering by ecosystem responses to powdered rock. Nature Geoscience. 14 (8), 545-549 (2021).
- Hartmann, J., et al. Enhanced chemical weathering as a geoengineering strategy to reduce atmospheric carbon dioxide, supply nutrients, and mitigate ocean acidification. Reviews of Geophysics. 51 (2), 113-149 (2013).
- Vicca, S., et al. Is the climate change mitigation effect of enhanced silicate weathering governed by biological processes. Global Change Biology. 28 (3), 711-726 (2022).
- Strefler, J., Amann, T., Bauer, N., Kriegler, E., Hartmann, J. Potential and costs of carbon dioxide removal by enhanced weathering of rocks. Environmental Research Letters. 13 (3), 034010 (2018).
- te Pas, E. E., Hagens, M., Comans, R. N. Assessment of the enhanced weathering potential of different silicate minerals to improve soil quality and sequester CO2. Frontiers in Climate. 4, 954064 (2023).
- Jordan, G., Pokrovsky, O. S., Guichet, X., Schmahl, W. W. Organic and inorganic ligand effects on magnesite dissolution at 100 °C and pH = 5 to 10. Chemical Geology. 242 (3-4), 484-496 (2007).
- Shirokova, L. S., et al. Experimental study of the effect of heterotrophic bacterium (Pseudomonas reactans) on olivine dissolution kinetics in the context of CO2 storage in basalts. Geochimica et Cosmochimica Acta. 80, 30-50 (2012).
- Pokrovsky, O. S., Shirokova, L. S., Zabelina, S. A., Jordan, G., Bénézeth, P. Weak impact of microorganisms on Ca, Mg-bearing silicate weathering. npj Materials Degradation. 5, 51 (2021).
- Basak, B. B., Biswas, D. R. Influence of potassium solubilizing microorganism (Bacillus mucilaginosus) and waste mica on potassium uptake dynamics by sudan grass (Sorghum vulgare Pers.) grown under two Alfisols. Plant and Soil. 317 (1-2), 235-255 (2009).
- Gouda, S., et al. Revitalization of plant growth promoting rhizobacteria for sustainable development in agriculture. Microbiological Research. 206, 131-140 (2018).
- Burghelea, C. I., et al. Trace element mobilization during incipient bioweathering of four rock types. Geochimica et Cosmochimica Acta. 234, 98-114 (2018).
- Wild, B., Imfeld, G., Daval, D. Direct measurement of fungal contribution to silicate weathering rates in soil. Geology. 49 (9), 1055-1058 (2021).
- Hu, L., et al. Earthworm gut bacteria increase silicon bioavailability and acquisition by maize. Soil Biology and Biochemistry. 125, 215-221 (2018).
- Liu, D., Lian, B., Wang, B., Jiang, G. Degradation of potassium rock by earthworms and responses of bacterial communities in its gut and surrounding substrates after being fed with mineral. PLoS ONE. 6 (12), e28803 (2011).
- Schwartzman, D. The geobiology of weathering: a 13th hypothesis. arXiv. , (2015).
- Buss, H. L., Lüttge, A., Brantley, S. L. Etch pit formation on iron silicate surfaces during siderophore-promoted dissolution. Chemical Geology. 240 (3-4), 326-342 (2007).
- Sun, L. L., et al. Differences in the gene expressive quantities of carbonic anhydrase and cysteine synthase in the weathering of potassium-bearing minerals by Aspergillus niger. Science China Earth Sciences. 56 (12), 2135-2140 (2013).
- Van Hees, P. A. W., et al. Oxalate and ferricrocin exudation by the extramatrical mycelium of an ectomycorrhizal fungus in symbiosis with Pinus sylvestris. New Phytologist. 169 (2), 367-378 (2006).
- Xiao, L., Lian, B., Hao, J., Liu, C., Wang, S. Effect of carbonic anhydrase on silicate weathering and carbonate formation at present day CO2 concentrations compared to primordial values. Scientific Reports. 5, 7733 (2015).
- Welch, S. A., Taunton, A. E., Banfield, J. F. Effect of microorganisms and microbial metabolites on apatite dissolution. Geomicrobiology Journal. 19 (3), 343-367 (2002).
- Suzuki, Y., Matsubara, T., Hoshino, M. Breakdown of mineral grains by earthworms and beetle larvae. Geoderma. 112 (1-2), 131-142 (2003).
- Carpenter, D., Hodson, M. E., Eggleton, P., Kirk, C. The role of earthworm communities in soil mineral weathering: a field experiment. Mineralogical Magazine. 72 (1), 33-36 (2008).
- Georgiadis, A., Marhan, S., Lattacher, A., Mäder, P., Rennert, T. Do earthworms affect the fractionation of silicon in soil. Pedobiologia. 75, 1-7 (2019).
- TRBA 450 classification criteria for biological agents. Available from: https://www.baua.de/DE/Angebote/Rechtstexte-und-Technische-Regeln/Regelwerk/TRBA/TRBA-450.html (2016)
- TRBA 466 Classification of prokaryotes (bacteria and archaea) into risk groups. Available from: https://www.baua.de/EN/Service/Legislative-texts-and-technical-rules/Rules/TRBA/TRBA-466.html (2010)
- TRBA 460 Classification of fungi in risk groups. Available from: https://www.baua.de/DE/Angebote/Rechtstexte-und-Technische-Regeln/Regelwerk/TRBA/TRBA-460.html (2016)
- Amann, T., Hartmann, J. Carbon accounting for enhanced weathering. Frontiers in Climate. 4, 849948 (2022).
- Amann, T., Hartmann, J., Hellmann, R., Pedrosa, E. T., Malik, A. Enhanced weathering potentials-the role of in situ CO2 and grain size distribution. Frontiers in Climate. 4, 929268 (2022).
- Vienne, A., et al. Enhanced weathering using basalt rock powder: carbon sequestration, co-benefits and risks in a mesocosm study with Solanum tuberosum. Frontiers in Climate. 4, 869456 (2022).
- Ten Berge, H. F., et al. Olivine weathering in soil, and its effects on growth and nutrient uptake in ryegrass (Lolium perenne L.): a pot experiment. PLoS ONE. 7 (8), e42098 (2012).
- Amann, T., et al. Enhanced weathering and related element fluxes-a cropland mesocosm approach. Biogeosciences. 17 (1), 103-119 (2020).
- Dietzen, C., Harrison, R., Michelsen-Correa, S. Effectiveness of enhanced mineral weathering as a carbon sequestration tool and alternative to agricultural lime: an incubation experiment. International Journal of Greenhouse Gas Control. 74, 251-258 (2018).
- Wood, C., Harrison, A. L., Power, I. M. Impacts of dissolved phosphorus and soil-mineral-fluid interactions on CO2 removal through enhanced weathering of wollastonite in soils. Applied Geochemistry. 148, 105511 (2023).
- Carpenter, D., Hodson, M. E., Eggleton, P., Kirk, C. Earthworm induced mineral weathering: preliminary results. European Journal of Soil Biology. 43, S176-S183 (2007).
- De Souza, M. E. P., et al. Vermicomposting with rock powder increases plant growth. Applied Soil Ecology. 69, 56-60 (2013).
- Burghelea, C., et al. Mineral nutrient mobilization by plants from rock: influence of rock type and arbuscular mycorrhiza. Biogeochemistry. 124, 187-203 (2015).
- Zaharescu, D. G., et al. Ecosystem composition controls the fate of rare earth elements during incipient soil genesis. Scientific Reports. 7, 43208 (2017).
- Van Grinsven, J. J. M., Van Riemsdijk, W. H. Evaluation of batch and column techniques to measure weathering rates in soils. Geoderma. 52 (1-2), 41-57 (1992).
- Calabrese, S., et al. Nano-to global-scale uncertainties in terrestrial enhanced weathering. Environmental Science & Technology. 56 (22), 15261-15272 (2022).

