التعبير الجيني المحوري في الخلايا المستزرعة باستخدام النواقل الفيروسية المرتبطة بالغدي المؤتلف غير المنقى
Summary
يستخدم الفيروس الغدي المؤتلف (rAAV) على نطاق واسع لتوصيل الجينات السريرية وما قبل السريرية. الاستخدام الذي لا يحظى بالتقدير الكافي ل rAAVs هو النقل القوي للخلايا المستزرعة دون الحاجة إلى التنقية. بالنسبة للباحثين الجدد في rAAV ، نقدم بروتوكولا لاستنساخ كاسيت الجينات المحورة ، وإنتاج ناقلات الخام ، ونقل زراعة الخلايا.
Abstract
يمكن للنواقل الفيروسية المرتبطة بالغدي المؤتلف (rAAV) أن تحقق تعبيرا قويا ودائما عن جين التحوير دون التكامل في مجموعة واسعة من أنواع الأنسجة ، مما يجعلها خيارا شائعا لتوصيل الجينات في النماذج الحيوانية وفي البيئات السريرية. بالإضافة إلى التطبيقات العلاجية ، تعد rAAVs أداة مختبرية مفيدة لتوصيل جينات التحوير المصممة خصيصا لتلبية الاحتياجات التجريبية للباحث والأهداف العلمية في الخلايا المزروعة. تتضمن بعض الأمثلة جينات المراسل الخارجية ، وأشرطة الإفراط في التعبير ، وتداخل الحمض النووي الريبي ، والأدوات القائمة على كريسبر ، بما في ذلك تلك الخاصة بشاشات الجينوم الواسعة. تعتبر عمليات نقل rAAV أقل ضررا للخلايا من التثقيب الكهربائي أو النقل الكيميائي ولا تتطلب أي معدات خاصة أو كواشف باهظة الثمن لإنتاجها. يمكن إضافة المحللات الخام أو الوسائط المكيفة التي تحتوي على rAAVs مباشرة إلى الخلايا المستزرعة دون مزيد من التنقية لتحويل العديد من أنواع الخلايا – وهي ميزة لا تحظى بالتقدير الكافي ل rAAVs. هنا ، نقدم بروتوكولات لاستنساخ كاسيت الجينات المحورة الأساسية ونوضح كيفية إنتاج وتطبيق مستحضرات rAAV الخام على الخلايا المستزرعة. كدليل على المبدأ ، نثبت نقل ثلاثة أنواع من الخلايا لم يتم الإبلاغ عنها بعد في تطبيقات rAAV: خلايا المشيمة ، الأرومات العضلية ، والكائنات العضوية المعوية الدقيقة. نناقش الاستخدامات المناسبة لمستحضرات rAAV الخام ، وقيود rAAVs لتوصيل الجينات ، واعتبارات اختيار القفيصة. يحدد هذا البروتوكول طريقة بسيطة ومنخفضة التكلفة وفعالة للباحثين لتحقيق توصيل الحمض النووي المنتج في زراعة الخلايا باستخدام rAAV دون الحاجة إلى خطوات معايرة وتنقية شاقة.
Introduction
غالبا ما يتطلب توضيح القواعد الجزيئية للوظائف الخلوية التعبير عن الحمض النووي المعدل وراثيا في زراعة الخلايا. للتعبير عنها ، يجب أن تخترق جينات التحوير الغشاء الانتقائي للخلية وتصل إلى النواة 1,2. لذلك ، فإن القدرة على تجاوز الحواجز المادية للخلية بشكل فعال والتلاعب بعملياتها المركزية هي ضرورة لتطبيق الجينات المحورة للكشف عن ظواهر بيولوجية جديدة. يستفيد أحد الأساليب من القدرة الجوهرية للفيروسات علىتوصيل الحمض النووي الأجنبي 3,4 والتعبير عنه.
الفيروس المرتبط بالغدي (AAV) هو واحد من أصغر فيروسات الثدييات: يحتوي جينوم الحمض النووي أحادي الشريط الذي يبلغ حجمه 4.7 كيلو قاعدة (kb) على جينين ، rep (للتكرار) وغطاء (للقفيصة) ، معبأ داخل قفيصة 60-mer icosahedral قياس 25 نانومتر. تحتوي جينات rep / cap على العديد من المروجين وإطارات القراءة ومنتجات لصق التي تشفر ما لا يقل عن تسعة بروتينات فريدة مطلوبة لتكاثر الفيروس وإنتاجه وتعبئته 5,6. بالإضافة إلى ذلك ، يحتوي كلا طرفي الجينوم على هياكل ثانوية تسمى التكرارات الطرفية المقلوبة (ITRs) الضرورية لتكرار الحمض النووي وتغليف الجينوم والمعالجة النهائية أثناء النقل7،8،9،10. ولوائح الاتصالات الدولية هي عناصر الحمض النووي الوحيدة اللازمة لتعبئة الجينوم في القفيصة، وبالتالي يمكن استنساخ AAV لأغراض توصيل الجينات المحورة عن طريق استبدال جينات الممثل/الغطاء الفيروسي باختيار الباحث للعناصر التنظيمية و/أو الجينات ذات الأهمية6. يستخدم AAV المؤتلف الناتج (rAAV) ، مع جينوم ناقل مهندس (VG) ، على نطاق واسع في عيادة العلاج الجيني البشري وقد حقق نجاحات11. استخدام الناقل لا يحظى بالتقدير الكافي في المختبر. يمكن ل rAAVs تحقيق التعبير الجيني المحورة بكفاءة في الخلايا المستزرعة لتلبية الاحتياجات التجريبية للباحث12.
الطريقة الأكثر شيوعا لإنتاج rAAV هي عن طريق نقل البلازميد الثلاثي إلى خلايا HEK293 أو 293T (الشكل 1). يحتوي البلازميد الأول، الذي يطلق عليه عادة بلازميد رابطة الدول المستقلة، على جين التحوير المطلوب المحاط بلوائح الاتصالات الدولية (pAAV). اعتمادا على التطبيق ، تتوفر بلازميدات رابطة الدول المستقلة ذات العناصر المشتركة ، مثل المروجين الأقوياء أو الأدوات القائمة على كريسبر ، للشراء. والثاني هو بلازميد pRep / Cap الذي يحتوي على جينات AAV rep و cap من النوع البري المقدمة في trans – أي على بلازميد منفصل غير ITR يحتوي على بلازميد يعبر عن العناصر التنظيمية والهيكلية التي تتفاعل بعد ذلك مع بلازميد رابطة الدول المستقلة – وبالتالي يسمى البلازميد المتحول. بالإضافة إلى إحاطة VG فعليا ، يؤثر القفيصة على الانتحاء الخلوي12,13. من خلال توفير جين الغطاء الخاص بالنمط المصلي في trans ، يمكن للباحثين بسهولة زيادة كفاءة النقل إلى أقصى حد عن طريق اختيار النمط المصلي القفيصة الأمثل للخلية المستهدفة المحددة. أخيرا ، باعتباره Dependoparvovirus ، يتطلب AAV فيروسا مساعدا لتنشيط تعبير rep / cap من المروجين الفيروسيين ، والذي تحققه الجينات المساعدة الفيروسية الغدية ، المقدمة على بلازميد ثالث مثل pAdΔF614,15. بعد 72 ساعة من انتقال البلازميد الثلاثي ، يمكن إطلاق الناقل من الخلايا المنتجة إلى وسط الاستزراع عن طريق دورات التجميد / الذوبان المتكررة. ثم يتم جمع محتويات اللوحة بأكملها ، ويتم إزالة الحطام الخلوي الكبير عن طريق الطرد المركزي ؛ طاف الوسائط الناتج هو إعداد rAAV خام جاهز لعمليات النقل النهائية.
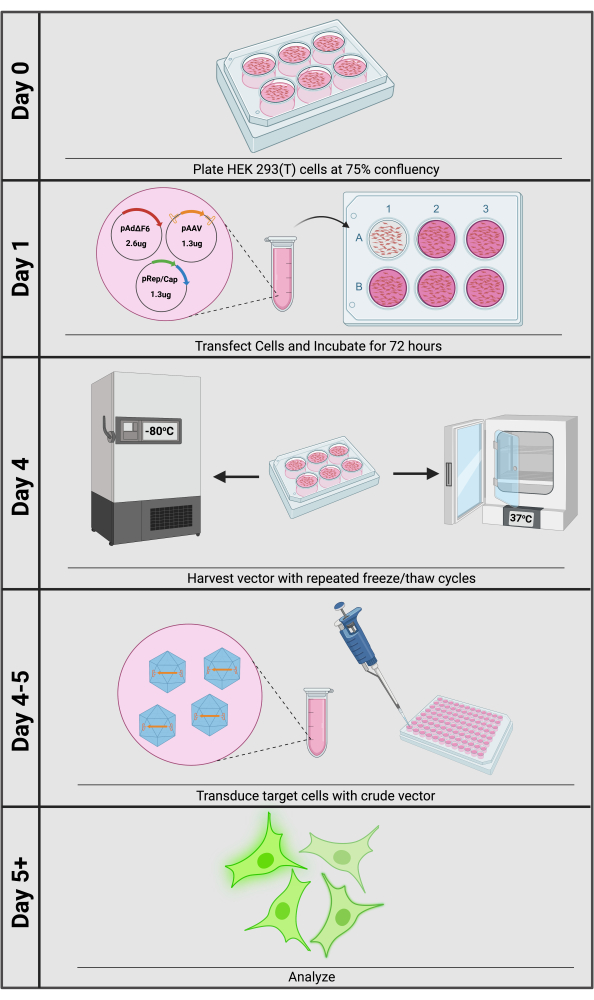
الشكل 1: نظرة عامة على إنتاج ناقلات rAAV الخام. يمكن إنجاز إنتاج ونقل الخام rAAV في غضون 5 أيام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
قد يكون rAAV أكثر ملاءمة لتوصيل الجينات المحورة مقارنة بطرق النقل الأخرى ، والتي ترتبط عادة بالسمية الخلوية ، والكفاءة المنخفضة ، والكواشف والمعدات باهظة الثمن ، مثل التثقيب الكهربائي أو النقل الكيميائي / القائم على الدهون16,17. يتجاوز rAAV هذه العقبات وغالبا ما يوفر تعبيرا قويا عن الجينات المحورة بأقل قدر من السمية ، والحد الأدنى من الوقت العملي. الأهم من ذلك ، أن إنتاج rAAV وتطبيقه في زراعة الخلايا أمر بسيط ونادرا ما يتطلب تنقية الناقل من وسائط الاستزراع (الشكل 1). بالإضافة إلى ذلك ، لا يدمج rAAV VG الخاص به في جينوم المضيف ، على عكس توصيل الجينات المحورة Lentiviral ، وبالتالي يقلل من خطر حدوث طفرات إدراجية18. على الرغم من الفوائد المحتملة لاستخدام rAAV لتوصيل الجينات المحورة ، يجب مراعاة القيود. والأهم من ذلك، ينبغي ألا يتجاوز حجم جين التحوير، بما في ذلك لوائح الاتصالات الدولية، 4,9 كيلو بايت بسبب القيود المادية للقفيصة، مما يحد من قدرة الباحث على تقديم عناصر تنظيمية كبيرة وجينات محورة بشكل فعال. علاوة على ذلك ، نظرا لأن rAAV هو فيروس غير متكامل ، فإن النقل يؤدي إلى تعبير جين التحوير العابر في الخلايا المنقسمة وقد لا يكون عمليا للتعبير المستقر. ومع ذلك ، يمكن استخدام الطرق التي تستخدم قوالب Cas9 المزدوجة التي يتم تسليمها بواسطة rAAV والإصلاح الموجه بالتماثل (HDR) لإدراج تسلسلات ثابتة في مواقع جينومية محددة إذا رغب الباحثفي 19.
Protocol
Representative Results
Discussion
استنساخ
لا يقتصر بروتوكول الاستنساخ على بلازميد pAAV.CMV.Luc.IRES.EGFP.SV40 المستخدم أعلاه ويمكن تغييره بسهولة بناء على الاحتياجات التجريبية للباحث. ويتاح شراء العديد من البلازميدات المحتوية على لوائح الاتصالات الدولية بسهولة على الإنترنت. على سبيل المثال ، تتوفر البلازميدات التي تحتوي على كل من Cas9 وموقع استنساخ sgRNA ولكنها تتطلب خطوات إضافية قليلة مثل تلدين قليل النوكليوتيد ومعالجة PNK30. وبالإضافة إلى ذلك، يمكن العثور على البلازميدات التي تحتوي على موقع استنساخ متعدد (MCS) مع لوائح الاتصالات الدولية فقط وبدون عناصر تنظيمية داخلية31. إذا كان سيتم استخدام بلازميدات مختلفة ، فإن إنزيمات القطع (RE) المستخدمة في الهضم هي عادة العناصر الوحيدة التي قد تحتاج إلى تغيير في هذا البروتوكول. ومع ذلك ، فإن أحد قيود rAAV هو سعة الشحن المحدودة. ونظرا للقيود المادية للقفيصة، ينبغي ألا يتجاوز جينوم الناقل 4,9 كيلوبايت، بما في ذلك لوائح الاتصالات الدولية.
عند عزل البلازميد عن البكتيريا ، من الأهمية بمكان استخدام مجموعة midiprep أو maxiprep منخفضة السموم الداخلية أو خالية من الماكسيريب لتخفيف الضرر الذي يلحق بالخلايا أثناء نقل البلازميد الثلاثي أو التنبيث. غالبا ما تحتوي البلازميد من مجموعات miniprep على شوائب أعلى وتركيزات منخفضة وعدد أقل من الحمض النووي فائق الالتفاف ، وكلها يمكن أن تؤثر على الإنتاج النهائي ل rAAV وبالتالي لا ينصح به.
ومن الأهمية بمكان فهم هيكل لوائح الاتصالات الدولية وخصائصها أثناء الاستنساخ. أولا، من الصعب للغاية استخدام تفاعل البوليميراز المتسلسل من خلال لوائح الاتصالات الدولية. وينبغي تجنب تصاميم الاستنساخ التي تتطلب تضخيم تفاعل البوليميراز المتسلسل من خلال لوائح الاتصالات الدولية، بالإضافة إلى الحد من استخدام تقنية استنساخ تجميع جيبسون. وعلى هذا النحو، فإن استنساخ إنزيمات التقييد هو الطريقة المفضلة للاستنساخ في البلازميدات المحتوية على لوائح الاتصالات الدولية. وعلاوة على ذلك، قد لا تكون بعض البادئات لتسلسل سانجر متوافقة إذا كانت المنطقة المتسلسلة تحتوي على لوائح الاتصالات الدولية. وبدلا من ذلك، يوصى باستخدام الأعداد الأولية التي تتسلسل بعيدا عن لوائح الاتصالات الدولية وفي جسم الجينوم المتجه للحصول على نتائج تسلسل أكثر دقة. ثانيا، تكون لوائح الاتصالات الدولية عرضة للحذف وإعادة الترتيب والطفرات عند تحويلها إلى بكتيريا لتضخيم البلازميد32,33. للتخفيف من هذه الأحداث ، يوصى باستخدام سلالات بكتيرية مختصة تعاني من نقص إعادة التركيب ، مثل Stbl3 ، واحتضانها عند 30 درجة مئوية لإبطاء الانقسامات الخلوية. وأخيرا، لوحظ أن المستعمرات الأصغر قد تتوافق مع الحيوانات المستنسخة دون إعادة ترتيب أو حذف، لأن المستعمرات التي لا تحتوي على لوائح الاتصالات الدولية قد تمنح ميزة نمو وتكون أكبر. لذلك ، يوصى باختيار مستعمرات صغيرة.
إنتاج النواقل
يمكن أن يتأثر الإنتاج الناجح لناقل rAAV بعناصر متعددة. أحد العوامل الحاسمة هو صحة خلايا HEK293 أو 293T المستخدمة في النقل. بشكل عام ، تعتبر أرقام المرور المنخفضة مثالية ، حيث قد تظهر الخلايا ذات المرور العالي اختلافات في النمط الجيني والنمط الظاهري يمكن أن تقلل من عيار rAAV. بالإضافة إلى ذلك ، يجب أن تكون كثافة الخلايا المصنفة 75٪ -90٪ التقاء للإنتاج الفعال. تولد الخلايا المتناثرة غلات متجهة منخفضة نظرا لوجود عدد أقل من الخلايا المتاحة لإنتاج النواقل ، في حين أن الخلايا المتضخمة لن يتم نقلها بكفاءة.
تساهم الاختلافات بين الكثير من الكواشف ومخزون الخلايا والتباين العام من مختبر إلى مختبر في الاختلافات في كفاءة النقل وعيار الإنتاج. أحد العوامل القابلة للتحسين التي يمكن أن تؤدي إلى تحسينات العيار هو نسبة البلازميد: PEI في تفاعلات النقل. من الأهمية بمكان استخدام PEI MAX<. يوصى باستخدام نسبة البلازميد: PEI البالغة 1: 1 كنقطة انطلاق ، وإذا بدت كفاءة النقل أو التنبيغ ضعيفة ، فاختبر عدة نسب مختلفة. يكون تحسين العيار أسهل إذا كنت تستخدم جين التحوير مع قراءة مرئية ، مثل مراسل CMV.Luc.IRES.EGFP trangene المستخدم هنا كمواد أولية للاستنساخ. لإجراء التحسين ، اتبع خطوة البروتوكول 3 باستخدام لوحة 12 بئرا وتقليل كتل البلازميد وأحجام الكاشف بمقدار اثنين (كتلة البلازميد النهائية هي 2.6 ميكروغرام). اضبط حجم PEI وفقا لذلك ليتوافق مع النسب التي تتراوح من 1: 0.75 إلى 1: 3 ، مع زيادة الزيادات بمقدار 0.25 (الشكل 6). خفف كل تفاعل باستخدام 950 ميكرولتر من وسائط SF بعد 15 دقيقة. للراحة ، يمكن عمل مزيج رئيسي يحتوي على البلازميدات الثلاثية وسحبها بشكل فردي في أنابيب سعة 1.5 مل قبل إضافة PEI-see الملف التكميلي 2. حصاد المتجه ، وتحويل الخلايا ذات الأهمية ، والصورة. يتوافق البئر ذو أعلى كفاءة نقل (نسبة خلايا GFP +) مع أعلى عيار وأفضل نسبة من PEI: DNA.
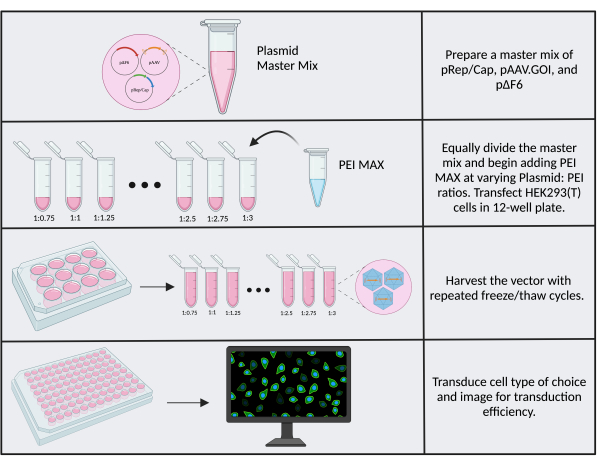
الشكل 6: سير عمل تحسين جزيرة الأمير إدوارد. رسم تخطيطي للخطوات المطلوبة لتحسين جزيرة الأمير إدوارد. نسب متعددة من البلازميد: يتم اختبار جزيرة الأمير إدوارد لتحديد النسبة المثلى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
اعتبارات الحصاد والعيار
تعمل تقنية التجميد / الذوبان المستخدمة لحصاد ناقل rAAV على تحلل خلايا HEK293 بشكل فعال بطريقة متوافقة مع الاستخدام المباشر للمحللات الموضحة لتحويل الخلايا المستزرعة. يتم إطلاق بعض الأنماط المصلية rAAV ، مثل AAV1 و AAV8 و AAV9 من الخلايا أثناء إنتاج النواقل ويمكن حصادها من وسط الخلية المستزرع دون دورات التجميد / الذوبان34. عادة ما تنتج الطريقة الموصوفة هنا عيارا بترتيب 1 × 10 10 VG / mL عند استخدام قفيصة AAV2 ، و 1 ×10 11 VG / mL ل AAV8. في حين يمكن تحقيق عيارات أعلى عن طريق المنظفات أو غيرها من التحلل الكيميائي ، إلا أنها ضارة بالخلايا في الاستخدام النهائي وتتطلب تنقية rAAVs من المحلل. العيار السفلي هو أحد المقايضات التي يجب على الباحث مراعاتها عند تحديد ما إذا كانت المستحضرات الخام مناسبة لاحتياجاته البحثية ، ومع ذلك ، فإن التتر المنخفض الهامشي الناتج عن الطرق الموضحة هنا يمكن أن يحول العديد من أنواع الخلايا بشكل جيد للغاية (انظر النتائج التمثيلية). بالإضافة إلى كفاءة النقل وصحة الخلية ، يختلف عيار النواقل اعتمادا على القفيصة المستخدمة أثناء إنتاج rAAV وحجم وتسلسل جين التحوير داخل VG35.
عند حصاد مستحضرات النواقل الخام ، قد يكون الحمض النووي البلازميد الذي تم استخدامه أثناء نقل البلازميد الثلاثي موجودا ، وعلى الرغم من ندرته ، إلا أنه يؤدي إلى نقل المصب أثناء النقل. علاوة على ذلك ، قد ترتبط VGs غير المعبأة بالجزء الخارجي من القفيصات وتستدعي استجابة مناعية فطرية للحمض النووي العاري والأجنبي أحادي الشريط36,37. لذلك ، قد تتطلب أنواع الخلايا الحساسة هضم مستحضرات النواقل DNase وتنقيتها لإزالة VGs والبلازميد غير المعبأة.
إذا رغب المرء في حساب عيار المستحضر الخام ، فيمكن إجراء qPCR لتحديد عدد VG المعبأة داخل الجسيمات المقاومة للإنزيم DNase (DRP). باختصار ، يتم هضم كمية صغيرة من المستحضر الخام DNase لإزالة الحمض النووي البلازميد ، أو تلويث الأحماض النووية ، أو VG المعبأ جزئيا. ثم تخضع العينة ل qPCR ويتم تحديد كمية VG المحمية داخل DRPs ، مما ينتج عنه عيار بوحدات جينوم متجه لكل مل من التحضير الخام38. لا يوصى بإجراء معايرة متجهة باستخدام المقايسات المستندة إلى ELISA التي تحدد كمية التتر القفيصة. بالمقارنة مع فيروس AAV من النوع البري ، يعاني rAAV من نسبة من القفيصات الفارغة والمعبأة جزئيا39. ستقوم ELISA بتحديد كمية جميع القفيصات بغض النظر عن محتويات الجينوم الخاصة بها وستبالغ في تقدير وحدات الطاقة القابلة للتحويل الموجودة في المستحضر ، الأمر الذي يتطلب VG معبأ.
اعتبارات النقل
هناك العديد من العوامل التي تؤثر على عمليات نقل rAAV ويجب وضع اعتبارات مناسبة لأي تجربة جديدة. اعتمادا على المروج الذي يقود التعبير الجيني ، يمكن أن يحدث بداية التعبير في وقت مبكر من 4 ساعات بعد النقل (hpt) ، ويتم تحقيق ذروة التعبير عادة بمقدار 48 hpt. من المهم أن تضع في اعتبارك المدة الزمنية من البذر الأولي للخلايا إلى نقطة النهاية التجريبية. هذا لتقدير التقاء بداية الخلايا والتأكد من أنها لا تنمو بشكل زائد بنهاية التجربة. إذا أصبحت الخلايا مفرطة في الالتقاء ، فقد يتغير السلوك الخلوي بسبب استجابة الإجهاد ويمكن أن يربك النتائج التجريبية. يمكن لبعض أنواع الخلايا ، مثل U2-OS ، تحمل فرط النمو / تثبيط الاتصال بشكل جيد. بالإضافة إلى ذلك ، يمكنهم تحمل فترات طويلة (48 ساعة +) في وسط مكيف خال من المصل – وهو نتاج بروتوكول الإنتاج هذا. ومع ذلك ، قد تتطلب أنواع الخلايا الحساسة إضافة مصل أو تخفيف المستحضر الخام مع وسط نمو خاص للحفاظ على الصحة أثناء النقل. تعد كفاءة النقل المنخفضة قليلا من استخدام الوسائط المحتوية على المصل مقايضة محتملة لصحة الخلايا ويجب أن يأخذها الباحث في الاعتبار.
عادة ، بالنسبة للخلايا سريعة الانقسام ، يكون التقاء البداية بنسبة 50٪ تقريبا هو الأمثل للتطبيقات التي سيتم إنهاؤها 48 hpt. ومع ذلك ، يمكن تعديل التقاء وفقا لذلك بناء على احتياجات التجربة. لا ينصح بتحويل خطوط الخلايا الخالدة من النوع أحادي الطبقة التي تزيد عن التقاء 75٪ بسبب انخفاض كفاءة النقل. يتم تحويل معظم أنواع الخلايا المستزرعة بنجاح وصحية بعد الحضانة الليلية باستخدام مستحضرات rAAV الخام ، يليها تغيير إلى الوسائط الطازجة المحتوية على المصل في الصباح.
يعد النمط المصلي للقفيصة عاملا مهما يجب مراعاته عند إنتاج rAAV لتحويل خلية مستهدفة ، حيث أن القفيصة هي المحدد الأساسي للانتحاء الخلوي والتعبير الجيني المحوري اللاحق13. AAV2 هو نمط مصلي يستخدم على نطاق واسع نظرا لقدرته على تحويل العديد من أنواع الخلايا المستزرعة بشكل فعال12. يمكن أن تعزى خاصية AAV2 هذه إلى بروتيوغليكان كبريتات الهيبارين (HSPGs) الذي يعمل كعامل ارتباط أساسي ل AAV2 والمستويات العالية من HSPGs على الخلايا المستزرعة من التكيف إلى النمو في طبق40. القفيصات الأخرى ، مثل AAV9 ، أقل فعالية في تحويل أنواع الخلايا الواسعة ويمكن تفسيرها من خلال عوامل ارتباط الاعتماد التي لم يتم التعبير عنها في هذا الإعداد41. لذلك ، نوصي باستخدام AAV2 كخيار أول قفيصة في الخلايا المستزرعة إذا لم يتم اختبار الخلية المستهدفة المرغوبة مسبقا باستخدام rAAV في الأدبيات.
يرجى ملاحظة أن أحد القيود الرئيسية على مستحضرات النواقل الخام هو أنها غير مناسبة لتحويل النماذج الحيوانية. تتطلب الدراسات في الجسم الحي تنقية المستحضرات والخضوع لتقييم الجودة.
التعبير الجيني التحوير واعتبارات التكامل المحتملة
لا تؤدي rAAVs بشكل موثوق إلى التعبير الدائم عن جين التحوير. بمرور الوقت ، يمكن إسكات VGs وقد يتم إغلاق التعبير المعدل وراثيا بعد عدة مقاطع42. بالإضافة إلى ذلك ، تظل غالبية VGs عرضية ، ولا تحتوي rAAVs على بروتينات Rep الفيروسية التي من شأنها أن تتوسط في الاندماج المتكرر في جينوم المضيف كما هو الحال في العدوى الفيروسية من النوع البري أو تعزز تكرار VGs43. ونتيجة لذلك، ستضعف الحلقات في الخلايا المستحثة في النهاية بين الخلايا البنوية من خلال الانقسامات.
التكامل على المستوى القاعدي هو إمكانية لجميع مواد الحمض النووي المعدلة وراثيا التي يتم تسليمها. ومع ذلك ، فإن VGs المحتوية على ITR عرضة للتكامل بتردد أعلى44. لذلك ، يمكن ملاحظة التعبير الدائم عن جين التحوير في مجموعة فرعية صغيرة من الخلايا. يجب على المستخدمين التفكير في هذا الاحتمال خاصة عند استخدام rAAV لتوصيل إنزيمات قطع الحمض النووي ، مثل Cas9 ، لأن الفواصل المزدوجة التي تقطعت بها السبل قد تؤدي إلى تكرار أكبر للتكامل والتعبير الدائم45. في حين أن هذا يجعل rAAV مرشحا جيدا لتقديم قوالب إصلاح موجهة بالتماثل لوضع العلامات الداخلية أو إضافة الجينات ، يجب اعتبار إمكانية إدخال Cas919,46.
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
نشكر روبرت تجيان وكزافييه دارزاك على دعمهما واستخدامهما لمعدات المختبرات. نشكر مارك كاي على هديته من بلازميدات KP1 و LK03 rep / cap ، ولوك فاندنبرغ لبلازميد AAV4 rep / cap. تم توفير التمويل من قبل معهد هوارد هيوز الطبي (34430 ، RT) ومعهد كاليفورنيا لبرنامج التدريب على الطب التجديدي EDUC4-12790. تقر NW بالتمويل من مركز بيركلي للخلايا الجذعية عبر زمالة Siebel لما بعد الدكتوراه ومن مؤسسة الأبحاث الألمانية (DFG) عبر زمالة Walter Benjamin.
Materials
| Snapgene DNA viewing sofrware | Snapgene | ||
| pAAV.CMV.Luc.IRES.EGFP.SV40 | AddGene | 105533 | |
| pAAV2/2 (Rep/Cap) | AddGene | 104963 | |
| pAdΔF6 | AddGene | 112867 | |
| LB Agar Carbenicillin | Sigma-Aldrich | L0418 | |
| Boekel Scientific Economy Digital Incubator | Boekel Scientific | 133000 | |
| LB medium, powder | MP Biomedicals | 113002042 | |
| Carbencillin (Disodium) | GoldBio | C-103-5 | |
| New Brunswick I26 Shaker | Eppendorf | M1324-0000 | |
| 50 mL Centrifuge Tubes | Corning | 430828 | |
| Centrifuge 5810 R | Eppendorf | 22627040 | |
| QIAGEN Plasmid Plus Midi Kit | Qiagen | 12945 | |
| PCR PULL-APART 8-TUBE STRIPS | USA Scientific | 1402-3900 | |
| Mastercycler nexus | Eppendorf | 6333000022 | |
| dNTP | Thermo Fisher Scientific | 18427013 | |
| 5x Phusion Buffer | NEB | B0518S | Provided with purchase of Phusion Polymerase |
| Phusion High-Fidelity DNA Polymerase | NEB | M0530S | |
| Gel Loading Dye, Orange (6X) | NEB | B7022S | |
| DNA Clean & Concentrator-100 | Zymo | D4029 | |
| Zymoclean Gel DNA Recovery Kit | Zymo | D4001 | |
| NotI-HF | NEB | R3189S | |
| EcoRI-HF | NEB | R3101S | |
| CutSmart Buffer (10x) | NEB | B6004S | Provided with purchase of restriction enzyme |
| UltraPure Agarose | Thermo Fisher Scientific | 16500100 | |
| Ethidium Bromide | Sigma-Aldrich | E1510 | |
| T4 DNA Ligase | NEB | M0202S | |
| T4 DNA Ligase Reaction Buffer | NEB | B0202S | Provided with purchase of T4 Ligase |
| Eppendorf Safe-Lock Tubes (1.5mL) | Eppendorf | 22363204 | |
| Precision Microprocessor Water Bath | Thermo Scientific | 51221046 | |
| Sterile Plastic Culture Tubes | Fisher Scientific | 149566B | |
| 2.0 mL Microcentrifuge Tube | Thomas Scientific | 1149Y01 | |
| ZR Plasmid Miniprep – Classic | Zymo | D4015 | |
| Xma1 | NEB | R0180S | |
| Sma1 | NEB | R0141S | |
| HEK 293T cells | ATCC | CRL-3216 | |
| Falcon 6-well | Corning | 353046 | |
| Gibco DMEM, high glucose, pyruvate | Thermo-Fisher | 11995065 | |
| Sanyo MCO-18AIC(UV) CO2 Incubator | Marshall Scientific | MCO-18AIC | |
| PEI MAX (Polyethylenimine Hydrochloride) | Polysciences | 24765-100 | |
| Mixer Vortex Genie 2 | Electron Microscopy Sciences | 102091-234 | |
| Sanyo Ultra Low Freezer | Sanyo | 14656-15267-16219 | |
| INCU-Line IL 10 with transparent window | VWR | 390-0384 | |
| Eppendorf Microcentrifuges | Eppendorf | 05-400-005 | |
| Falcon 96-well | Corning | 353072 | |
| C57BL/6J mice | JAX | strain #000664 | |
| organoid growth medium | STEMCELL Technologies | 6005 | |
| L Wnt-3A cells | ATCC | CRL-2647 | |
| nicotinamide | Sigma | N0636-100G | |
| ROCK inhibitor | STEMCELL Technologies | 72302 | |
| CHIR99021 | STEMCELL Technologies | 72052 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane | Fisher | 356231 | |
| 24-well plate | Fisher | 08-772-1 | |
| D-PBS | Thermo Fisher Scientific | 14-190-250 | |
| TrypLE Express | Fisher | 12604013 | |
| DMEM/F-12 with 15 mM HEPES | STEMCELL Technologies | 36254 | |
| polybrene | Millipore Sigma | TR-1003-G | |
| 48-well plates | Fisher | 08-772-3D | |
| Thermo Scientific Nunc Lab-Tek Chambered Coverglass | Fisher | 12-565-470 | |
| BeWo cells | ATCC | CCL-98 | |
| F-12K Medium | ATCC | 30-2004 | |
| Hepa1-6 | ATCC | CRL-1830 | |
| Huh7 | UC Berkeley BSD Cell Culture Facility | HUH-7 | |
| C2C12 | ATCC | CRL-1772 | |
| HSkMC | ATCC | PCS-950-010 | |
| Skeletal Muscle Cell Growth Medium | Sigma | C-23060 | |
| Skeletal Muscle Differentiation Medium | Sigma | C-23061 | |
| Invitrogen EVOS Digital Color Fluorescence Microscope | Fisher Scientific | 12-563-340 | |
| Perkin Elmer Opera Phenix | Perkin Elmer | HH14001000 | |
| PhenoPlate 96-well | Perkin Elmer | 6055302 | |
| DMEM, high glucose, no glutamine, no phenol red | Thermo-Fisher | 31053028 | |
| GlutaMAX Supplement | Thermo-Fisher | 35050079 | |
| Sodium Pyruvate | Thermo-Fisher | 11360070 | |
| pAAV2/5 (Rep/Cap) | Addgene | 104964 | |
| pAAV2/8 (Rep/Cap) | Addgene | 112864 | |
| pAAV-DJ-N589X (Rep/Cap) | Addgene | 130878 | |
| pAAV2/9n (Rep/Cap) | Addgene | 112865 | |
| pAnc80L65AAP | Addgene | 92307 | |
| KP1 (rep/cap) | gifted by Professor Mark Kay (Stanford University) | ||
| LK03 (rep/cap) | gifted by Professor Mark Kay (Stanford University) | ||
| pAAV4 (rep/cap) | gifted by Professor Luk Vandenberghe (Harvard Medical School) | ||
| pAAV.Cas9.sgRNA | Addgene | 61591 | |
| pAAV.MCS | Addgene | 46954 | |
| gBlock (synthetic DNA fragement) | IDT |
Riferimenti
- Pillay, S., et al. Corrigendum: An essential receptor for adeno-associated virus infection. Nature. 539 (7629), 456 (2016).
- Nicolson, S. C., Samulski, R. J. Recombinant adeno-associated virus utilizes host cell nuclear import machinery to enter the nucleus. Journal of Virology. 88 (8), 4132-4144 (2014).
- Lundstrom, K. Viral Vectors in Gene Therapy. Diseases. 6 (2), 42 (2018).
- Daya, S., Berns, K. I. Gene therapy using adeno-associated virus vectors. Clinical Microbiology Reviews. 21 (4), 583-593 (2008).
- Ling, C., et al. The Adeno-Associated Virus Genome Packaging Puzzle. Journal of Molecular and Genetic Medicine. 9 (3), 175 (2015).
- Maurer, A. C., Weitzman, M. D. Adeno-Associated Virus Genome Interactions Important for Vector Production and Transduction. Human Gene Therapy. 31 (9-10), 499-511 (2020).
- Srivastava, A. Replication of the adeno-associated virus DNA termini in vitro. Intervirology. 27 (3), 138-147 (1987).
- Wang, X. S., Ponnazhagan, S., Srivastava, A. Rescue and replication of adeno-associated virus type 2 as well as vector DNA sequences from recombinant plasmids containing deletions in the viral inverted terminal repeats: selective encapsidation of viral genomes in progeny virions. Journal of Virology. 70 (3), 1668-1677 (1996).
- Earley, L. F., et al. Adeno-Associated Virus Serotype-Specific Inverted Terminal Repeat Sequence Role in Vector Transgene Expression. Human Gene Therapy. 31 (3-4), 151-162 (2020).
- Yang, J., et al. Concatamerization of adeno-associated virus circular genomes occurs through intermolecular recombination. Journal of Virology. 73 (11), 9468-9477 (1999).
- Au, H. K. E., Isalan, M., Mielcarek, M. Gene Therapy Advances: A Meta-Analysis of AAV Usage in Clinical Settings. Frontiers in Medicine. 8, 809118 (2021).
- Ellis, B. L., et al. A survey of ex vivo/in vitro transduction efficiency of mammalian primary cells and cell lines with Nine natural adeno-associated virus (AAV1-9) and one engineered adeno-associated virus serotype. Virology Journal. 10, 74 (2013).
- Zincarelli, C., Soltys, S., Rengo, G., Rabinowitz, J. E. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Molecular Therapy. 16 (6), 1073-1080 (2008).
- Atchison, R. W., Casto, B. C., Hammon, W. M. Adenovirus-Associated Defective Virus Particles. Science. 149 (3685), 754-756 (1965).
- Meier, A. F., Fraefel, C., Seyffert, M. The Interplay between Adeno-Associated Virus and its Helper Viruses. Viruses. 12 (6), 662 (2020).
- Djurovic, S., Iversen, N., Jeansson, S., Hoover, F., Christensen, G. Comparison of nonviral transfection and adeno-associated viral transduction on cardiomyocytes. Molecular Biotechnology. 28 (1), 21-32 (2004).
- Batista Napotnik, T., Polajzer, T., Miklavcic, D. Cell death due to electroporation – A review. Bioelectrochemistry. 141, 107871 (2021).
- McCarty, D. M., Young, S. M., Samulski, R. J. Integration of adeno-associated virus (AAV) and recombinant AAV vectors. Annual Review of Genetics. 38, 819-845 (2004).
- Yang, Y., et al. A dual AAV system enables the Cas9-mediated correction of a metabolic liver disease in newborn mice. Nature Biotechnology. 34 (3), 334-338 (2016).
- Stacey, G. N. Cell culture contamination. Methods in Molecular Biology. 731, 79-91 (2011).
- Parks, W. P., Melnick, J. L., Rongey, R., Mayor, H. D. Physical assay and growth cycle studies of a defective adeno-satellite virus. Journal of Virology. 1 (1), 171-180 (1967).
- Bantel-Schaal, U., zur Hausen, H. Characterization of the DNA of a defective human parvovirus isolated from a genital site. Virology. 134 (1), 52-63 (1984).
- Gao, G. P., et al. Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy. Proceedings of the National Academy of Science United States of America. 99 (18), 11854-11859 (2002).
- Gao, G., et al. Clades of Adeno-associated viruses are widely disseminated in human tissues. Journal of Virology. 78 (12), 6381-6388 (2004).
- Zinn, E., et al. In Silico Reconstruction of the Viral Evolutionary Lineage Yields a Potent Gene Therapy Vector. Cell Reports. 12 (6), 1056-1068 (2015).
- Grimm, D., et al. In vitro and in vivo gene therapy vector evolution via multispecies interbreeding and retargeting of adeno-associated viruses. Journal of Virology. 82 (12), 5887-5911 (2008).
- Lisowski, L., et al. Selection and evaluation of clinically relevant AAV variants in a xenograft liver model. Nature. 506 (7488), 382-386 (2014).
- Pekrun, K., et al. Using a barcoded AAV capsid library to select for clinically relevant gene therapy vectors. JCI Insight. 4 (22), e131610 (2019).
- Colon-Thillet, R., Jerome, K. R., Stone, D. Optimization of AAV vectors to target persistent viral reservoirs. Virology Journal. 18 (1), 85 (2021).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Britton, S., Coates, J., Jackson, S. P. A new method for high-resolution imaging of Ku foci to decipher mechanisms of DNA double-strand break repair. The Journal of Cell Biology. 202 (3), 579-595 (2013).
- Bi, X., Liu, L. F. DNA rearrangement mediated by inverted repeats. Proceedings of the National Academy of Science United States of America. 93 (2), 819-823 (1996).
- Samulski, R. J., Berns, K. I., Tan, M., Muzyczka, N. Cloning of adeno-associated virus into pBR322: rescue of intact virus from the recombinant plasmid in human cells. Proceedings of the National Academy of Science United States of America. 79 (6), 2077-2081 (1982).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Sommer, J. M., et al. Quantification of adeno-associated virus particles and empty capsids by optical density measurement. Molecular Therapy. 7 (1), 122-128 (2003).
- Zhu, J., Huang, X., Yang, Y. The TLR9-MyD88 pathway is critical for adaptive immune responses to adeno-associated virus gene therapy vectors in mice. The Journal of Clinical Investigation. 119 (8), 2388-2398 (2009).
- Wagner, H., Bauer, S. All is not Toll: new pathways in DNA recognition. The Journal of Experimental Medicine. 203 (2), 265-268 (2006).
- Sanmiguel, J., Gao, G., Vandenberghe, L. H. Quantitative and Digital Droplet-Based AAV Genome Titration. Methods in Molecular Biology. 1950, 51-83 (2019).
- Grimm, D., et al. Titration of AAV-2 particles via a novel capsid ELISA: packaging of genomes can limit production of recombinant AAV-2. Gene Therapy. 6 (7), 1322-1330 (1999).
- Summerford, C., Samulski, R. J. Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. Journal of Virology. 72 (2), 1438-1445 (1998).
- Bell, C. L., et al. The AAV9 receptor and its modification to improve in vivo lung gene transfer in mice. The Journal of Clinical Investigation. 121 (6), 2427-2435 (2011).
- McCown, T. J., Xiao, X., Li, J., Breese, G. R., Samulski, R. J. Differential and persistent expression patterns of CNS gene transfer by an adeno-associated virus (AAV) vector. Brain Research. 713 (1-2), 99-107 (1996).
- Weitzman, M. D., Kyostio, S. R., Kotin, R. M., Owens, R. A. Adeno-associated virus (AAV) Rep proteins mediate complex formation between AAV DNA and its integration site in human DNA. Proceedings of the National Academy of Science United States of America. 91 (13), 5808-5812 (1994).
- Miller, D. G., Petek, L. M., Russell, D. W. Adeno-associated virus vectors integrate at chromosome breakage sites. Nature Genetics. 36 (7), 767-773 (2004).
- Hanlon, K. S., et al. High levels of AAV vector integration into CRISPR-induced DNA breaks. Nature Communications. 10 (1), 4439 (2019).
- Porteus, M. H., Cathomen, T., Weitzman, M. D., Baltimore, D. Efficient gene targeting mediated by adeno-associated virus and DNA double-strand breaks. Molecular and Cellular Biology. 23 (10), 3558-3565 (2003).

