Forberedelse og immunfluorescensfarvning af bundter og enkeltfiberceller fra cortex og kernen i øjenlinsen
Summary
Denne protokol beskriver metoder til fremstilling af perifere, modne og nukleare øjenlinsefiberceller til immunofluorescensfarvning for at studere komplekse celle-til-celle-interdigitationer og membranarkitekturen.
Abstract
Linsen er et gennemsigtigt og ellipsoid organ i øjets forreste kammer, der ændrer form for at finfokusere lys på nethinden for at danne et klart billede. Hovedparten af dette væv består af specialiserede, differentierede fiberceller, der har et sekskantet tværsnit og strækker sig fra de forreste til de bageste poler af linsen. Disse lange og tynde celler er tæt imod naboceller og har komplekse interdigitationer langs cellens længde. De specialiserede sammenlåsende strukturer er nødvendige for linsens normale biomekaniske egenskaber og er blevet grundigt beskrevet ved hjælp af elektronmikroskopiteknikker. Denne protokol demonstrerer den første metode til at bevare og immunbelette ental samt bundter af muselinsefiberceller for at muliggøre detaljeret lokalisering af proteiner i disse komplekst formede celler. De repræsentative data viser farvning af de perifere, differentierende, modne og nukleare fiberceller på tværs af alle områder af linsen. Denne metode kan potentielt anvendes på fiberceller isoleret fra linser af andre arter.
Introduction
Linsen er et klart og ovoid væv i øjets forreste kammer, der består af to celletyper, epitel- og fiberceller 1 (figur 1). Der er et monolag af epitelceller, der dækker linsens forreste halvkugle. Fiberceller er differentieret fra epitelceller og udgør hovedparten af linsen. De højt specialiserede fiberceller gennemgår en forlængelse, differentiering og modningsprogrammering, præget af forskellige ændringer i cellemembranmorfologi fra linseperiferien til linsecentret 2,3,4,5,6,7,8,9,10,11,12 , også kendt som linsekernen. Linsens funktion til finfokuslys, der kommer fra forskellige afstande på nethinden, afhænger af dets biomekaniske egenskaber, herunder stivhed og elasticitet 13,14,15,16,17,18,19. De komplekse interdigitationer af linsefibre er blevet antaget 20,21 og for nylig vist sig at være vigtige for linsestivhed 22,23.
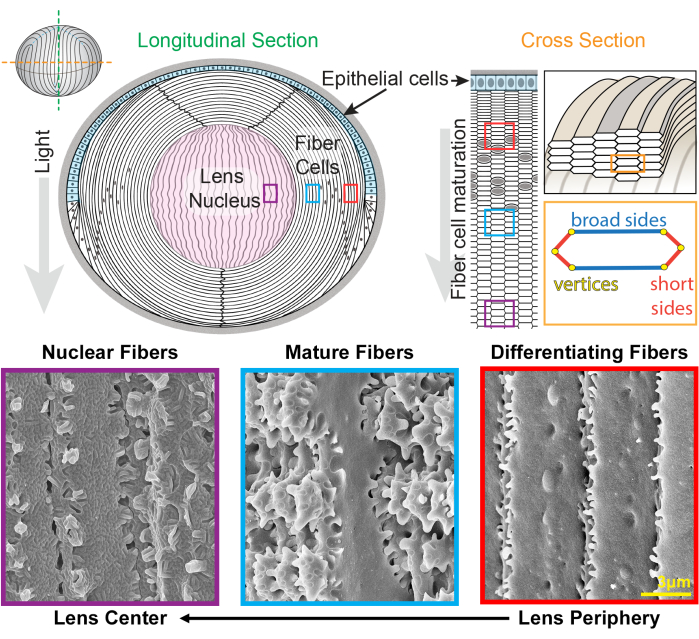
Figur 1: Linseanatomidiagrammer og repræsentative scanningelektronmikroskopibilleder (SEM) fra linsefibre. Tegneserien viser et langsgående (forreste til bageste fra top til bund) billede af det forreste monolag af epitelceller (skraveret i lyseblå) og en bulkmasse af linsefiberceller (hvid). Midten af linsen (skraveret i pink) er kendt som kernen og består af stærkt komprimerede fiberceller. Til højre afslører en tegneserie med tværsnit den aflange sekskantcelleform af linsefibre, der er pakket ind i et bikagemønster. Fiberceller har to brede sider og fire korte sider. Repræsentative SEM-billeder langs bunden viser de komplekse membraninterdigitationer mellem linsefiberceller i forskellige dybder af linsen. Fra højre har nydannede linsefibre i linseperiferien små fremspring langs de korte sider og kugler langs bredsiden (røde bokse). Under modning udvikler linsefibre store padledomæner, der er dekoreret med små fremspring langs de korte sider (blå kasser). Modne fiberceller besidder store padledomæner illustreret med små fremspring. Disse sammenkoblede domæner er vigtige for objektivets biomekaniske egenskaber. Fiberceller i linsekernen har færre små fremspring langs deres korte sider og har komplekse tunge-og-rille interdigitationer (lilla kasser). De brede sider af cellen viser en kugleformet membranmorfologi. Tegneserien blev ændret fra22,32 og ikke tegnet i skala. Skalabjælke = 3 μm. Klik her for at se en større version af denne figur.
Linsen vokser ved at tilføje skaller af nye fiberceller overlejret oven på tidligere generationer af fibre24,25. Fiberceller har en langstrakt, sekskantet tværsnitsform med to brede sider og fire korte sider. Disse celler strækker sig fra linsens forreste til bageste pol, og afhængigt af arten kan linsefibrene være flere millimeter lange. For at understøtte strukturen af disse aflange og tynde celler skaber specialiserede interdigitationer langs de brede og korte sider sammenlåsende strukturer for at opretholde linseformen og biomekaniske egenskaber. Ændringer i cellemembranform under fibercelledifferentiering og modning er blevet grundigt dokumenteret ved elektronmikroskopi (EM) undersøgelser 2,3,4,5,6,7,8,9,10,20,26,27,28,29 . Nydannede fiberceller har kugler og stikkontakter langs deres brede sider med meget små fremspring langs deres korte sider, mens modne fibre har sammenlåsende fremspring og padler langs deres korte sider. Nukleare fibre viser tunge-og-rille interdigitationer og kugleformet membranmorfologi. Lidt er kendt om de proteiner, der kræves til disse komplekse sammenlåsende membraner. Tidligere undersøgelser af proteinlokalisering i fiberceller har været afhængige af linsevævssektioner, som ikke tillader klar visualisering af den komplekse cellearkitektur.
Dette arbejde har skabt og perfektioneret en ny metode til at fiksere enkelt- og bundter af linsefiberceller for at bevare den komplekse morfologi og tillade immunfarvning for proteiner ved cellemembranen og i cytoplasmaet. Denne metode bevarer trofast cellemembranarkitektur, der kan sammenlignes med data fra EM-undersøgelser, og tillader farvning med primære antistoffer til specifikke proteiner. Vi har tidligere immunfarvede kortikale linsefibre, der gennemgår differentiering og modning22,23. I denne protokol er der også en ny metode til at plette fiberceller fra linsekernen. Denne protokol åbner døren til forståelse af mekanismerne for dannelse og ændringer i membraninterdigitationer under fibercellemodning og linsekernekomprimering.
Protocol
Representative Results
Discussion
Denne protokol har demonstreret fikserings-, konserverings- og immunfarvningsmetoderne, der trofast bevarer 3D-membranmorfologien af bundter eller entallinsefiberceller fra forskellige dybder i linsen. De farvede linsefibre sammenlignes med SEM-præparater, der længe har været brugt til at studere linsefibercellemorfologi. Resultaterne viser sammenlignelige membranstrukturer mellem begge præparater. EM forbliver guldstandarden for at studere cellemorfologi, men immunmærkning er mere udfordrende i SEM-prøver til loka…
Divulgazioni
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af tilskud R01 EY032056 (til CC) fra National Eye Institute. Forfatterne takker Dr. Theresa Fassel og Kimberly Vanderpool ved Scripps Research Core Microscopy Facility for deres hjælp med elektronmikroskopbillederne.
Materials
| 100% Triton X-100 | FisherScientific | BP151-500 | |
| 60mm plate | FisherScientific | FB0875713A | |
| 16% paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| 10X phosphate buffered saline | ThermoFisher | 70011-044 | |
| 1X phosphate buffered saline | ThermoFisher | 14190136 | |
| 48-well plate | CytoOne | CC7672-7548 | |
| Cover slips (22 x 40 mm) | FisherScientific | 12-553-467 | |
| Curved tweezers | World Precision Instruments | 501981 | |
| Dissection microscope | Carl Zeiss | Stereo Discovery V8 | |
| Fine tip straight tweezers | Electron Microscopy Sciences | 72707-01 | |
| Fisherbrand Superfrost Plus Microscope Slides | FisherScientific | 12-550-15 | |
| LSM 800 confocal microscope with Airyscan (63X) and Zen 3.5 Software | Carl Zeiss | ||
| Nail polish | |||
| Normal donkey serum | Jackson ImmunoResearch | 017-000-121 | |
| Phalloidin (rhodamine) | ThermoFisher | R415 | |
| Primary antibody | |||
| Scalpel Feather Disposable, steril, No. 11 | VWR | 76241-186 | |
| Secondary antibody | |||
| Straight forceps | World Precision Instruments | 11252-40 | |
| Thermo Scientific Nunc MicroWell MiniTrays (dissection tray) | FisherScientific | 12-565-154 | |
| Ultra-fine scissors | World Precision Instruments | 501778 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | |
| Wheat germ agglutinin (fluorescein) | Vector Laboratories | FL-1021-5 |
Riferimenti
- Lovicu, F. J., McAvoy, J. W. Growth factor regulation of lens development. Biologia dello sviluppo. 280 (1), 1-14 (2005).
- Kuszak, J., Alcala, J., Maisel, H. The surface morphology of embryonic and adult chick lens-fiber cells. The American Journal of Anatomy. 159 (4), 395-410 (1980).
- Kuszak, J. R. The ultrastructure of epithelial and fiber cells in the crystalline lens. International Review of Cytology. 163, 305-350 (1995).
- Kuszak, J. R., Macsai, M. S., Rae, J. L. Stereo scanning electron microscopy of the crystalline lens. Scanning Electron Microscopy. , 1415-1426 (1983).
- Lo, W. K., Harding, C. V. Square arrays and their role in ridge formation in human lens fibers. Journal of Ultrastructure Research. 86 (3), 228-245 (1984).
- Taylor, V. L., et al. Morphology of the normal human lens. Investigative Ophthalmology & Visual Science. 37 (7), 1396-1410 (1996).
- Vrensen, G. F. Aging of the human eye lens-a morphological point of view. Comparative Biochemistry and Physiology. Part A, Physiology. 111 (4), 519-532 (1995).
- Vrensen, G. F., Duindam, H. J. Maturation of fiber membranes in the human eye lens. Ultrastructural and Raman microspectroscopic observations. Ophthalmic Research. 27, 78-85 (1995).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rabbit. A scanning electron microscopic reinvestigation. Albrecht von Graefe’s Archive for Clinical and Experimental Opthalmology. 216 (4), 275-289 (1981).
- Willekens, B., Vrensen, G. The three-dimensional organization of lens fibers in the rhesus monkey. Graefe’s Archive for Clinical and Experimental Ophthalmology. 219 (3), 112-120 (1982).
- Zhou, C. J., Lo, W. K. Association of clathrin, AP-2 adaptor and actin cytoskeleton with developing interlocking membrane domains of lens fibre cells. Experimental Eye Research. 77 (4), 423-432 (2003).
- Kuwabara, T. The maturation of the lens cell: a morphologic study. Experimental Eye Research. 20 (5), 427-443 (1975).
- Weeber, H. A., Eckert, G., Pechhold, W., vander Heijde, R. G. Stiffness gradient in the crystalline lens. Graefe’s Archive for Clinical and Experimental Ophthalmology. 245 (9), 1357-1366 (2007).
- Weeber, H. A., et al. Dynamic mechanical properties of human lenses. Experimental Eye Research. 80 (3), 425-434 (2005).
- Weeber, H. A., vander Heijde, R. G. On the relationship between lens stiffness and accommodative amplitude. Experimental Eye Research. 85 (5), 602-607 (2007).
- Heys, K. R., Cram, S. L., Truscott, R. J. Massive increase in the stiffness of the human lens nucleus with age: the basis for presbyopia. Molecular Vision. 10, 956-963 (2004).
- Heys, K. R., Friedrich, M. G., Truscott, R. J. Presbyopia and heat: changes associated with aging of the human lens suggest a functional role for the small heat shock protein, alpha-crystallin, in maintaining lens flexibility. Aging Cell. 6 (6), 807-815 (2007).
- Glasser, A., Campbell, M. C. Biometric, optical and physical changes in the isolated human crystalline lens with age in relation to presbyopia. Vision Research. 39 (11), 1991-2015 (1999).
- Pierscionek, B. K. Age-related response of human lenses to stretching forces. Experimental Eye Research. 60 (3), 325-332 (1995).
- Biswas, S. K., Lee, J. E., Brako, L., Jiang, J. X., Lo, W. K. Gap junctions are selectively associated with interlocking ball-and-sockets but not protrusions in the lens. Molecular Vision. 16, 2328-2341 (2010).
- Lo, W. K., et al. Aquaporin-0 targets interlocking domains to control the integrity and transparency of the eye lens. Investigative Ophthalmology & Visual Science. 55 (3), 1202-1212 (2014).
- Cheng, C., et al. Tropomyosin 3.5 protects the F-actin networks required for tissue biomechanical properties. Journal of Cell Science. 131 (23), (2018).
- Cheng, C., et al. Tropomodulin 1 regulation of actin is required for the formation of large paddle protrusions between mature lens fiber cells. Investigative Ophthalmology & Visual Science. 57 (10), 4084-4099 (2016).
- Kuszak, J. R. The development of lens sutures. Progress in Retinal and Eye Research. 14 (2), 567-591 (1995).
- Bassnett, S., Costello, M. J. The cause and consequence of fiber cell compaction in the vertebrate lens. Experimental Eye Research. 156, 50-57 (2017).
- Biswas, S., Son, A., Yu, Q., Zhou, R., Lo, W. K. Breakdown of interlocking domains may contribute to formation of membranous globules and lens opacity in ephrin-A5(-/-) mice. Experimental Eye Research. 145, 130-139 (2016).
- Blankenship, T., Bradshaw, L., Shibata, B., Fitzgerald, P. Structural specializations emerging late in mouse lens fiber cell differentiation. Investigative Ophthalmology & Visual Science. 48 (7), 3269-3276 (2007).
- Cheng, C., et al. Age-related changes in eye lens biomechanics, morphology, refractive index and transparency. Aging. 11 (24), 12497-12531 (2019).
- Cheng, C., et al. EphA2 affects development of the eye lens nucleus and the gradient of refractive index. Investigative Ophthalmology & Visual Science. 63 (1), 2 (2022).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. Journal of Visualized Experiments. (111), e53986 (2016).
- Forrester, J. V., Dick, A. D., McMenamin, P. G., Roberts, F., Pearlman, E., Saunders, W. B. Anatomy of the eye and orbit. The Eye (Fourth Edition). , 1 (2016).
- Cheng, C., Nowak, R. B., Fowler, V. M. The lens actin filament cytoskeleton: Diverse structures for complex functions. Experimental Eye Research. 156, 58-71 (2017).
- Goldberg, M. W., Fiserova, J. Immunogold labeling for scanning electron microscopy. Methods in Molecular Biology. 1474, 309-325 (2016).
- Goldberg, M. W. High-resolution scanning electron microscopy and immuno-gold labeling of the nuclear lamina and nuclear pore complex. Methods in Molecular Biology. 1411, 441-459 (2016).
- Hermann, R., Walther, P., Muller, M. Immunogold labeling in scanning electron microscopy. Histochemistry and Cell Biology. 106 (1), 31-39 (1996).
- Gokhin, D. S., et al. Tmod1 and CP49 synergize to control the fiber cell geometry, transparency, and mechanical stiffness of the mouse lens. PLoS One. 7 (11), e48734 (2012).

