2.5:
주기율표
2.5:
주기율표
초기 화학자들은 더 많은 원소를 발견하면서, 다양한 원소가 유사한 화학 적 행동에 의해 그룹화 될 수 있다는 것을 깨달았습니다. 이러한 그룹화에는 리튬(리), 나트륨(Na), 칼륨(K)이 포함됩니다. 이러한 모든 원소는 반짝이며 열과 전기를 잘 수행하며 유사한 화학 적 특성을 가지고 있습니다. 두 번째 그룹화에는 칼슘(Ca), 스트론튬(Sr), 바륨(Ba)이 포함되며, 이는 또한 반짝이고 열과 전기의 좋은 도체이며, 화학적 특성을 공통으로 가지고 있습니다. 그러나 이 두 그룹화의 특정 속성은 서로 특히 다릅니다. 예를 들어, 리, Na, K는 Ca, Sr 및 Ba보다 훨씬 더 반응적입니다. 또한, 리, Na, K는 원자의 2개에서 1개의 산소 원자에 산소를 가진 화합물을 형성하는 반면, Ca, Sr 및 Ba는 원자 중 하나를 하나의 산소 원자에 화합물을 형성합니다. 불소 (F), 염소 (Cl), 브롬 (Br), 요오드 (I) 또한 서로 유사한 특성을 전시하지만, 이러한 속성은 위의 요소 중 하나와 크게 다릅니다.
러시아의 디미트리 멘델레예프(1869)와 독일의 로타르 마이어(1870)는 당시 알려진 요소들의 특성들 사이에서 주기적인 관계를 독립적으로 인정했다. 두 게시 된 테이블 모두 원자 질량 증가에 따라 배열 된 요소와 함께. 그러나 멘델레예프는 마이어보다 한 걸음 더 나아갔다. 그는 자신의 테이블을 사용하여 알루미늄과 실리콘과 유사한 특성을 가지고 있지만 아직 알려지지 않은 요소의 존재를 예측했습니다. 갈륨 (1875)과 게르마늄 (1886)의 발견은 멘델레예프의 작품에 상당한 지원을 제공했다. 멘델레예프와 마이어는 우선 순위에 대해 오랫동안 논쟁을 벌였지만, 멘델레예프가 정기테이블 개발에 기여한 것은 이제 더욱 널리 인정받고 있다.
20세기에는 주기적인 관계가 원자질량이 아닌 원자수와 관련이 있다는 것이 명백해졌다. 이 관계의 현대 문, 주기적인 법칙, 다음과 같은 상태: t그는 요소의 속성은 그들의 원자 숫자의 정기적인 기능. 최신 정기 표는 원자 수의 순서를 늘리는 요소를 정렬하고 동일한 세로 열에서 유사한 특성을 가진 원자를 그룹화합니다. 각 상자에는 요소를 나타내며 원자 번호, 기호, 평균 원자 질량 및 (때로는) 이름을 포함합니다.
요소는 마침표 또는 계열이라고 하는 7개의 가로 행과 그룹이라고 하는 18개의 수직 열로 정렬됩니다. 그룹은 각 열의 맨 위에 레이블이 지정됩니다. 테이블이 단일 페이지에 맞도록 하려면 행의 두 개 중 일부가 총 14개의 열이 일반적으로 테이블의 본문 아래에 기록됩니다.
많은 원소는 화학적 및 물리적 특성에 크게 다르지만 일부 요소는 동작과 유사합니다. 예를 들어, 많은 원소가 반짝이고, 가단성및 연성이며, 열과 전기를 잘 수행합니다. 다른 원소는 반짝이지, 가단, 또는 연성, 열과 전기의 가난한 도체입니다. 요소는 일반적인 특성을 가진 큰 클래스로 정렬 할 수 있습니다 : 금속 (반짝, 가단, 열과 전기의 좋은 도체 — 그늘진 노란색); 비금속 (열과 전기의 둔하고 가난한 도체 – 그늘진 빨간색으로 보이는 요소); 및 메탈로이드 (열과 전기를 적당히 잘 수행하고 금속의 일부 특성과 비금속의 일부 특성을 소유하는 요소 – 그늘진 보라색).
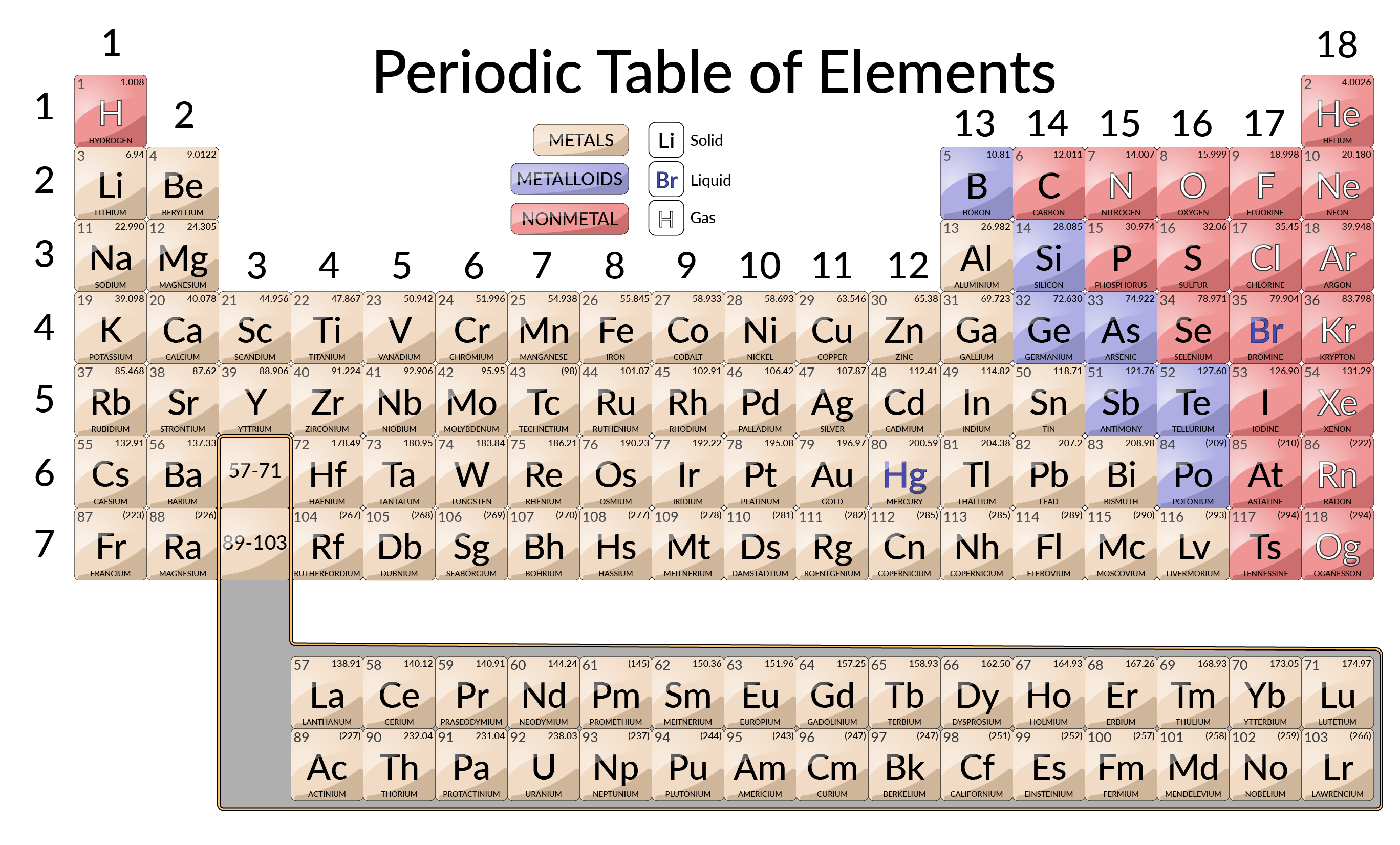
요소는 1, 2 및 13-18로 표시된 열의 주 그룹 요소(또는 대표 요소)로 분류될 수도 있습니다. 3-12로 표시된 열의 전이 금속; 테이블 하단의 두 행의 내부 전환 금속입니다. 테이블 맨 아래에 있는 맨 위 열 요소는 란탄이며 맨 아래 행 요소는 작동합니다. 원소는 형성되는 화합물의 조성과 같은 보다 구체적인 특성에 의해 더 세분화될 수 있다. 예를 들어, 그룹 1(제1 열)의 원소는 요소의 원자 하나와 수소원자 1개로 구성된 화합물을 형성한다. 이러한 원소(수소 제외)는 알칼리 금속으로 알려져 있으며 모두 유사한 화학적 특성을 가지고 있습니다. 그룹 2(두 번째 컬럼)의 원소는 요소의 원자 1개와 수소 원자 2개로 구성된 화합물을 형성합니다: 이들은 알칼리성 지구 금속이라고 하며, 이들 그룹은 그 그룹의 구성원들 사이에서 유사한 특성을 갖는다.
특정 이름을 가진 그밖 단은 pnictogens (그룹 15), 찰코겐 (그룹 16), 할로겐 (그룹 17), 및 고귀한 가스 (그룹 18, 또한 불활성 가스로 알려져 있음)입니다. 그룹은 또한 그룹의 첫 번째 요소에 의해 언급 될 수있다: 예를 들어, 찰코겐은 산소 그룹 또는 산소 가족이라고 할 수 있습니다. 수소는 그룹 1 및 그룹 17 요소와 유사한 특성을 가진 고유한 비금속 원소입니다. 이러한 이유로 수소는 두 그룹의 맨 위에 표시될 수 있습니다.
요소 43(테크네튬), 원소 61(프로메티움), 원자번호 84(폴로늄) 이상을 가진 대부분의 원소들은 제곱대에 원자질량을 부여한다. 이것은 완전히 불안정한 방사성 동위원소로 구성된 원소에 대해 수행됩니다 (방사능은 핵 화학 장에서 더 자세히 다루어집니다). 그들의 방사성 동위원소는 근원에 따라 상대적으로 풍부하게 현저하게 변화할 수 있거나, 또는 자연에 존재하지 않을 수 있기 때문에 평균 원자 중량은 이 요소에 대해 결정될 수 없습니다. 제곱 괄호의 숫자는 원자 질량 수로, 이는 해당 요소의 가장 안정적인 동위원소의 대략적인 원자 질량입니다.
