15.8:
약염기 용액
15.8:
약염기 용액
일부 화합물은 물 분자와 화학적으로 반응하여 용해 될 때 수산화 이온을 생성합니다. 모든 경우에, 이러한 화합물은 부분적으로만 반응하므로 약한 기지로 분류됩니다. 화합물의 이러한 유형은 또한 자연과 다양 한 기술에 중요 한 상품에 풍부. 예를 들어, 약한 기저 암모니아의 글로벌 생산은 전형적으로 매년 100미터톤 이상이며, 농업 비료, 다른 화합물의 화학합성을 위한 원료, 가정용 세제의 활성 성분으로 널리 사용되고 있다. 물에 용해될 때 암모니아는 여기에 표시된 것처럼 수산화 이온을 산출하기 위해 부분적으로 반응합니다.
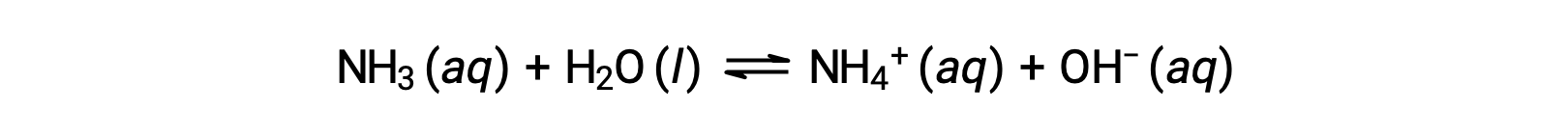
이것은, 정의에 의하면, 산염 기체 반응, 암모니아 분자에 물 분자에서 H+ 이온의 전송을 포함하는 이 경우. 일반적인 조건하에서, 용존암의 약 1%만이 NH4+ 이온으로 존재한다.
약한 베이스 솔루션에서 수산화이온 농도 및 pOH 계산
수산화 이온의 농도찾기, pOH, 및 0.25M 용액의 트리메틸라민, 약한 염기의 pH를 찾아보세요.
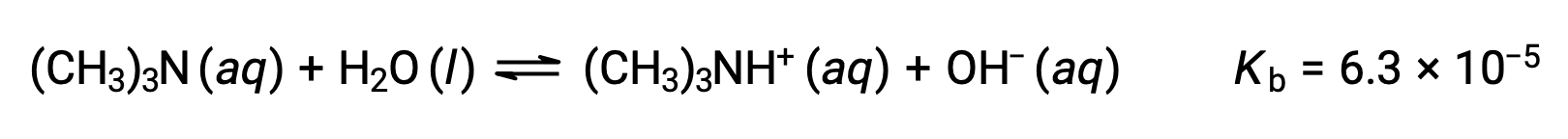
이 시스템의 ICE 테이블은
| (CH3) 3 N(aq) | (CH3) 3 NH+ (아크) | OH– (아크) | |
| 초기 농도(M) | 0.25 | 0 | ~0 |
| 변경(M) | -x | +x | +x |
| 평형 농도 (M) | 0.25 – x | 0 + x | ~0 + x |
평형 농도 용어를 Kb 식으로 대체하면
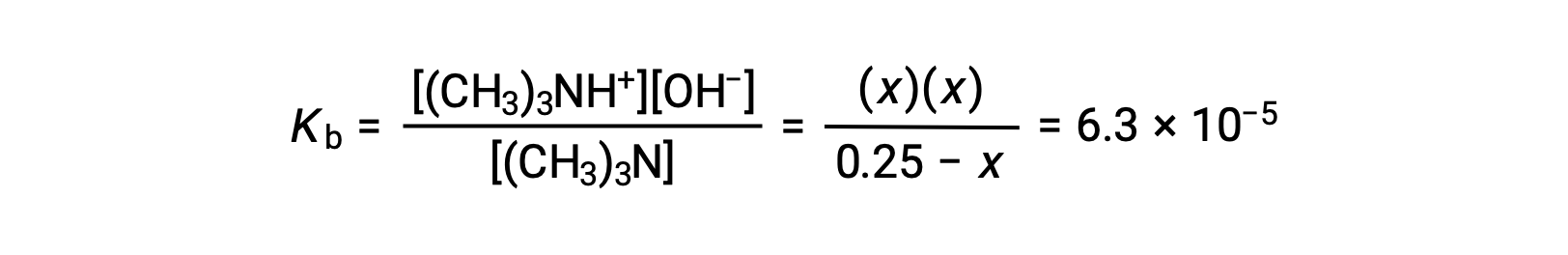
x<< 0.25를 가정하고 x 수익률 해결
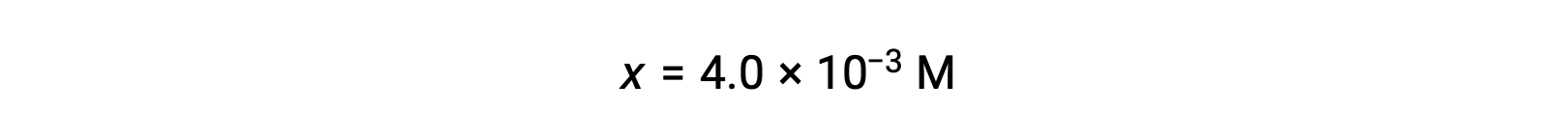
이 값은 초기 농도(0.25)의 5% 미만이므로 가정이 정당화됩니다.
ICE 테이블에 정의된 바와 같이 x는 수산화 이온의 평형 농도와 같습니다.
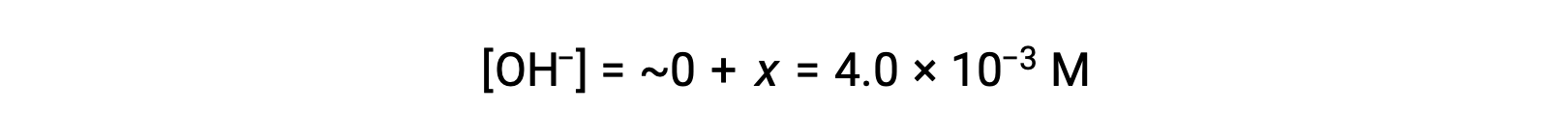
pOH는
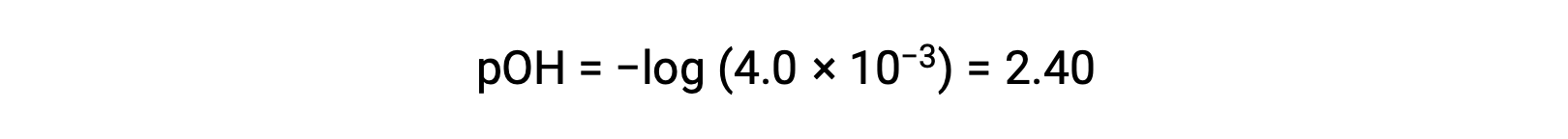
관계 사용;
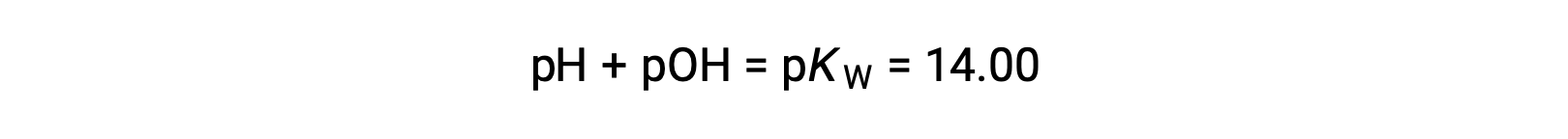
pH의 계산을 허용합니다.
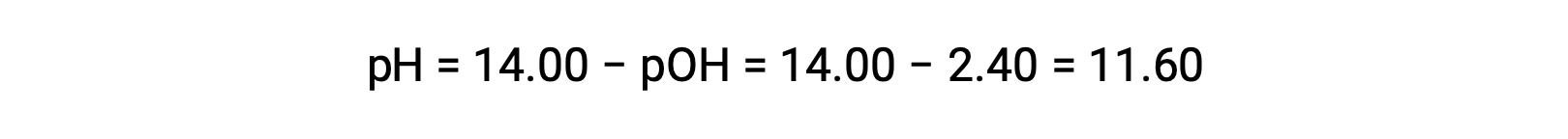
pH로부터 Kb의 결정
에틸라민의 0.28 M 용액(C2H5NH2)의pH가 12.10인 경우,Kb란?
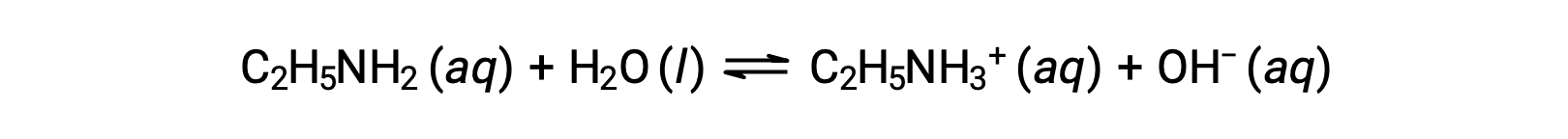
에틸라민의 Kb를 계산하려면 먼저 pOH 및 수산화 이온 농도를 결정해야합니다. pH는 12.10이기 때문에 pOH는 다음과 같이 계산할 수 있습니다.
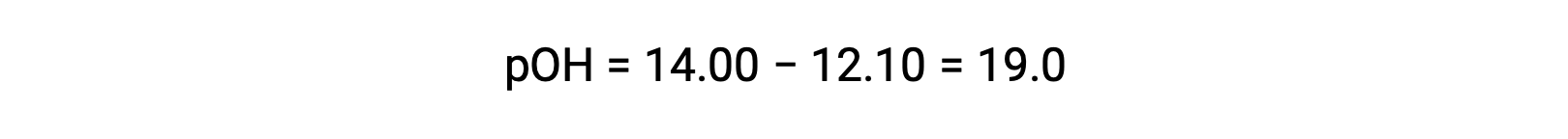
pOH가 1.90이기 때문에 용액의 수산화 이온 농도는 수식을 사용하여 계산할 수 있습니다.
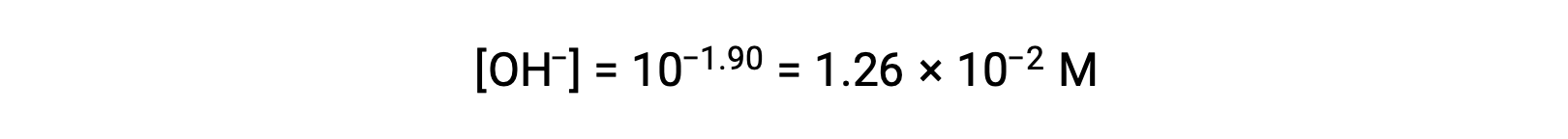
ICE 테이블은 다음과 같이 이 시스템을 위해 구성할 수 있습니다.
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH– (아크) | |
| 초기 농도(M) | 0.28 | 0 | ~0 |
| 변경 (M) | -0.0126 | +0.0126 | +0.0126 |
| 평형 농도 (M) | 0.28 – 0.0126 | 0.0126 | 0.0126 |
0.0126 M은 0.28M의 4.5%, 0.28 ~0.0126은 5%룰로 0.28M에 거의 동일하게 간주될 수 있다.
에틸라민의 Kb에 대한 발현에서 위의 값을 대체한 후,
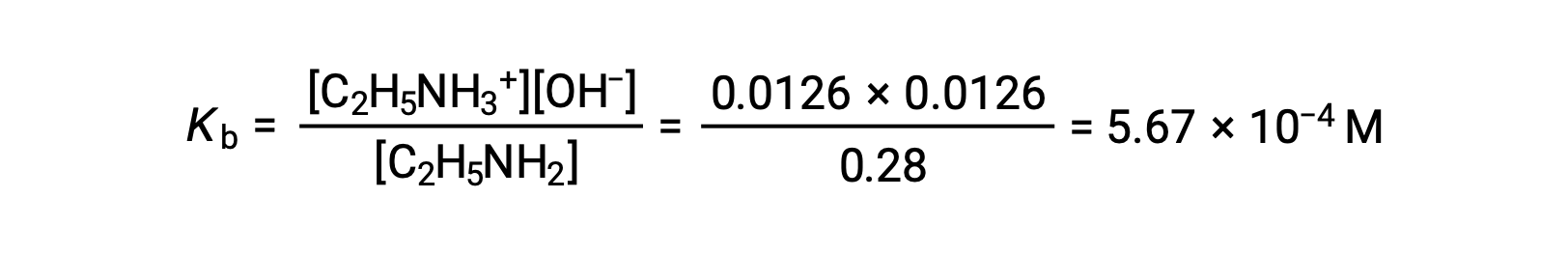
이 텍스트는 Openstax, 화학 2e 섹션 4.2: 화학 반응 분류 및 산 및 기지의 상대강점 14.3에서 적용됩니다.
