16.2:
Tampões
16.2:
Tampões
Uma solução que contenha quantidades apreciáveis de um par ácido-base conjugado fraco é chamada de solução tampão, ou um tampão. As soluções tampão resistem a uma mudança no pH quando são adicionadas pequenas quantidades de um ácido forte ou de uma base forte. Uma solução de ácido acético e acetato de sódio é um exemplo de um tampão que consiste em um ácido fraco e o seu sal: CH3COOH (aq) + CH3COONa (aq). Um exemplo de um tampão que consiste em uma base fraca e o seu sal é uma solução de amoníaco e cloreto de amónio: NH3 (aq) + NH4Cl (aq)
Como Funcionam os Tampões
Para ilustrar a função de uma solução tampão, considere uma mistura de quantidades aproximadamente iguais de ácido acético e acetato de sódio. A presença de um par ácido-base conjugado fraco na solução permite a capacidade de neutralizar quantidades modestas de ácido ou base forte adicionada. Por exemplo, adicionar uma base forte a esta solução irá neutralizar o ião hidrónio e deslocar o equilíbrio de ionização do ácido acético para a direita, restaurando parcialmente a concentração diminuída de H3O+:
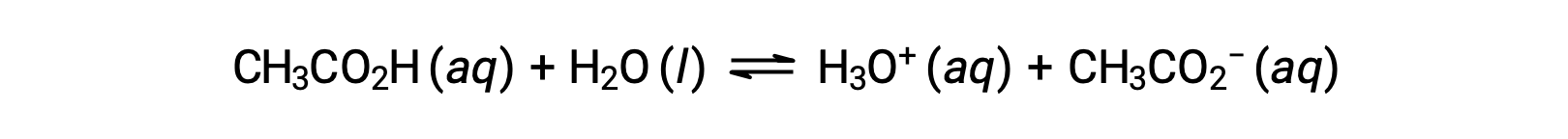
Da mesma forma, adicionar um ácido forte a esta solução tampão irá neutralizar o ião acetato, deslocando o equilíbrio de ionização acima para a direita e retornando [H3O+] para perto do seu valor original. A Figura 1 apresenta uma ilustração gráfica das alterações na solução tampão quando são adicionados ácidos e bases fortes. A ação de tamponamento da solução é essencialmente resultado da conversão dos ácidos e das bases fortes adicionados ao ácido e base fracos que compõem o par conjugado do tampão. O ácido e a base mais fracos sofrem apenas uma ligeira ionização, em comparação com a ionização completa do ácido e base fortes. O pH da solução, portanto, muda muito menos drasticamente do que mudaria em uma solução sem tamponamento.
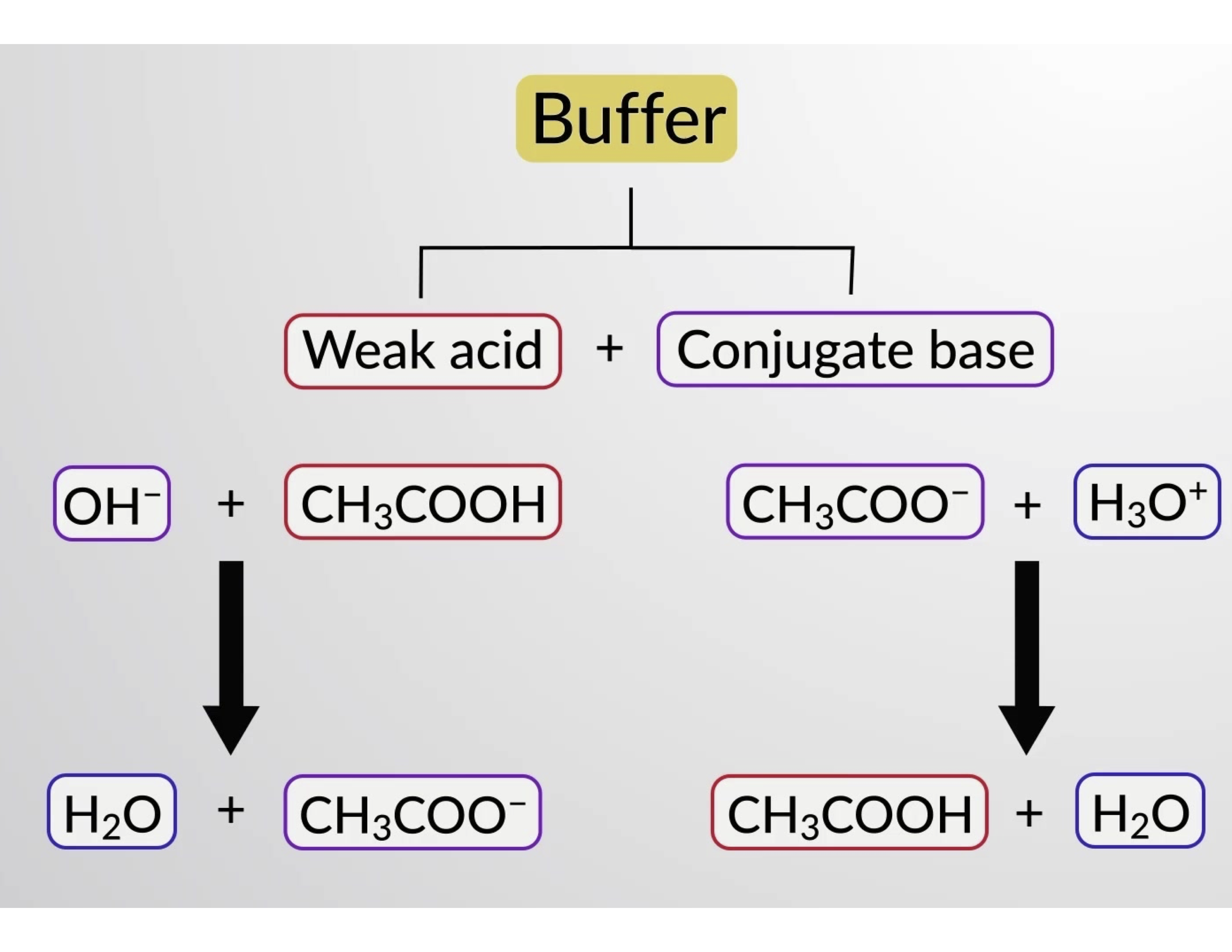
Figura 1. Ação de tamponamento em uma mistura de ácido acético e sal de acetato.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.6: Buffers.
