Messung der mechanischen Eigenschaften von lebenden Zellen mit Atomic Force Microscopy
Summary
Dieses Papier zeigt ein Protokoll, um die mechanischen Eigenschaften von lebenden Zellen mittels Mikroindentation mit einem Atomic Force Microscope (AFM) zu charakterisieren.
Abstract
Mechanische Eigenschaften der Zellen und der extrazellulären Matrix (ECM) spielt eine wichtige Rolle in vielen biologischen Prozessen einschließlich Stammzelldifferenzierung, Tumorentstehung und Wundheilung. Änderungen in der Steifigkeit von Zellen und ECM sind oft Anzeichen von Veränderungen in der Zellphysiologie oder Krankheiten in Geweben. Somit ist Zelle Steifigkeit ein Index, um den Status von Zellkulturen zu bewerten. Unter der Vielzahl von Methoden angewandt, um die Steifigkeit von Zellen und Geweben zu messen, bietet Mikro-Vertiefung mit einem Atomic Force Microscope (AFM) einen Weg, um zuverlässig zu messen die Steifigkeit der lebenden Zellen. Diese Methode wurde in großem Umfang angewendet, um die mikro-Steifigkeit für eine Vielzahl von Materialien, angefangen von Metalloberflächen weichen biologischen Geweben und Zellen zu charakterisieren. Das Grundprinzip dieses Verfahrens ist es, Gedankenstrich eine Zelle mit einer AFM-Spitze aus Geometrie und messen die aufgebrachte Kraft aus der Biegung des AFM-Cantilever. Montage der Kraft-Einzug Kurve nach Hertz-Modusl für die entsprechende Geometrie der Spitze geben können quantitative Messungen der Steifigkeit des Materials. Dieses Papier zeigt das Verfahren, um die Steifigkeit von lebenden Zellen mit AFM charakterisiert. Die wichtigsten Schritte einschließlich des Prozesses der AFM Kalibrierung, Kraft-Kurve Erwerb und Datenanalyse unter Verwendung eines MATLAB Routine demonstriert. Einschränkungen dieser Methode werden ebenfalls diskutiert.
Introduction
Mechanische Eigenschaften, insbesondere Festigkeit, der einzelnen Zellen und der sie umgebenden extrazellulären Matrix (ECM) sind entscheidend für viele biologische Prozesse wie Zellwachstum, Motilität, Teilung, Differenzierung und Gewebshomöostase. 1 Es wurde gezeigt, dass die Zelle mechanische Steifigkeit wird hauptsächlich bestimmt durch das Zytoskelett, insbesondere die Netzwerke von Actin und intermediären Filamenten und andere Proteine mit ihnen verbunden sind. 2 ergibt sich aus mechanischen Tests in vitro Netzwerke von Actin und Intermediärfilamenten vermuten, dass die Zelle Mechanik weitgehend abhängig von der Zytoskelett-Struktur und der Vorspannung ist in das Zytoskelett. 3-5 Steifigkeit von lebenden Zellen wird dann als Index für die Zytoskelett-Struktur 6, Myosin Aktivität 7 und viele andere zelluläre Prozesse evaluieren angesehen. Noch wichtiger ist, sind Veränderungen in der Zelle mechanische Eigenschaften auch oft festgestellt, dass nahe stehendeATED mit verschiedenen Krankheitszuständen wie Tumorbildung und Metastasenbildung 8-10 Kontrolle der mechanischen Steifigkeit von lebenden Zellen kann daher einen neuen Weg zur Zellphysiologie zu überwachen;. zu erkennen und zu diagnostizieren Krankheiten 8;. und um die Wirksamkeit der medikamentösen Behandlungen ausgewertet 11 , 12
Mehrere Verfahren, einschließlich Teilchen Tracking Mikrorheologie, 13-16 magnetischen Verdrehen Zytometrie 17 Mikropipette Streben 18,19 und Mikroindentation 20-22 wurden entwickelt, um die Elastizität der Zellen zu messen. Particle Tracking Mikrorheologie zeichnet die thermischen Schwingungen von entweder Submikron fluoreszierenden Teilchen in Zellen oder Bezugsmarkierungen in der Zelle Zytoskeletts injiziert. 23 elastischen und viskosen Eigenschaften von Zellen aus den gemessenen Verschiebungen Teilchen mit der Fluktuations-Dissipations-Theorem berechnet. 14,23 Dieses Verfahren ermöglicht gleichzeitige Messungen der lokalenmechanische Eigenschaften mit hoher räumlicher Auflösung an verschiedenen Orten in einer Zelle. Jedoch kann Einspritzen fluoreszierenden Teilchen in die Zellen auf Veränderungen in der zellulären Funktion, Zytoskelett-Struktur und damit die Zellmechanik führen. Die Mikropipette Aspiration Methode gilt Unterdruck in einer Mikropipette mit einem Durchmesser im Bereich von 1 bis 5 um ein kleines Stück von der Zellmembran in die Pipette saugen. Zelle Steifigkeit von der angelegten Unterdruck und Zellmembran Verformung. 18 Dieses Verfahren berechnet wird, kann jedoch nicht erkennen, die heterogene Verteilung der Steifigkeit über die Zelle. Magnetische Verdrehen Durchflusszytometrie (MTC) gilt Magnetfeld Drehmoment an superparamagnetische Kügelchen, die an der Zellmembran zu erzeugen. 17 Handy Steifigkeit wird bei diesem Verfahren aus der Beziehung zwischen der angelegten Drehmoments und der Drehverformung der Zellmembran abgeleitet. Es ist schwierig, die Position der magnetischen Kügelchen in der MTC Verfahren zu steuern, und es ist auch challenging, die Verdrehungsdeformation mit hoher Auflösung zu charakterisieren. Mikroindentation gilt ein Stempel mit wohldefinierten Geometrie in die Zelle zu stanzen. Das Einrücken Kraft und die daraus resultierende Vertiefung in Zellen folgen oft die Vorhersage der Hertz-Modell. Young-Modul von Zellen aus den Kraft-Vertiefung Kurven durch Aufstecken auf die Hertz-Modell berechnet werden. Diese Methode wurde in großem Umfang eingesetzt, um die mechanischen Eigenschaften von Gewebe und Zellen trotz seiner Grenzen wie die Unsicherheit in Kontaktstelle Bestimmung Anwendbarkeit der Hertz-Modell, und das Potential zu Schäden am Zellen zu testen. Unter den vielen Geräten für microindentaion 20, ist der Atomic Force Microscope (AFM) im Handel erhältlich und wurde in großem Umfang angewendet, um die mechanischen Eigenschaften von lebenden Zellen und Geweben 21,24-27 charakterisieren.
Dieses Papier zeigt das Verfahren der Verwendung eines Asylum MFP3D-Bio AFM zu Zelle Mechanik charakterisieren. AFM nicht aufly liefert hochauflösende Topographie der Zellen, sondern auch weit verbreitet angewendet worden, um die mechanischen Eigenschaften von Gewebe-Zellen charakterisieren. Das Prinzip der AFM Vertiefung ist in Abbildung 1 dargestellt. Die AFM-Cantilever nähert die Zelle von wenigen Mikrometern über, in Kontakt mit der Zelle; Einzüge die Zelle, so dass die Cantileverauslenkung erreicht einen vorgewählten Sollwert und zieht sich aus der Zelle. Dabei wird die freitragende Auslenkung in Abhängigkeit von seiner Lage aufgezeichnet, wie in Abbildung 1 dargestellt. Vor dem Kontakt mit der Zelle bewegt sich der Ausleger in dem Medium ohne sichtbare Verformung. Wenn Einrücken auf der Zelle, den Freischwinger Kurven und den Ablenksignal zunimmt. Die Ausleger sind als elastische Strahlen, so dass die Auslenkung proportional zu der Kraft, die auf die Zelle modelliert. Durch die Einstellung der maximalen Cantileverauslenkung wird die maximale Größe der Kraft, die auf die Probe beschränkt d vermeidenAmage zu den Zellen. Der Abschnitt der Kraftverlauf von Punkt B nach C in Fig. 1, wobei die Spitze Vertiefungen in die Zelle, an die Hertz-Modell zu passen, um die Zelle zu extrahieren Steifigkeit zeigen.
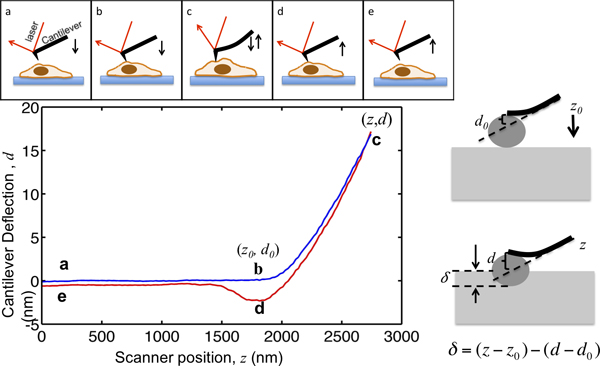
Abbildung 1. Illustration von AFM Mikroindentation und Interpretation der Kraft-Kurve. Das obere Feld zeigt die Bewegung der AFM-Cantilever durch die Piezo-Scanner gefahren. Die vertikale Lage des Auslegers und der z Cantileverauslenkung D wird während des Verfahrens aufgezeichnet. Der Ausleger beginnt bei Punkt a, wenige Mikrometer über der Zelle. Bei Annäherung an die Zelle, bleibt die Probe Vertiefung δ Null bis Punkt B, wo die Spitze in Kontakt mit der Zelle erreicht. Die Koordinaten des Punktes b in der Handlung sind kritische Wertefür die Datenanalyse durch (z 0, d 0>) bezeichnet. Von B nach C, die Cantilever-Einzüge in die Zelle, bis die Cantileverauslenkung erreicht einen Sollwert, der auf das Verhältnis zwischen der maximalen gezielte Eindruckkraft und Kragfeder Konstante sein wird. Sobald die Auslenkung Signal erreicht den vorgegebenen Maximalwert, wird der Ausleger dann aus der Zelle zu Punkt d, wo es oft nach unten durch Spitze-Probe Haftung gezogen werden zurückgenommen, löst sich von der Zelle und kehrt in seine ursprüngliche Lage am e. Das rechte Bild zeigt die Beziehung zwischen der Vertiefung und dem aufgezeichneten z und d-Signals. In der unteren linken Bereich ist eine graphische Darstellung eines repräsentativen Kraftverlauf, die maximale Vertiefung eines Auslegers, der die Federkonstante gemessen werden 0.07N / m ist, ist auf 17 nm, so dass die maximale Eindruckkraft anzuwendenden Probe ist 1,2 nN. Die wichtigsten Orten während der Vertiefung sind markiert.
Protocol
Representative Results
Discussion
Die AFM Vertiefung Methode hat Vorteile gegenüber mechanischen Eigenschaften von lebenden Zellen zu charakterisieren. Wenn auch weniger empfindlich als die magnetische Verdrehen Durchflusszytometrie und optische Pinzette, die Kräfte auf die Pikonewton Stufe 32 messen kann, kann die AFM Widerstandskraft von Proben im Bereich von zig Pico-Newton, um Hunderte von nano-Newton, vergleichbar zu erfassen, um der Kraft reichen, dass Zellen können unter Verwendung einer Mikropipette 19 aufgebracht werden…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren danken Dr. Paul Janmey an der University of Pennsylvania für die Bereitstellung von Zelllinien in diesem Papier verwendet. QW auch anerkennen, JF Byfield und Evan Anderson für ihre aufschlussreichen Diskussionen über AFM-Techniken.
References
- Discher, D. E., Janmey, P., Wang, Y. L. Tissue cells feel and respond to the stiffness of their substrate. Science. 310, 1139-1143 (2005).
- Wagner, O. I., et al. Softness, strength and self-repair in intermediate filament networks. Exp. Cell Res. 313, 2228-2235 (2007).
- Wang, N., et al. Mechanical behavior in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98, 7765-7770 (2001).
- Wang, N., et al. Cell prestress. I. Stiffness and prestress are closely associated in adherent contractile cells. American Journal of Physiology. Cell Physiology. 282, 606-616 (2002).
- Kasza, K. E., et al. Filamin A is essential for active cell stiffening but not passive stiffening under external force. Biophysical Journal. 96, 4326-4335 (2009).
- Elson, E. L. Cellular mechanics as an indicator of cytoskeletal structure and function. Annual Review of Biophysics and Biophysical Chemistry. 17, 397-430 (1988).
- Schafer, A., Radmacher, M. Influence of myosin II activity on stiffness of fibroblast cells. Acta Biomaterialia. 1, 273-280 (2005).
- Guck, J., et al. Optical deformability as an inherent cell marker for testing malignant transformation and metastatic competence. Biophysical Journal. 88, 3689-3698 (2005).
- Cross, S. E., Jin, Y. S., Rao, J., Gimzewski, J. K. Nanomechanical analysis of cells from cancer patients. Nature Nanotechnology. 2, 780-783 (2007).
- Plodinec, M., et al. The nanomechanical signature of breast cancer. Nature Nanotechnology. 7, 757-765 (2012).
- Rotsch, C., Radmacher, M. Drug-induced changes of cytoskeletal structure and mechanics in fibroblasts: an atomic force microscopy study. Biophysical Journal. 78 (00), 520-535 (2000).
- Cross, S. E., Jin, Y. S., Lu, Q. Y., Rao, J., Gimzewski, J. K. Green tea extract selectively targets nanomechanics of live metastatic cancer cells. Nanotechnology. 22, 215101 (2011).
- Hoffman, B. D., Crocker, J. C. Cell mechanics: dissecting the physical responses of cells to force. Annual Review of Biomedical Engineering. 11, 259-288 (2009).
- Hoffman, B. D., Massiera, G., Van Citters, K. M., Crocker, J. C. The consensus mechanics of cultured mammalian cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 10259-10264 (2006).
- Lau, A. W., Hoffman, B. D., Davies, A., Crocker, J. C., Lubensky, T. C. Microrheology, stress fluctuations, and active behavior of living cells. Physical Review Letters. 91, 198101 (1981).
- Liu, J., et al. Microrheology probes length scale dependent rheology. Physical Review Letters. 96, 118104 (2006).
- Deng, L., et al. Fast and slow dynamics of the cytoskeleton. Nature Materials. 5, 636-640 (2006).
- Oh, M. J., Kuhr, F., Byfield, F., Levitan, I. Micropipette Aspiration of Substrate-attached Cells to Estimate Cell Stiffness. J. Vis. Exp. (67), e3886 (2012).
- Hochmuth, R. M. Micropipette aspiration of living cells. Journal of Biomechanics. 33, 15-22 (2000).
- Levental, I., et al. A simple indentation device for measuring micrometer-scale tissue stiffness. J. Phys-Condens. Mat. 22, (2010).
- Mahaffy, R. E., Park, S., Gerde, E., Kas, J., Shih, C. K. Quantitative analysis of the viscoelastic properties of thin regions of fibroblasts using atomic force microscopy. Biophysical Journal. 86, 1777-1793 (2004).
- Radmacher, M. Measuring the elastic properties of biological samples with the AFM. IEEE Engineering in Medicine and Biology Magazine: The Quarterly Magazine of the Engineering in Medicine & Biology Society. 16, 47-57 (1997).
- Crocker, J. C., Hoffman, B. D. Multiple-particle tracking and two-point microrheology in cells. Methods in Cell Biology. 83, 141-178 (2007).
- Liu, F., Tschumperlin, D. J. Micro-mechanical characterization of lung tissue using atomic force microscopy. J. Vis. Exp. (54), e2911 (2011).
- Solon, J., Levental, I., Sengupta, K., Georges, P. C., Janmey, P. A. Fibroblast adaptation and stiffness matching to soft elastic substrates. Biophysical Journal. 93, 4453-4461 (2007).
- Wu, H. W., Kuhn, T., Moy, V. T. Mechanical properties of l929 cells measured by atomic force microscopy: Effects of anticytoskeletal drugs and membrane crosslinking. Scanning. 20, 389-397 (1998).
- Radmacher, M., Fritz, M., Kacher, C. M., Cleveland, J. P., Hansma, P. K. Measuring the viscoelastic properties of human platelets with the atomic force microscope. Biophysical Journal. 70, 556-567 (1996).
- Levy, R., Maaloum, M. Measuring the spring constant of atomic force microscope cantilevers: thermal fluctuations and other methods. Nanotechnology. 13, 33-37 (2002).
- Lin, D. C., Dimitriadis, E. K., Horkay, F. Robust strategies for automated AFM force curve analysis–I. Non-adhesive indentation of soft, inhomogeneous materials. Journal of Biomechanical Engineering. 129, 430-440 (2007).
- Davis, J. T., Wen, Q., Janmey, P. A., Otteson, D. C., Foster, W. J. Muller cell expression of genes implicated in proliferative vitreoretinopathy is influenced by substrate elastic modulus. Investigative Ophthalmology & Visual Science. 53, 3014-3019 (2012).
- Engler, A. J., Rehfeldt, F., Sen, S., Discher, D. E. Microtissue elasticity: Measurements by atomic force microscopy and its influence on cell differentiation. Method Cell Biol. 83, 521-545 (2007).
- Lele, T. P., et al. Tools to study cell mechanics and mechanotransduction. Methods in Cell Biology. 83 (07), 443-472 (2007).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74, 1564-1578 (1998).
- Costa, K. D., Sim, A. J., Yin, F. C. Non-Hertzian approach to analyzing mechanical properties of endothelial cells probed by atomic force microscopy. Journal of Biomechanical Engineering. 128, 176-184 (2006).
- Xiong, Y., Lee, A. C., Suter, D. M., Lee, G. U. Topography and nanomechanics of live neuronal growth cones analyzed by atomic force microscopy. Biophysical Journal. 96, 5060-5072 (2009).
- Byfield, F. J., et al. Absence of filamin A prevents cells from responding to stiffness gradients on gels coated with collagen but not fibronectin. Biophysical Journal. 96, 5095-5102 (2009).
- Cross, S. E., et al. AFM-based analysis of human metastatic cancer cells. Nanotechnology. 19, 384003 (2008).
- Storm, C., Pastore, J. J., MacKintosh, F. C., Lubensky, T. C., Janmey, P. A. Nonlinear elasticity in biological gels. Nature. 435, 191-194 (2005).
- Wen, Q., Janmey, P. A. Polymer physics of the cytoskeleton. Current Opinion in Solid State & Materials Science. 15, 177-182 (2011).
- Dimitriadis, E. K., Horkay, F., Maresca, J., Kachar, B., Chadwick, R. S. Determination of elastic moduli of thin layers of soft material using the atomic force microscope. Biophysical Journal. 82 (02), 2798-2810 (2002).
- Trache, A., Lim, S. M. Live cell response to mechanical stimulation studied by integrated optical and atomic force microscopy. J. Vis. Exp. (44), e2072 (2010).
- Lim, S. M., Kreipe, B. A., Trzeciakowski, J., Dangott, L., Trache, A. Extracellular matrix effect on RhoA signaling modulation in vascular smooth muscle cells. Exp. Cell Res. 316, 2833-2848 (2010).

