Analyse von Proteindynamik mit Wasserstoffwechsel Massenspektrometrie
Summary
Protein-Konformation und Dynamik sind der Schlüssel zum Verständnis der Beziehung zwischen Struktur und Funktion. Wasserstoffaustausch gekoppelt mit hochauflösender Massenspektrometrie ist eine vielseitige Methode, um die Konformationsänderungen Dynamik von Proteinen als auch studieren Charakterisierung von Protein-Ligand und Protein-Protein-Wechselwirkungen, einschließlich Kontaktschnittstellen und allosterische Effekte.
Abstract
Alle zellulären Prozesse abhängig von der Funktionalität der Proteine. Obwohl die Funktionalität eines gegebenen Proteins ist die direkte Folge der einzigartigen Aminosäuresequenz wird nur durch die Faltung der Polypeptidkette in einer einzigen definierten dreidimensionalen Anordnung oder häufiger in einem Ensemble von Konformationen ineinander Umwandeln realisiert. Die Untersuchung der Verbindung zwischen Protein-Konformation und seine Funktion ist für ein komplettes Verständnis davon, wie Proteine in der Lage sind, ihre große Vielfalt von Aufgaben zu erfüllen daher unerlässlich. Eine Möglichkeit, ein Protein Konformationsänderungen erfährt, während voran durch seine Funktionszyklus studieren Wasserstoff-1 H / 2 H-Austausch in Kombination mit hochauflösender Massenspektrometrie (HX-MS). HX-MS ist eine vielseitige und robuste Methode, die eine neue Dimension der Strukturinformationen, zB durch Kristallographie gewonnen erstellt. Es wird verwendet, um Protein zu studieren und Ausklappen Bindung von kleinen molkül Liganden, Protein-Protein-Wechselwirkungen, Konformationsänderungen verbunden Enzymkatalyse und Allosterie. Zusätzlich wird HX-MS häufig verwendet, wenn die Menge an Protein ist sehr begrenzt oder Kristallisation des Proteins nicht möglich ist. Hier stellen wir ein allgemeines Protokoll für die Untersuchung der Proteindynamik mit HX-MS und zu beschreiben als ein Beispiel, wie man die Interaktionsschnittstelle von zwei Proteinen in einem Komplex zu offenbaren.
Introduction
Die Anzahl von Kristallstrukturen von Proteinen und Proteinkomplexen schnell erhöht in den letzten Jahren. Sie präsentieren unschätzbare Schnappschüsse von der strukturellen Organisation dieser Proteine und eine Grundlage für die Struktur-Funktions-Analyse. Jedoch die Dynamik von Proteinen und Konformationsänderungen, die für ihre Funktionen sind, werden selten durch Röntgenkristallographie ergab. Cryo-Elektronenmikroskopie, auf der anderen Seite, ist in der Lage, Protein-und Protein-Komplexe in verschiedenen Konformationen zu erfassen, aber im Allgemeinen können Konformationsänderungen nicht lösen auf Sekundärstrukturebene ein. Konformationsdynamik von Proteinen in Lösung in atomarer Informationen sind nur für NMR gelöst werden, aber dieses Verfahren ist immer noch relativ kleine Proteine von Größen (in der Regel ≤ 30 kDa) beschränkt und erfordert hohe Konzentrationen von Proteinen (≥ 100 &mgr; M), die Experimente mit behindert Oligomerisierung oder Aggregation neigen Proteine 2. Eine Methode, dieder Lage ist, zwischen hochauflösende Röntgen-Kristallographie und Kryo-Elektronenmikroskopie und die Brücke nicht durch Größe oder Protein-Konzentration begrenzt ist Amid-Wasserstoff-1 H / 2 H-Austausch (HX) in Kombination mit der Massenspektrometrie (MS). In den letzten Jahren hat dieses Verfahren einen wertvollen analytisches Werkzeug für die Analyse von Proteindynamik, Proteinfaltung, der Proteinstabilität und Konformationsänderungen 3-5 entwickelt. Die molekulare Grundlage dieses Verfahrens ist die Labilität Rückgrat Amidwasserstoffe in Proteinen, die durch Deuteriumatome austauscht, wenn das Protein in D 2 O-Lösung gegeben. Die anschließende Erhöhung der Proteinmasse im Laufe der Zeit wird mit hochauflösenden MS gemessen.
Kurz unstrukturierten Peptiden HX hängt nur von der Temperatur, Katalysatorkonzentration (OH -, H 3 O +, dh pH-Wert, siehe Abbildung 3) und Aminosäure-Seitenketten der benachbarten Resten durch induktive, Katzekatalytische und sterische Effekte. Diese Auswirkungen auf die intrinsische chemischen Austauschrate k ch wurden elegant von Bai et al. 6 quantifiziert und ein Programm zur Verfügung (mit freundlicher Genehmigung Z. Zhang), die k ch für jede Aminosäure in einem Polypeptid abhängig von pH-Wert und Temperatur berechnet. Bei neutralem pH-Wert und Umgebungstemperaturen ch k in der Größenordnung von 10 1 bis 10 3 sec -1. Ionen in das Innere einer eng gefalteten Protein – in gefalteter Proteine HX 2-9 Größenordnungen langsamer hauptsächlich auf Wasserstoffbrückenbindung in der Sekundärstruktur und aufgrund eingeschränkter Zugangs hydratisierter OH geringem Ausmaß sein. HX in nativen Proteinen impliziert daher teilweise oder globale Entfaltung, chemischen Austausch und die Rückfaltung in den nativen Zustand nach Gleichung (1) und die beobachteten Wechselkurse k obs abhängig von der Öffnungsrate k op, die Schlussrate k cl und der intrinsischen chemischen Austausch rate ch k gemäß Gleichung (2).
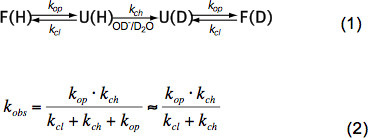
Unter nativen Zustand Bedingungen k op ist viel kleiner als k ch und kann im Nenner vernachlässigt werden. Es gibt zwei extreme Wechsel Regime genannt EX1 und EX2. Wenn der k Cl ist viel kleiner als k CH (EX1) die beobachtete Geschwindigkeit praktisch gleich der Öffnungsrate und HX unmittelbare Beobachtung der Entfaltung eines Strukturelements. Ein solcher Austausch Regime, in dem alle Amidprotonen Austausch auf einmal beim Öffnen des Strukturelements ist leicht beobachtbaren MS durch eine bimodale Verteilung der Isotopenpeaks 7. Wenn k Cl ist viel größer als k CH (EX2) die beobachtete Rate ist proportional zu k ch wobei die Proportionalitätskonstante gleich dem Faltungs-Entfaltungs-Gleichgewichte ist die Konstante K u = K op </sub> K / cl. Unter diesen Bedingungen sind viele Öffnungs-und Schließereignisse notwendig, bevor alle Amidprotonen gegen Deuteronen, was zu einem allmählichen Anstieg der Durchschnittsmasse, während die Isotopenverteilung etwa gleich bleibt. Die EX2 Regime ermöglicht die Bestimmung der freien Energie der Entfaltung &Dgr; G u und damit der Stabilität eines Strukturelements. Unter nativen Zustand Zustand der EX2-Regime ist am häufigsten. Erhöhung des pH-Wertes und Zugabe von chaotropen Mitteln können die Austauschmechanismus zu EX1 verschieben. Daher kann HX-MS verwendet werden, um thermodynamische erkunden sowie kinetischen Parameter der Proteinfaltung und Konformationsänderungen werden.
Wie oben erwähnt ist HX eigen pH-und temperaturabhängig und der Austausch Halbwertszeit von einer völlig löse ausgesetzt Protonen des Rückgrats Amidgruppe zwischen 5-400 ms bei einem physiologischen pH-Wert (pH 7,6) und 30 ° C, aber mindestens 10 min auf> 15 Stunden mit einem Mittelwert von> 2 h bei pH 2,9 und 0 °C (mit Ausnahme des Protons des ersten Gerüst-Amidbindung eines Polypeptids, das mit einer Halbwertszeit von ca. 1-2 min austauscht). Unter solchen langsamen Austausch Bedingungen ist es möglich, die Probe zu verdauen Proteasen (z. B. Pepsin), die aktiv sind, unter diesen Bedingungen mit verlieren sich alle in den eingeDeuteRonen enthaltenen Informationen. Seit der Einführung des Magen-Darm-Verdauung unter langsamem Austausch Bedingungen kann nicht nur die Gesamt HX Kinetik der vollständigen Proteine analysiert werden, aber HX kann auf bestimmte Regionen 8,9 lokalisiert werden. Ortsauflösung wird noch auf die Größe der Fragmente Magen erzeugt, die im allgemeinen zwischen 10-30 Reste beschränkt. Jedoch könnte überlappende Fragmente aufgrund der unspezifischen Art der Spaltung durch Pepsin erzeugt eine Erhöhung der räumlichen Auflösung führen. Darüber hinaus wurden mehrere andere Proteasen gefunden unter Abschrecken Bedingungen aktiv zu sein, aber viel weniger effizient als Pepsin 10. Weitere zunehse der räumlichen Auflösung können durch Fragmentierung von Peptiden in der Gasphase durch Methoden, die Deuterierung Muster wie Elektroneneinfang-Dissoziation (ECD), Elektronentransfer-Dissoziation (ETD) und Infrarot-Multiphoton-Dissoziation (IRMPD) 11-13 erhaltenen erreichen. Diese Methoden verhindern den Verlust an räumlicher Auflösung durch intramolekulare Protonenwanderung ("Scrambling"), die durch stoßinduzierte Dissoziation (CID) zu beobachten ist die am häufigsten verwendeten Fragmentierungstechnik. Allerdings erfordern diese Verfahren die Optimierung für jedes einzelne Peptid und ist damit immer noch ziemlich schwierig.
HX-MS wurde verwendet, um Protein-Liganden und Protein-Protein-Wechselwirkungen, einschließlich virale Kapsid-Zusammensetzung 14-17 analysieren. Protein-Entfaltung und Rückfaltung sowie temperaturinduzierte Konformationsänderung untersucht 7,18,19. Phosphorylierung und einzigen Aminosäure mutationsbedingte Konformationsänderungen 16,20 und nucleotide-induzierten Veränderungen wurden analysiert 21,22. Daher scheint diese Methode ideal geeignet zur Montage und Dynamik von molekularen Maschinen zu analysieren. Ein attraktiver Kandidat, dessen Mechanismus ist von großem allgemeinem Interesse ist das Hsp90-Chaperon-Komplex.
Protocol
Representative Results
Discussion
Bindung eines Interaktionspartners zu einem Protein führt unweigerlich zu Veränderungen der Lösungsmittelzugänglichkeit an der Bindungsstelle. Darüber hinaus haben viele Proteine werden dynamisch Konformationsänderungen bei der Bindung, die anderen Regionen beeinflussen als die tatsächliche Bindung Schnittstelle. HX-MS ist eine robuste Methode, um diese Änderungen zu überwachen und ist sogar in der Lage, enthüllt Konformationsänderungen in Proteinen auf Zeitskalen, dass andere Verfahren nicht abdecken k…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken M. Boysen für Kommentare zum Manuskript. Dieses Projekt wurde von der Deutschen Forschungsgemeinschaft (: Cellnetworks EXC 81/1 SFB638 und MA 1278/4-1 MPM und Exzellenzcluster) finanziert. MPM ist Investigator des Exzellenzclusters: Cellnetworks.
Materials
| Reagent/Equipment | Company | Catalogue number | Comments (optional) |
| maXis QTOF | Bruker | ||
| nanoAcquity UPLC | Waters Corp. | ||
| Shimadzu 10AD-VP | Shimadzu | ||
| 6-port Valve EPC6W with microelectric actuator | Valco | #EPC6W | |
| Injection valve (manual) | Rheodyne | #7725 | |
| Poros AL20 media | Applied Biosystems | #1-6029-06 | |
| Poros R2 | Applied Biosystems | #1-1118-02 | |
| Pepsin | Sigma | #P6887 | use fresh pepsin |
| Microbore (1 mm) | IDEX | #C-128 | |
| Microbore (2 mm) | IDEX | #C-130B | |
| Acquity UPLC BEH C8 Column | Waters Corp. | #186002876 | |
| Thermomixer | Eppendorf | #5355000.011 | |
| Tubing (various diameters) | IDEX | ||
| Fittings | IDEX | #PK-110 with PK-100 |
References
- Saibil, H. R. Conformational changes studied by cryo-electron microscopy. Nat. Struct. Biol. 7 (9), 711-714 (2000).
- Mittermaier, A., Kay, L. E. New tools provide new insights in NMR studies of protein dynamics. Science. 312 (5771), 224-228 (2006).
- Hoofnagle, A. N., Resing, K. A., Ahn, N. G. Protein analysis by hydrogen exchange mass spectrometry. Annu. Rev. Biophys. Biomol. Struct. 32, 1-25 (2003).
- Wales, T. E., Engen, J. R. Hydrogen exchange mass spectrometry for the analysis of protein dynamics. Mass. Spectrom. Rev. 25 (1), 158-170 (2006).
- Konermann, L., Pan, J., Liu, Y. -. H. Hydrogen exchange mass spectrometry for studying protein structure and dynamics. Chem Soc. Rev. 40 (3), 1224-1210 (2011).
- Bai, Y., Milne, J. S., Mayne, L., Englander, S. W. Primary structure effects on peptide group hydrogen exchange. Proteins. 17 (1), 75-86 (1993).
- Rist, W., Jørgensen, T. J. D., Roepstorff, P., Bukau, B., Mayer, M. P. Mapping temperature-induced conformational changes in the Escherichia coli heat shock transcription factor sigma 32 by amide hydrogen exchange. The Journal of biological chemistry. 278 (51), 51415-51421 (1074).
- Englander, J. J., Rogero, J. R., Englander, S. W. Protein hydrogen exchange studied by the fragment separation method. Anal Biochem. 147 (1), 234-244 (1985).
- Zhang, Z., Smith, D. L. Determination of amide hydrogen exchange by mass spectrometry: a new tool for protein structure elucidation. Protein Sci. 2 (4), 522-531 (1993).
- Cravello, L., Lascoux, D., Forest, E. Use of different proteases working in acidic conditions to improve sequence coverage and resolution in hydrogen/deuterium exchange of large proteins. Rapid Commun. Mass Spectrom. : RCM. 17 (21), 2387-2393 (2003).
- Rand, K. D., Zehl, M., Jensen, O. N., Jørgensen, T. J. D. Protein hydrogen exchange measured at single-residue resolution by electron transfer dissociation mass spectrometry. Anal chem. 81 (14), 5577-5584 (2009).
- Pan, J., Han, J., Borchers, C. H., Konermann, L. Electron capture dissociation of electrosprayed protein ions for spatially resolved hydrogen exchange measurements. J. Am. Chem. Soc. 130 (35), 11574-11575 (2008).
- Yamada, N., Suzuki, E. -. I., Hirayama, K. Identification of the interface of a large protein-protein complex using H/D exchange and Fourier transform ion cyclotron resonance mass spectrometry. Rapid Commun. Mass Spectrom. 16 (4), 293-299 (2002).
- Lee, T., Hoofnagle, A. N., et al. Docking motif interactions in MAP kinases revealed by hydrogen exchange mass spectrometry. Mol. Cell. 14 (1), 43-55 (2004).
- Hasan, A., Smith, D. L., Smith, J. B. Alpha-crystallin regions affected by adenosine 5′-triphosphate identified by hydrogen-deuterium exchange. Biochem. 41 (52), 15876-15882 (2002).
- Lanman, J., Lam, T. T., Emmett, M. R., Marshall, A. G., Sakalian, M., Prevelige, P. E. Key interactions in HIV-1 maturation identified by hydrogen-deuterium exchange. Nat. Struct. Mol. Biol. 11 (7), 676-677 (2004).
- Wang, L., Lane, L. C., Smith, D. L. Detecting structural changes in viral capsids by hydrogen exchange and mass spectrometry. Protein Sci. 10 (6), 1234-1243 (2001).
- Pan, H., Raza, A. S., Smith, D. L. Equilibrium and kinetic folding of rabbit muscle triosephosphate isomerase by hydrogen exchange mass spectrometry. J. Mol. Biol. 336 (5), 1251-1263 (2004).
- Mazon, H., Marcillat, O., Forest, E., Smith, D. L., Vial, C. Conformational dynamics of the GdmHCl-induced molten globule state of creatine kinase monitored by hydrogen exchange and mass spectrometry. Biochem. 43 (17), 5045-5054 (2004).
- Lanman, J., Lam, T. T., et al. Identification of novel interactions in HIV-1 capsid protein assembly by high-resolution mass spectrometry. J. Mol. Biol. 325 (4), 759-772 (2003).
- Rist, W., Graf, C., Bukau, B., Mayer, M. P. Amide hydrogen exchange reveals conformational changes in hsp70 chaperones important for allosteric regulation. J. Biol. chem. 281 (24), 16493-16501 (2006).
- Graf, C., Stankiewicz, M., Kramer, G., Mayer, M. P. Spatially and kinetically resolved changes in the conformational dynamics of the Hsp90 chaperone machine. EMBO J. 28 (5), 602-613 (2009).
- Lee, C. -. T., Graf, C., Mayer, F. J., Richter, S. M., Mayer, M. P. Dynamics of the regulation of Hsp90 by the co-chaperone Sti1. EMBO J. 31 (6), 1518-1528 (2012).
- Lou, X., Kirchner, M., et al. Deuteration distribution estimation with improved sequence coverage for HX/MS experiments. Bioinformatics. 26 (12), 1535-1541 (2010).
- Kreshuk, A., Stankiewicz, M., Lou, X., Kirchner, M., Hamprecht, F. A., Mayer, M. P. Automated detection and analysis of bimodal isotope peak distributions in H/D exchange mass spectrometry using HeXicon. Intl. J. mass spectrom. 302 (1-3), 125-131 (2011).
- Walters, B. T., Ricciuti, A., Mayne, L., Englander, S. W. Minimizing back exchange in the hydrogen exchange-mass spectrometry experiment. J. Am. Soc. Mass Spectrom. 23 (12), 2132-2139 (2012).
- Weis, D. D., Wales, T. E., Engen, J. R., Hotchko, M., Ten Eyck, L. F. Identification and characterization of EX1 kinetics in H/D exchange mass spectrometry by peak width analysis. J. Am. Soc. Mass Spectrom. 17 (11), 1498-1509 (2006).
- Fang, J., Rand, K. D., Beuning, P. J., Engen, J. R. False EX1 signatures caused by sample carryover during HX MS analyses. Intl. J. Mass Spectrom. 302 (1-3), 19-25 (2011).
- Deng, Y., Smith, D. L. Identification of unfolding domains in large proteins by their unfolding rates. Biochem. 37 (18), 6256-6262 (1998).
- Wales, T. E., Engen, J. R. Partial unfolding of diverse SH3 domains on a wide timescale. J. Mol. Biol. 357 (5), 1592-1604 (2006).
- Pan, Y., Piyadasa, H., O’Neil, J. D., Konermann, L. Conformational dynamics of a membrane transport protein probed by h/d exchange and covalent labeling: the glycerol facilitator. J. Mol. Biol. 416 (3), 400-413 (2012).
- Hebling, C. M., Morgan, C. R., Stafford, D. W., Jorgenson, J. W., Rand, K. D., Engen, J. R. Conformational analysis of membrane proteins in phospholipid bilayer nanodiscs by hydrogen exchange mass spectrometry. Anal chem. 82 (13), 5415-5419 (2010).
- Abzalimov, R. R., Kaplan, D. A., Easterling, M. L., Kaltashov, I. A. Protein conformations can be probed in top-down HDX MS experiments utilizing electron transfer dissociation of protein ions without hydrogen scrambling. J. Am. Soc. Mass Spectrom. 20 (8), 1514-1517 (2009).

