<em> Xenopus</emFluorometri ile> Yumurta Kes-açık Vazelin Gap Gerilim-kelepçe Tekniği
Summary
Kesik açık vazelin boşluk yaklaşım hızlı kanal kinetiği yüksek çözünürlüklü Xenopus oositlerde eksprese edilen voltaj-bağımlı iyon kanallarının iyonik ve yolluk akımlarının düşük ses kayıtları elde etmek için kullanılır. Küçük değişiklikler ile, voltaj kıskaç fluorometri kesme açık oosit protokolüne akuple edilebilir.
Abstract
Kesik açık oosit Vaseline boşluk (COVG) voltaj kelepçe tekniği oositlerde heterolog iyon kanalları, elektrofizyolojik ve kinetik özelliklerinin analizi sağlar. Kesim açık kurulumdan Kayıtlar düşük büyüklüğü yolluk akımları, hızlı iyonik akım aktivasyonu ve deaktivasyonunu çözmek için özellikle yararlıdır. Iki elektrotlu voltaj kelepçe (TEVC) tekniği fazla temel faydaları artış kelepçe hızı, gelişmiş bir sinyal-gürültü oranı ve hücre içi ve hücre dışı ortamı ayarlama yeteneği de bulunmaktadır.
Burada, kesme açık setup ve protokol hem de voltaj kelepçe fluorometri özelliği eklemek için gerekli olan değişiklikleri göstermek için, (HNA V 1.5), Xenopus oositlerde eksprese edilen insan kardiyak sodyum kanalı kullanır.
Böyle HNA V 1.5 gibi hızlı aktive iyon kanalları, özellikleri, tam olarak hangi de, TEVC kullanılarak oda sıcaklığına yakın çözülemezoosit membran saat tamamı voltaj kontrolü zorlaştırır, kenetlenir. Bununla birlikte, kesme, açık teknik, hücre zarının sadece küçük bir kısmının izolasyon patch clamp teknikleriyle ilişkili kanal halsiz önlerken doğru hızlı kinetiği kaydetmek için gerekli olan hızlı bir sıkma sağlar.
COVG teknik, iyon kanalı kinetik ve elektrofizyolojik özellikleri ile bağlantılı olarak daha fazla protein, hücre dışı hareket uygulanır fluoroforlar, genetik olarak kodlanmış floresan proteinleri sokulması, ya da doğal olmayan amino asitlerin dahil sistein konjügasyonu ile izlenen voltaj kelepçe fluorometri kullanılarak deneye tabi tutulabilir ilgi 1'in bölgesine. Bu, ek veri flüoresan molekülü çevreleyen mikro-değişimlere ile proteinin voltaj bağımlı konformasyonel yeniden düzenlemeleri ile ilgili kinetik bilgi verir.
Introduction
Uzman voltaj kenetleme teknikleri, kontrol edilen membran potansiyelleri iyonik akımların kayıt izin verir. Yaygın iki elektrotlu voltaj kelepçe (TEVC) kullanılmış ve yama kelepçe teknikleri çok iyon kanallarının özellikleri hakkında güvenilir elektrofizyolojik bilgi sağlar. Ancak, bu yöntemlerin her ikisi de hızlı voltaj-kapılı sodyum kanalları ve bu tür Xenopus oosit gibi zarlarında diğer hızlı aktive kanallar için güvenilir verilerin ele geçirilmesini önlemek dezavantajları var. Bezanilla ve Stefani laboratuvarları dolayısıyla oosit 2 için kesim açık Vazelin boşluk gerilim kelepçe tekniği (COVG) geliştirdi. Bu teknik, Na +, K + ve Ca 2 + channels 3-8 kaydetmek için yaygın olarak uygulanmaktadır.
COVG kayıt sırasında, bir heterolog protein ifade oosit zarı üç bölgeye ayrılmıştır. Iyonik mevcut veriler olarak oositin üst bölgesinden kaydedilirüst bölgeyi çevreleyen banyo kolayca ve hızlı bir şekilde değiştirilebilir bir komut potansiyeli, kenetlenir. Orta bölge üst bölge 9 ile aynı potansiyele kenetlenir edilerek kaçak akımlara karşı koruma sağlar. Oosit açıklık (cut-açık) bir saponin çözeltisi ya da bir kanül aracılığıyla oluştuğu alt bölgesidir. Kimyasal ya da alt bölgesinde zarın manuel açma toprağa kenetlenir iç potansiyel kontrolünü sağlar ve alt bölme çözeltisi ile hücre iç sürekliliğini hale getirir. En iyi odasındaki çözelti değişimi dış çevresi değiştirir, oysa alt odasına çözümler perfüzyon, iç ortam özelliklerini ayarlayabilirsiniz. 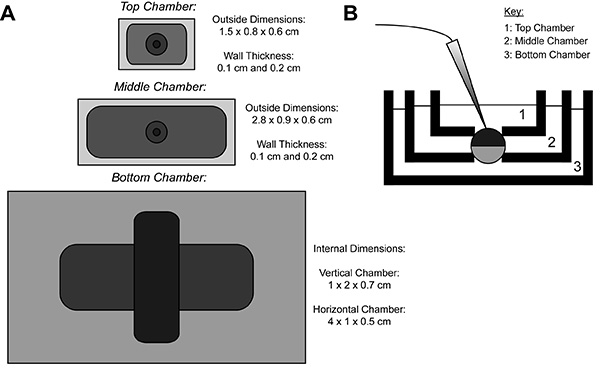
Şekil 1. Oosit Cut-Açık Gerilim-Kelepçe Banyo Kurulum Şeması. (A) Üstbirbirinden ayrılmış üç banyolarının görünümünde aşağı. COVG için bölmelerin boyutları şekil üzerinde görüntülenir. (B) testi pozisyonda hamam kurulum yan görünümü. resmi büyütmek için buraya tıklayın .
COVG tekniğin avantajları, düşük akım gürültü (3 kHz 1 nA), dış ortamın iyonik kompozisyonu, iç ortam, hızlı zamanı çözünürlük (çürüme 20-100 mikro saniye olduğu zaman sabiti modüle yeteneği kontrolü, kapasite geçici), ve birkaç saat 9 stabil kayıtları. Dezavantajları özel ekipman gerektirir ve iki elektrotlu voltaj kelepçeleme (TEVC) 10 ile karşılaştırıldığında gerçekleştirmek için daha zor olmasıdır.
COVG yaklaşımı son derece özel ekipman ve karmaşık usul unsurları gerektirir iken, valu edinimi için izin verebilirmümkün elektrofizyolojik veriler. Böyle hızlı kinetik ve kuyruk akımları 4 ile akımlarını yolluk gibi bu veriler, kanal köhne dahil olmak üzere diğer voltaj sıkıştırma protokolleri ile ilgili bazı sorunları olmadan kaydedilebilir. COVG kurulum için küçük değişiklikler sıcaklık kontrolörleri ve gerilim kelepçe fluorometri (VKF) kullanımı için izin verebilirsiniz. COVG montaj içinde gerilim kelepçe fluorometri unsurların eklenmesi anda mevcut 11-13 kaydederken protein yapısal değişimleri izlemek için yeteneğini kazandıran veri çıkışını güçlendirir.
Protocol
Representative Results
Discussion
Kesim açık oosit Vazelin boşluk gerilim kelepçe tekniği hızlı veri çözünürlüğü sağlar, düşük gürültü, nispeten uzun protokolleri üzerinden 19 iç çözümü ve dış çözüm kompozisyon üzerinde kontrol ve istikrarlı kayıtları arttı. Bu avantajlar, ayrı Standart iki elektrotlu voltaj kelepçe ve yama kelepçe teknikleri bu teknik ayarlayın. Özel ekipman gerekli ve protokol nispeten zor olmasına rağmen, sistem optimize edildikten sonra, çok az sayıda sorunlar oluşur. Bu sody…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Tüm St Louis Kardiyak Moleküler Mühendislik Lab Washington Üniversitesi'nden üyeleri. Bir Burroughs Bilimsel Arakesitte Fonu Kariyer Ödülü Hoşgeldiniz – 1010299 (JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

