Die<em> Xenopus</em> Eizelle Cut-open Vaseline Gap Voltage-Clamp-Technik Mit Fluorometrie
Summary
Die aufgeschnittenen Vaseline Lücke Ansatz werden geringe Geräuschaufnahmen von ionischen und Anschnittströme von spannungsabhängigen Ionenkanälen in Xenopus-Oozyten mit hoher Auflösung von schnellen Kanal Kinetik ausgedrückt zu erhalten. Mit geringen Modifikationen können Spannungsklemm Fluorometrie an den aufgeschnittenen Oozyte Protokoll gekoppelt werden.
Abstract
Die aufgeschnittenen Oozyte Vaseline Spalt (COVG) Voltage-Clamp Technik erlaubt die Analyse der elektrophysiologischen und kinetischen Eigenschaften von heterologen lonenkanäle in Oozyten. Aufnahmen aus der aufgeschnittenen Setup sind besonders nützlich für die Lösung geringer Größe Gating Strömungen, schnelle Ionenstrom-Aktivierung und Deaktivierung. Die Hauptvorteile gegenüber der Zwei-Elektroden-Spannungsklemme (TEVC)-Technik sind eine erhöhte Klemmgeschwindigkeit, verbessertes Signal-Rausch-Verhältnis, und die Fähigkeit, die intrazelluläre und extrazelluläre Milieu modulieren.
Hier verwenden wir die menschlichen kardialen Natriumkanals (HNA V 1.5), ausgedrückt in Xenopus-Oozyten, die aufgeschnittenen und Setup-Protokoll sowie Änderungen, die erforderlich sind, um Spannungsklemme Fluorometrie Fähigkeit hinzufügen demonstrieren.
Die Eigenschaften der schnellen Aktivierung von Ionenkanälen, wie z. B. 1,5 V HNA, nicht vollständig in der Nähe von Raumtemperatur gelöst werden mit TEVC in which die Gesamtheit der Eizelle Membran eingespannt ist, wodurch Spannungssteuerung schwierig. In der aufgeschnittenen Technik, Isolierung von nur einem kleinen Teil der Zellmembran ermöglicht jedoch für den Schnellspann erforderlich, genau zu erfassen, während verhindert schnelle Kinetik Kanal Auslauf mit Patch-Clamp-Techniken verbunden sind.
In Verbindung mit der COVG Technik Ionenkanal Kinetik und elektrophysiologischen Eigenschaften können durch Verwendung von Spannungsklemm Fluorometrie, wo Proteinbewegung wird über Cystein Konjugation von extrazellulär aufgebracht Fluorophore, Insertion von genetisch kodierten fluoreszierenden Proteinen oder den Einbau von unnatürlichen Aminosäuren getestet werden verfolgt in der Region von Interesse 1. Diese zusätzliche Daten liefert kinetische Informationen über spannungsabhängige Konformationsänderungen des Proteins über Veränderungen in der Mikroumgebung des fluoreszierenden Moleküls.
Introduction
Specialized Spannungsklemmtechniken erlauben die Aufzeichnung von Ionenströmen bei kontrollierten Membranpotentialen. Weit verbreitet Zwei-Elektroden-Spannungsklemme (TEVC) und Patch-Clamp-Techniken liefern zuverlässige Informationen über die elektrophysiologischen Eigenschaften vieler Ionenkanäle. Jedoch haben beide Verfahren Nachteile, die den Erwerb von zuverlässigen Daten für schnellen spannungsabhängigen Natriumkanäle und andere schnell aktivierenden Kanäle in den Membranen, wie sie von Xenopus Oozyten zu verhindern. Die Bezanilla und Stefani Laboratorien entwickelt folglich die aufgeschnittenen Spalt Vaseline Voltage-Clamp Technik (COVG) für Oozyten 2. Die Technik wurde häufig angewendet, um aufzuzeichnen, Na +, K + und Ca 2 +-Kanäle 3-8.
COVG während der Aufzeichnung wird ein heterologes Protein-exprimierenden Oozyten Membran in drei Bereiche unterteilt. Die Ionenstrom-Daten von dem oberen Bereich der Eizelle als die aufgezeichneteBad um den oberen Bereich auf einen Befehl Potential, das leicht und schnell geändert werden kann, eingespannt ist. Der mittlere Bereich schützt gegen Leckströme, indem sie auf dem gleichen Potential wie der Kopfbereich 9 eingespannt. Der Bodenbereich ist, wo Eizelle Öffnung (aufgeschnittenem) durch die Verwendung eines Saponin-Lösung oder einer Kanüle erfolgt. Chemische oder manuelles Öffnen der Membran im Bodenbereich ermöglicht die Steuerung der internen Potential, das an Masse geklemmt ist, und damit ist das Zellinnere angrenzend an die untere Kammer Lösung. Perfusion von Lösungen in die untere Kammer können die Eigenschaften der inneren Umgebung anzupassen, während Lösungsaustausch in der oberen Kammer verändert die äußere Umgebung. 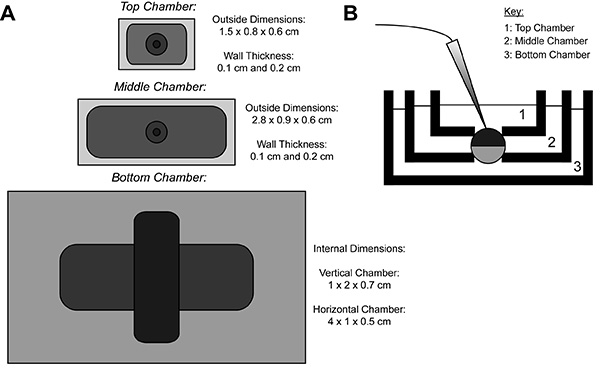
Fig. 1 ist. Eizellen Cut-Voltage-Clamp Öffnen Bad Setup-Übersicht. (A) TopSicht auf den drei Bädern voneinander getrennt. Die Abmessungen der Kammern für COVG sind in der Figur angezeigt. (B) Seitenansicht des Bäder-Setup in Testposition. Klicken Sie hier für eine größere Ansicht .
Die Vorteile der Technik COVG sind niedrige Stromrauschen (1 nA bei 3 kHz), Steuerung der Ionenzusammensetzung der externen Medien, die Fähigkeit, die internen Medien, schnelle Zeitauflösung (20-100 Mikrosekunden-Zeitkonstante des Zerfalls des modulieren Kapazität transient), und stabile Aufnahmen für mehrere Stunden 9. Die Nachteile sind, dass es erfordert spezielle Ausrüstung und es ist schwieriger durchzuführen, verglichen mit zwei Elektroden-Spannungsklemm (TEVC) 10.
Während die COVG Ansatz erfordert hoch spezialisierte Ausrüstung und komplizierte Verfahrenselemente, ist es für den Erwerb von wertvollen erlauben könnenkönnen elektrophysiologische Daten. Diese Daten, wie Anschnittströme mit schneller Kinetik und Schwanzströme 4, ohne einige der Fragen, mit anderen Klemmspannung Protokolle einschließlich Kanal heruntergekommenen verbunden aufgezeichnet werden. Kleinere Änderungen an der COVG Setup kann für den Einsatz von Temperaturregler und Spannungsklemme Fluorometrie (VCF) zu ermöglichen. Die Einbeziehung der Voltage-Clamp-Fluorometrie Elemente innerhalb der COVG Montage kann die Datenausgabe zu erhöhen durch die Übertragung die Möglichkeit, Protein Konformationsänderungen zu überwachen, während gleichzeitig Aufnahme von Strom 13.11.
Protocol
Representative Results
Discussion
Die aufgeschnittenen Eizelle Vaseline Spaltspannung Clamp-Technik ermöglicht eine schnelle Auflösung der Daten, geringes Rauschen, mehr Kontrolle über interne und externe Lösung Lösung Zusammensetzung und stabile Aufnahmen über längere Protokolle 19. Diese Vorteile setzen diese Technik abgesehen von der Standard-Zwei-Elektroden-Voltage-Clamp-und Patch-Clamp-Technik. Obwohl spezielle Ausrüstung erforderlich ist, und das Protokoll ist relativ schwierig, treten sehr wenige Probleme, sobald das System opt…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Alle Mitglieder der Washington University in St. Louis Herz Molecular Engineering Lab. Ein Burroughs Willkommen Fund Career Award in der Scientific Schnittstelle – 1010299 (JS).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

