Характеристика сложных систем по постановке эксперимента подхода: Переходный Белок Expression табачными в качестве примера
Summary
Опишем планирование эксперимента подхода, который может использоваться, чтобы определить и смоделировать влияние регуляторных элементов трансгенных, рост и развитие растений, параметров и условий инкубации на временной экспрессии моноклональных антител и репортерных белков в растениях.
Abstract
Растения обеспечивают множество преимуществ для производства биофармацевтических препаратов, включая низкие затраты, масштабируемость и безопасность. Кратковременная экспрессия предлагает дополнительное преимущество короткого развития и производства раз, но уровни экспрессии могут существенно различаться между партиями таким образом, послуживших основанием для регуляторных проблем в контексте надлежащей производственной практики. Мы использовали дизайн эксперименты (DOE) подхода для определения влияния основных факторов, таких как регуляторных элементов в конструкции экспрессии, рост растений и параметров развития, а также условия инкубации в течение выражения, по изменчивости экспрессии между партиями. Мы протестировали растения, выражающие модель анти-ВИЧ моноклональное антитело (2G12) и флуоресцентный маркер белок (DsRed). Обсуждается обоснование выбора определенных свойств модели и выявить его потенциальные ограничения. Общий подход может быть легко переведены в другие проблемы, поскольку принципы модели Авновь широко применимы: основанной на знаниях выбор параметров, снижение сложности путем разделения исходную задачу на более мелкие модули, программное обеспечение наведением установки оптимальных комбинаций эксперимента и поэтапного проектирования увеличения. Таким образом, методология не только полезно для характеристики экспрессии белка в растениях, но и для исследования других сложных систем, не имеющих механистический описание. Прогнозные уравнения, описывающие взаимосвязь между параметрами можно использовать для установления механистические модели для других сложных систем.
Introduction
Производство биофармацевтических белков в растениях является выгодным, поскольку растения являются недорогими расти, платформа может быть расширен только путем выращивания больше растений, и патогены человека не в состоянии воспроизвести 1,2. Переходные стратегии экспрессии на основе, например, на инфильтрацией листьев с Agrobacterium tumefaciens обеспечивает дополнительные преимущества, так как время между точкой доставки ДНК и доставки очищенного продукта снижается с нескольких лет до менее чем за 2 месяца 3. Переходный выражение используется также для функционального анализа, например, для тестирования генов для их способность к комплементации с потерей функции мутантов или для исследования белковых взаимодействий 4-6. Тем не менее, переходные уровни экспрессии как правило, показывают больший разброс от партии к партии, чем уровни экспрессии в трансгенных растениях 7-9. Это снижает вероятность того, что биофармацевтических производственных процессов на основе временной экспрессии Wiбудете утверждены в контексте надлежащей производственной практики (GMP), потому что воспроизводимость является атрибутом критическим качество и подлежит оценке риска 10. Такое изменение может также маскировать любые взаимодействия, что исследователи намерены провести расследование. Таким образом, мы намерены выявить основные факторы, которые влияют переходные уровни экспрессии в растениях и построить качественную количественную модель прогнозирования.
(OFAT) подход один фактор-на-а-время часто используется для характеристики воздействия (эффект) определенных параметров (факторов) на исход (ответ) эксперимента 11. Но это не является оптимальным, так как отдельные тесты (работает) в ходе расследования (эксперимент) будет приведена в соответствие, как жемчужины на нитке через потенциальный области, натянутого на факторы, которые проверены (дизайн помещения). Охват дизайн помещения и, следовательно, от степени информации, полученной из экспериментанизкий, как показано на рисунке 1A 12. Кроме того, взаимозависимости между различными факторами (коэффициент взаимодействия) может оставаться скрытым что приводит к плохим моделей и / или прогнозирования ложной оптимума, как показано на фиг.1В 13.
Недостатки, описанные выше, можно избежать с помощью планирование экспериментов (DOE) подход, в котором работает эксперимента разбросаны более равномерно в течение дизайна помещения, а это означает, что более чем один фактор варьируется между двумя отрезками 14. Существуют специализированные проекты для смесей, скрининг факторов (факторные планы) и количественная оценка воздействия фактора на ответах (методы поверхности отклика, RSM S) 15. Кроме того, RSMS может быть реализована как центральных композиционных конструкций, но также может быть достигнуто эффективно с помощью специализированного программного обеспечения, которое можно применить различные критерии для отбора трасс. Например, так называемый D-optimalitКритерий у выберет работает так, чтобы минимизировать ошибку в коэффициентах полученной модели, в то время как критерий IV-оптимальность выбирает работает, что достижения минимально дисперсию предсказания на протяжении всего дизайна помещения 15,16. РСМ мы описываем здесь позволяет точную количественную оценку временной экспрессии белка в растениях, но он может быть легко переведены в любой системе с участием нескольких (~ 5-8) числовые коэффициенты (например, температура, время, концентрация) и несколько (~ 2 – 4) категориальные факторы (например, промоутер, цвет), в котором механистический описание отсутствует или слишком сложны для моделирования.
Подход DoE возникла в сельскохозяйственных наук, но распространился на другие области, потому что это может быть передана любой ситуации, где это полезно уменьшить количество трасс, необходимых для получения достоверных данных и генерировать описательные модели для сложных процессов. Это в свою очередь привело к включению DoE в «Руководства дляПромышленность, Q8 (R2) Фармацевтическая разработка ", опубликованном Международной конференции по гармонизации технических требований к регистрации лекарственных препаратов для человека (ICH) 17. Министерство энергетики теперь широко используется в научных исследованиях и промышленности 18. Тем не менее, следует соблюдать осторожность во время планирование и проведение эксперимента, потому что выбора неправильного степень полинома для модели множественного линейного регрессионного (базовая модель) можно ввести необходимость в дополнительных трасс правильно моделировать все эффекты фактора. Кроме того, повреждены или отсутствуют данные генерировать неправильные модели и недостатки прогнозы, и даже может предотвратить любую модель здания попытку, как описано в секциях протокола и дискуссионных 18. В разделе протокола, мы первоначально установлен наиболее важные этапы планирования для эксперимента РСМ-основе, а затем объяснить дизайн, основанный на DoE Программное обеспечение DesignExpert v8.1. Однако подобные конструкции могут быть построены с другим программным обеспечением includiнг JMP, Modde и STATISTICA. Экспериментальные процедуры следуют инструкции для анализа и оценки данных.
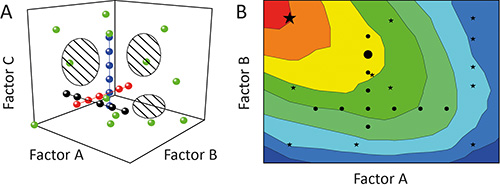
Рисунок 1. Сравнение OFAT и НОО. А. Последовательное изменение одного фактора, в то время (OFAT) в эксперименте (черный, красный и синий кружки) достигает малый охват дизайн помещения (заштрихованные области). В противоположность этому, изменение более чем один фактор за раз, используя конструкцию экспериментов (DOE) Стратегии (зеленые кружки) усиливает охват и, следовательно, точность результирующих моделей. B. Предвзятым дизайн пространства охват означает, что OFAT эксперименты (черные кружки) могут и не выявить оптимальные эксплуатационные регионы (красный) и предсказать суб-оптимальные решения (большой черный круг), в то время как Министерство энергетики стратегическиэс (черные звезды), скорее всего, определить предпочтительные условия (большой черный Star).
Protocol
Representative Results
Discussion
Каждый эксперимент требует тщательного планирования, поскольку ресурсы часто дефицитным и дорогим. Это особенно верно для стратегий Доу, так как ошибки на этапе планирования (например, выбора базовой модели, которая не покрывает все значимые взаимодействия факторов) может сущест…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы благодарны д-р Томас Радемахер для обеспечения растений вектор экспрессии PPAM и Ибрахима аль Amedi для выращивания табачные растения, используемые в данном исследовании. Мы хотели бы поблагодарить д-ра Ричарда М. Twyman за его помощь в редактировании рукописи. Эта работа была частично финансируется Европейским исследовательским советом Расширенный Грант "Future-Фарма", число предложений 269110 и Фраунгофера Zukunftsstiftung (Fraunhofer Будущее Фонд).
Materials
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Tryptone | Carl Roth GmbH | 8952.2 | Media component |
| Yeast extract | Carl Roth GmbH | 2363.2 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Ampicillin | Carl Roth GmbH | K029.2 | Antibiotic |
| Agar-Agar | Carl Roth GmbH | 5210.2 | Media component |
| Escherichia coli K12 DH5a | Life technologies | 18263-012 | Microorganism |
| pPAM | GenBank | AY027531 | Cloning/expression vector; |
| NucleoSpin Plasmid | MACHEREY-NAGEL GmbH | 740588.250 | Plasmid DNA isolation kit |
| NucleoSpin Gel and PCR Clean-up | MACHEREY-NAGEL GmbH | 740609.250 | Plasmid DNA purification kit |
| NanoDrop 2000 | Thermo Scientific | n.a. | Spectrophotometer |
| NcoI | New England Biolabs Inc. | R3193L | Restrictionendonuclease |
| EcoRI | New England Biolabs Inc. | R3101L | Restrictionendonuclease |
| AscI | New England Biolabs Inc. | R0558L | Restrictionendonuclease |
| NEB 4 | New England Biolabs Inc. | B7004S | Restrictionendonuclease buffer |
| TRIS | Carl Roth GmbH | 4855.3 | Media component |
| Disodium tetraborate | Carl Roth GmbH | 4403.3 | Media component |
| EDTA | Carl Roth GmbH | 8040.2 | Media component |
| Agarose | Carl Roth GmbH | 6352.4 | Media component |
| Bromophenol blue | Carl Roth GmbH | A512.1 | Color indicator |
| Xylene cyanol | Carl Roth GmbH | A513.1 | Color indicator |
| Glycerol | Carl Roth GmbH | 7530.2 | Media component |
| Mini-Sub Cell GT Cell | BioRad | 170-4406 | Gel electrophoresis chamber |
| Agrobacterium tumefaciens strain GV3101:pMP90RK | DSMZ | 12365 | Microorganism |
| Electroporator 2510 | Eppendorf | 4307000.658 | Electroporator |
| Beef extract | Carl Roth GmbH | X975.2 | Media component |
| Peptone | Carl Roth GmbH | 2365.2 | Media component |
| Sucrose | Carl Roth GmbH | 4621.2 | Media component |
| Magnesium sulfate | Carl Roth GmbH | 0261.3 | Media component |
| Carbenicillin | Carl Roth GmbH | 6344.2 | Antibiotic |
| Kanamycin | Carl Roth GmbH | T832.3 | Antibiotic |
| Rifampicin | Carl Roth GmbH | 4163.2 | Antibiotic |
| FWD primer | Eurofins MWG Operon | n.a. | CCT CAG GAA GAG CAA TAC |
| REV primer | Eurofins MWG Operon | n.a. | CCA AAG CGA GTA CAC AAC |
| 2720 Thermal cycler | Applied Biosystems | 4359659 | Thermocycler |
| RNAfold webserver | University of Vienna | n.a. | Software |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Grodan Rockwool Cubes 10x10cm | Grodan | n.a. | Rockwool block |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Omnifix-F Solo | B. Braun | 6064204 | Syringe |
| Murashige and Skoog salts | Duchefa | M 0222.0010 | Media component |
| Glucose | Carl Roth GmbH | 6780.2 | Media component |
| Acetosyringone | Sigma-Aldrich | D134406-5G | Phytohormon analogon |
| BioPhotometer plus | Eppendorf | 6132 000.008 | Photometer |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Synergy HT | BioTek | SIAFRT | Fluorescence plate reader |
| Biacore T200 | GE Healthcare | n.a. | SPR device |
| Protein A | Life technologies | 10-1006 | Antibody binding protein |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| Tween-20 | Carl Roth GmbH | 9127.3 | Media component |
| 2G12 antibody | Polymun | AB002 | Reference antibody |
References
- Fischer, R., Emans, N. Molecular farming of pharmaceutical proteins. Transgenic research. 9, 277-299 (2000).
- Commandeur, U., Twyman, R. M., Fischer, R. The biosafety of molecular farming in plants. AgBiotechNet. 5, 9 (2003).
- Shoji, Y., et al. A plant-based system for rapid production of influenza vaccine antigens. Influenza Other Resp. 6, 204-210 (2012).
- Goodin, M. M., Zaitlin, D., Naidu, R. A., Lommel, S. A. Nicotiana benthamiana: Its history and future as a model for plant-pathogen interactions. Mol Plant Microbe In. 21, 1015-1026 (2008).
- Berg, R. H., Beachy, R. N. Fluorescent protein applications in plants. Method Cell Biol. 85, 153 (2008).
- Chung, S. M., Vaidya, M., Tzfira, T. Agrobacterium is not alone: gene transfer to plants by viruses and other bacteria. Trends in plant science. 11, 1-4 (2006).
- Sheludko, Y. V., Sindarovska, Y. R., Gerasymenko, I. M., Bannikova, M. A., Kuchuk, N. V. Comparison of several Nicotiana species as hosts for high-scale Agrobacterium-mediated transient expression. Biotechnology and Bioengineering. 96, 608-614 (2007).
- Wydro, M., Kozubek, E., Lehmann, P. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana. Acta Biochimica Polonica. 53, 289-298 (2006).
- Buyel, J. F., Fischer, R. Processing heterogeneous biomass: Overcoming the hurdles in model building. Bioengineered. 4, (2013).
- Fischer, R., Schillberg, S., Hellwig, S., Twyman, R. M., Drossard, J. GMP issues for recombinant plant-derived pharmaceutical proteins. Biotechnol Adv. 30, 434-439 (2012).
- Daniel, C. One-at-a-time plans. Journal of the American Statistical Association. 68, 353-360 (1973).
- Czitrom, V. One-Factor-at-a-Time versus Designed Experiments The American Statistician. 53, 6 (1999).
- Anderson, M. J., Kraber, S. L. Keys to successful designed experiments. ASQ – The global voice of quality. 6, 6 (1999).
- Montgomery, D. C. . Design and Analysis of Experiments. , (2007).
- Myers, R. H., Montgomery, D. C., Anderson-Cook, C. M. . Response Surface Methodology: Process and Product Optimization Using Designed Experiments. , (2009).
- Piepel, G. F. Programs for generating extreme vertices and centroids of linearly constrained experimental regions. J Qual Technol. 20, 15 (1988).
- . . FDA. , (2009).
- Shivhare, M., McCreath, G. Practical Considerations for DoE Implementation in Quality By Design. BioProcess International. 8, 9 (2010).
- Buyel, J. F., Fischer, R. Predictive models for transient protein expression in tobacco (Nicotiana tabacum L.) can optimize process time, yield, and downstream costs. Biotechnology and bioengineering. 109, 2575-2588 (2012).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnology and bioengineering. 110, 471-482 (2013).
- Anderson, M. J., Whitcomb, P. J. . DOE Simplified: Practical Tools for Effective Experimentation. , (2000).
- Anderson, M. J., Whitcomb, P. J. . Response Surface Methods Simplified. , (2005).
- De Gryze, S., Langhans, I., Vandebroek, M. Using the correct intervals for prediction: A tutorial on tolerance intervals for ordinary least-squares regression. Chemometr Intell Lab. 87, 147-154 (2007).
- . . Plasmid DNA purification User manual. , (2012).
- . . PCR clean-up Gel extraction User manual. , (2012).
- . . Quick Ligation Protocol. 4, (2009).
- Inoue, H., Nojima, H., Okayama, H. High-Efficiency Transformation of Escherichia-Coli with Plasmids. Gene. 96, 23-28 (1990).
- Main, G. D., Reynolds, S., Gartland, J. S. Electroporation protocols for Agrobacterium. Methods in Molecular Biology. 44, 405-412 (1995).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neubock, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic acids research. 36, 70-74 (2008).
- Howell, S., Kenmore, M., Kirkland, M., Badley, R. A. High-density immobilization of an antibody fragment to a carboxymethylated dextran-linked biosensor surface. J Mol Recognit. 11, 200-203 (1998).
- Newcombe, A. R., et al. Evaluation of a biosensor assay to quantify polyclonal IgG in ovine serum used for the production of biotherapeutic antibody fragments. Process Biochem. 41, 842-847 (2006).
- Peixoto, J. L. Hierarchical Variable Selection in Polynomial Regression-Models. Am Stat. 41, 311-313 (1987).
- Peixoto, J. L. A Property of Well-Formulated Polynomial Regression-Models. Am Stat. 44, 26-30 (1990).
- Sanders, P. R., Winter, J. A., Barnason, A. R., Rogers, S. G., Fraley, R. T. Comparison of cauliflower mosaic virus 35S and nopaline synthase promoters in transgenic plants. Nucleic acids research. 15, 1543-1558 (1987).
- Ma, J. K. C., et al. Generation and Assembly of Secretory Antibodies in Plants. Science. 268, 716-719 (1995).
- Wycoff, K. L. Secretory IgA antibodies from plants. Curr Pharm Design. 11, 2429-2437 (2005).
- Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., Gray, T. How to measure and predict the molar absorption coefficient of a protein. Protein Sci. 4, 2411-2423 (1995).

