Préparation de l'ADN réticulé polyacrylamide hydrogels
Summary
Notre laboratoire a développé des hydrogels de polyacrylamide ADN réticulé, un système d'hydrogel dynamique, afin de mieux comprendre les effets de la modulation de la rigidité des tissus sur la fonction cellulaire. Ici, nous fournissons des schémas, des descriptions et des protocoles pour préparer ces hydrogels.
Abstract
Mécanobiologie est un domaine scientifique émergent qui porte sur le rôle critique de repères physiques dans la direction de la morphologie et de la fonction des cellules. Par exemple, l'effet de l'élasticité des tissus sur la fonction cellulaire est un domaine de recherche important de mécanobiologie car la rigidité des tissus module à la maladie, le développement, et les blessures. Statique des matériaux de tissus imitant ou des matériaux qui ne peuvent pas modifier la rigidité fois que les cellules sont étalées, sont principalement utilisés pour étudier les effets de la rigidité des tissus sur les fonctions cellulaires. Bien que les informations recueillies à partir d'études statiques est précieux, ces études ne sont pas représentatifs de la nature dynamique du microenvironnement cellulaire in vivo. Pour mieux cerner les effets de la rigidité dynamique sur la fonction cellulaire, nous avons développé un système hydrogel de polyacrylamide ADN réticulé (gels d'ADN). Contrairement à d'autres substrats dynamiques, des gels d'ADN sont capables de diminuer ou d'augmenter la rigidité après la fabrication sans stimuli. les gels sont constitués d'ADN de l'ADN crossldes encres qui sont polymérisés dans un squelette de polyacrylamide. Ajout et suppression de liaisons transversales par délivrance d'ADN simple brin permet temporelle, spatiale, et le contrôle réversible de gel élasticité. Nous avons montré que dans les rapports précédents modulation dynamique de gel d'ADN élasticité influe sur le comportement des fibroblastes et des neurones. Dans le présent rapport et la vidéo, nous fournissons un schéma qui décrit le gel d'ADN mécanismes de réticulation et des instructions étape-par-étape sur les gels d'ADN de préparation.
Introduction
Substrats statiques et dynamiques sont deux catégories de biomatériaux qui ont été développés pour étudier les effets de l'élasticité des tissus ou de la rigidité sur la fonction cellulaire. Substrats statiques sont incapables de modifier leurs propriétés physiques après ils sont fabriqués et / ou une fois les cellules sont étalées. Polyacrylamide (PA) ont été les premiers gels, des substrats statiques à deux dimensions qui ont été synthétisés pour les enquêtes sur mécanobiologie 5,17. Gels PA sont faciles à préparer, peu coûteux, polyvalent, et peuvent être fabriqués avec une large gamme de modules d'élasticité. Bien que ces avantages techniques font PA gélifie un substrat communément appliqué, substrats statiques ne sont pas représentatifs de la nature dynamique de la matrice extracellulaire (MEC) et entourant environnement cellulaire in vivo. Par exemple, l'ECM subit des altérations rigidité à la suite de blessures, le développement ou la maladie. Substrats dynamiques sont donc favorisés que les modèles de substrat tissus imitant dans les études de mécanobiologie <sup> 22,24,25.
De nombreux synthétique, deux dimensions, biomatériaux, en trois dimensions, statiques, dynamiques et naturelles ont été développées pour imiter la rigidité des tissus 1,3,6,16,23,26. Certains supports dynamiques ont besoin de chaleur, UV, le courant électrique, les ions, et des changements de pH de modifier leurs propriétés mécaniques 2,4,7,8,12,15,16, mais ces stimuli peuvent restreindre bio-demande de l'hydrogel. Hydrogels de polyacrylamide ADN réticulé (gels d'ADN) sont des substrats élastiques en deux dimensions dynamiques. réticulations d'ADN permettent la modulation temporelle, spatiale et réversible de rigidité de gel de l'ADN par addition de l'ADN simple brin (ADNsb) un support ou un tampon 9-11,13,14,18,21. Contrairement aux gels dynamiques mentionnées ci-dessus, où les stimuli sont appliqués pour la modulation de l'élasticité, les gels d'ADN s'appuient sur la diffusion de l'ADN sb appliquée pour la modification de l'élasticité. Par conséquent, la surface supérieure du gel, où les cellules sont cultivées, la première zone est modulé en raison du taux of élasticité modulation dépend de l'épaisseur du gel.
des gels d'ADN sont identiques à leurs homologues de gel PA en ce sens qu'ils ont un squelette de polyacrylamide, cependant, les liaisons croisées de bis-acrylamide sont remplacées par des liaisons transversales composées d'ADN (Figure 1). Deux ADNsb (SA1 et SA2) s'hybrident avec un brin d'agent de réticulation (L2) pour compenser les réticulations d'ADN du gel. SA1 et SA2 ont des séquences distinctes qui contiennent tous deux une modification Acrydite à la fin 5'pour l'incorporation effective dans le réseau d'aires protégées. Pour la préparation de gels, SA1 et SA2 sont polymérisés individuellement dans un squelette PA et, par la suite, le SA1 et SA2 polymérisé sont mélangés ensemble. L2, l'agent de réticulation, on ajoute à la SA1 et SA2 mélange. La séquence de bases L2 est complémentaire à la fois des séquences SA1 et SA2 et L2 s'hybride avec SA1 SA2 ainsi que pour former les liaisons de reticulation de l'ADN. Initial, le gel de l'ADN est déterminée par l'élasticité des deux concentrations de réticulation et L2 (tableaux 1 </strong> et 2). gels d'ADN contenant des quantités stoechiométriques égales de L2, SA1, SA2 et les gels rigides parce SA1 et SA2 sont 100% réticulé par L2 (désigné comme 100% de gels). Des concentrations plus faibles de résultat L2 dans un pourcentage plus faible de l'ADN réticulation et, par conséquent, plus doux gels d'ADN. Gels aussi bas que 50% réticulé (désigné comme 50% de gels) ont été construits 9-11.
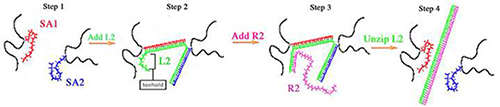
Figure 1: gel de l'ADN réticulation et uncrosslinking schématique 9-11,13,14,18,21. Etape 1: SA1 (rouge) et SA2 (bleu) sont polymérisés individuellement dans un squelette de polyacrylamide (noir). Après la polymérisation, les solutions polymérisées SA1 et SA2 sont mélangés ensemble. Etape 2: L2 (en vert) est ajouté et s'hybride avec SA1 SA2 en plus pour former les liaisons de reticulation du gel. Étape 3: R2 s'hybride avec til prendre pied de L2. Étape 4: hybridation prendre pied de R2 propulse la décompression de L2 de SA1 et SA2.
Contrairement gels PA, gels d'ADN peuvent durcir et adoucir après la synthèse. Pour cette raison, les cellules cultivées sur des gels d'ADN peuvent être soumis à des modifications de la raideur dynamique. Pour rigidifier les gels de cellules adhérentes, L2 peut être ajouté au milieu de culture de gels faibles pourcentages d'augmenter le pourcentage de liaisons de réticulation. Pour ramollir des gels de cellules adhérentes, L2 peut être enlevé pour diminuer le pourcentage de liaisons transversales 10,13,21. L2 a une séquence complémentaire de prendre pied à l'extrémité 3 'afin de permettre à L2 uncrosslink de SA1 et SA2 (tableau 1). L'élimination de L2 est réalisée par hybridation d'un brin d'inversion appelé R2. R2 est complémentaire de la longueur de L2 et s'hybride avec le premier prendre pied L2. Prendre pied hybridation propulse la décompression de L2 de SA1 et SA2, ce qui élimine la réticulation et réduit la rigidité de gel.
Dans le présent rapport etvidéo, étape par étape, des instructions sont fournies pour la préparation de gels de raidissement et l'adoucissement de l'ADN. Alors que 100% et 80% des préparations de gel sont décrits, ce protocole peut être adapté pour créer des gels d'ADN d'autres pourcentages réticulé initial et final. En général, 100% et 80% de gels sont préparés, immobilisées sur des lamelles de verre, fonctionnalisés, et ensemencées avec des cellules. L2 est ajouté au milieu de 80% de gels et R2 est ajouté au milieu de 100% de gels, de 48 h après l'ensemencement. L'ajout de L2 aux médias raidit 80% de gels à 100% réticulé, tandis que l'addition de R2 aux médias adoucit 100% de gels à 80% réticulé. Gels raidies sont désignés comme 80 → 100% de gels et gels adoucies sont désignés comme 100 → 80% de gels dans le texte. Pour le contrôle ou gels statiques, ADN simple brin constitué de Ts ou As est livré à un autre ensemble de 100% et 80% de gels. Après un minimum de deux jours suivants élasticité modulation, les cellules peuvent être traitées et analysées.
<table border="0" cellpadding="0" cellspacing="0" fo:keep-together.within page = "always">Tableau 1: séquences de base pour ssADN 9-11,13,14,18,21. Cellulaire et des études mécaniques ont utilisés plusieurs dconceptions de réticulation ifférents pour générer des gels d'ADN avec une gamme de propriétés mécaniques statiques et dynamiques. Les paramètres modulés dans la conception de réticulation sont séquence de base et durée de la séquence ou de la longueur de réticulation. Les caractères gras et en italique illustrent appariement de bases entre SA1 et SA2 entre L2 et L2 et, respectivement.
| Conception | ||||||||
| 1 | 2 | 3 | ||||||
| Acrylamide Concentration (%) | 10 | 10 | 10 | 4 | ||||
| SA1 SA2, plus hybride à L2 (% réticulé) | 50 | 80 | 100 | 50 | 80 | 100 | 100 | 100 |
| <strong> Elasticité (kPa, moyenne ± SEM) | 6,6 ± 0,6 | 17,1 ± 0,8 | 29,8 ± 2,5 | 5,85 ± 0,62 | 12,67 ± 1,33 | 22,88 ± 2,77 | 25,2 ± 0,5 | 10,4 ± 0,6 |
Tableau 2 Le module de Young (E) de gels d'ADN. 9-11,13,14,18,21 concentration de l'acrylamide, le pourcentage de reticulation, et la durée de reticulation peut être modulée dans des gels d'ADN. Designs 1, 2, et 3 ont 20, 28 et 40 pb longueurs de réticulation, respectivement. 100% de gels pour tous les modèles ont des modules semblables indiquant la longueur de réticulation ne pas affecter gel élasticité. Cependant, les variations de la concentration d'acrylamide modifient gel d'ADN élasticité.
Protocol
Representative Results
Discussion
La capacité de gels d'ADN pour adoucir ou raidir avant et après l'adhésion cellulaire en fait un modèle idéal pour étudier le rôle de la raideur dynamique en fonction du tissu cellulaire. Ces trois modèles ont été utilisés dans les études biologiques et mécaniques. Toutefois, les trois modèles ont des élasticités semblables à différents pourcentages de réticulation, indiquant la longueur de réticulation n'influence pas l'élasticité de gel d'ADN (tableau 2). En r…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs tiennent à remercier: Dr Frank Jiang, le Dr David Lin, le Dr Bernard Yurke et le Dr Uday Chippada pour leurs contributions sur le développement de la technologie d'ADN sur gel; Dr Norell Hadzimichalis, Smit Shah, Kimberly Peterman, Robert Arter pour leurs commentaires et modifications de ce manuscrit; sources de financement, y compris la Commission du New Jersey sur la moelle épinière de la recherche (subvention no 07A-019-SCR1, NAL) et du New Jersey Institut des Neurosciences (MLP); et les éditeurs de génie tissulaire, la partie A pour obtenir la permission de réimprimer les figures 2 et 4 et des biomatériaux pour l'autorisation de reproduire la figure 3.
Materials
| ssDNA | Integrated DNA Technologies (Coralville, Iowa) idtdna.com |
Do not vortex ssDNA. Gentle invert the vial and/or pipette solution to mix. | |
| PBS with calcium and magnesium | Any brand. | ||
| 100X Tris-EDTA buffer (TE buffer) | Sigma-Aldrich (St. Loius, MO) sigmaldrich.com |
T9285 | |
| 10X Tris-Borate-EDTA buffer (TBE buffer) | Sigma-Aldrich (St. Loius, MO) | 93290 | TBE is a reproductive toxin. |
| 40% Acrylamide solution | Fisher Scientific (Pittsburg, PA) | BP14021 | Acrylamide is a toxin. |
| Ammonium persulfate (APS) | Sigma-Aldrich (St. Loius, MO) | A3678 | Prepare a 2% solution in TE buffer. APS is a toxin and irratant. |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St. Loius, MO) | T9281 | Prepare a 20% solution in TE buffer. TEMED is flammable, a corrosive, and a toxin. |
| 12-mm diameter round coverglass | Fisher Scientific (Pittsburg, PA) fishersci.com |
12-545-82 | |
| Norland optical adhesive 72 | Norland Products (Cranbury, NJ) norlandprod.com |
NOA72 | |
| 24-well tissue culture plate | Any brand. | ||
| Microcentrifuge tubes | Any brand. | ||
| Sulfo-SANPAH | ProteoChem or Thermo Fisher, (Rockland, IL) proteochem.com or thermofisher.com |
C111 or 22589 | Prepare a 0.315 mg/ml solution in water immediately before use. Dissolve at 37°C and filter sterilze. It is normal to observe undisolved sulfo-SANPAH in the filter. Sulfo-SANPAH is light sensitive and, therefore, the solution should be protect from light until UV exposure. |
| Poly-D-Lysine (PDL) | Sigma-Aldrich (St. Loius, MO) | P6407 | Prepare a 0.2 mg/ml solution in water and filter sterilize. |
| Collagen Type I | Affymetrix (Santa Clara, CA) affymetrix.com |
13813 | Prepare a 0.2 mg/ml solution in 0.2 N acetic acid. Solution needs to remain cold at all times to avoid polymerization. Acetic acid is a flammable, toxic, and corrosive. |
| 22 X 60 cover glass | Fisher Scientific (Pittsburg, PA) | 12-544-G | |
| Positive-displacement pipette | Gilson, Inc (Middletown, WI) gilson.com |
F148504 | |
| Heat block | Fisher Scientific (Pittsburg, PA) | 11-718 | |
| UV light source | Place gels as close as possible to the UV light. UV light can cause skin or eye injury. | ||
| Thermometer | Any brand. | ||
| Nitrogen gas | GTS-Welco (Flemington, NJ) www.praxairmidatlantic.com/ |
NI 5.0UH-R |
References
- Balaban, N. Q., et al. Force and focal adhesion assembly A close relationship studied using elastic micropatterned substrates. Nat Cell Biol. 3 (5), 466-472 (2001).
- Peppas Brannon-Peppas, L., Peppas, N. A. Dynamic and equilibrium swelling behaviour of ph-sensitive hydrogels containing 2-hydroxyethyl methacrylate. Biomaterials. 11 (9), 635-644 (1990).
- Charati, M. B., Ifkovits, J. L., Burdick, J. A., Linhardt, J. G., Kiick, K. L. Hydrophilic elastomeric biomaterials based on resilin-like polypeptides. Soft Matter. 5 (18), 3412-3416 (2009).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32 (9), 2285-2293 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophys J. 76 (4), 2307-2316 (1999).
- Gray, D. S., Tien, J., Chen, C. S. Repositioning of cells by mechanotaxis on surfaces with micropatterned youngs modulus. J Biomed Mater Res A. 66 (3), 605-614 (2003).
- Homma, M., Seida, Y., Nakano, Y. Effect of ions on the dynamic behavior of an electrodriven ionic polymer hydrogel membrane. Journal of applied Polymer Science. 82 (1), 76-80 (2001).
- Horkay, F., Tasaki, I., Basser, P. J. Osmotic swelling of polyacrylate hydrogels in physiological salt solutions. Biomacromolecules. 1 (1), 84-90 (2000).
- Jiang, F. X., Yurke, B., Firestein, B. L., Langrana, N. A. Neurite outgrowth on a DNA crosslinked hydrogel with tunable stiffnesses. Ann Biomed Eng. 36 (9), 1565-1579 (2008).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. Effect of dynamic stiffness of the substrates on neurite outgrowth by using a DNA-crosslinked hydrogel. Tissue Engineering Part A. 16 (6), 1873-1889 (2010).
- Jiang, F. X., Yurke, B., Schloss, R. S., Firestein, B. L., Langrana, N. A. The relationship between fibroblast growth and the dynamic stiffnesses of a DNA crosslinked hydrogel. Biomaterials. 31 (6), 1199-1212 (2010).
- Kloxin, A. M., Tibbitt, M. W., Anseth, K. S. Synthesis of photodegradable hydrogels as dynamically tunable cell culture platforms. Nat Protoc. 5 (12), 1867-1887 (2010).
- Lin, D. C., Yurke, B., Langrana, N. A. Mechanical properties of a reversible, DNA-crosslinked polyacrylamide hydrogel. J Biomech Eng. 126 (1), 104-110 (2004).
- Lin, D. C., Yurke, B., Langrana, N. A. Use of rigid spherical inclusions in young’s moduli determination: Application to DNA-crosslinked gels. J Biomech Eng. 127 (4), 571-579 (2005).
- Luo, Y., Shoichet, M. S. Light-activated immobilization of biomolecules to agarose hydrogels for controlled cellular response. Biomacromolecules. 5 (6), 2315-2323 (2004).
- Marklein, R. A., Burdick, J. A. Spatially controlled hydrogel mechanics to modulate stem cell interactions. Soft Matter. 6 (1), 136-143 (2010).
- Pelham Jr, R. J., Wang, Y. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci U S A. 94 (25), 13661-13665 (1997).
- Previtera, M. L., Chippada, U., Schloss, R. S., Yurke, B., Langrana, N. A. Mechanical properties of DNA-crosslinked polyacrylamide hydrogels with increasing crosslinker density. BioResearch Open Access. 1 (5), 256-259 (2012).
- Previtera, M. L., Langhammer, C. G., Firestein, B. L. Effects of substrate stiffness and cell density on primary hippocampal cultures. J Biosci Bioeng. 110 (4), 459-470 (2010).
- Previtera, M. L., Langhammer, C. G., Langrana, N. A., Firestein, B. L. Regulation of dendrite arborization by substrate stiffness is mediated by glutamate receptors. Ann Biomed Eng. 38 (12), 3733-3743 (2010).
- Previtera, M. L., Trout, K. L., Verma, D., Chippada, U., Schloss, R. S., Langrana, N. A. Fibroblast morphology on dynamic softening of hydrogels. Ann Biomed Eng. 40 (5), 1061-1072 (2012).
- Saxena, T., Gilbert, J., Stelzner, D., Hasenwinkel, J. Mechanical characterization of the injured spinal cord after lateral spinal hemisection injury in the rat. J Neurotrauma. 29 (9), 1747-1757 (2012).
- Sundararaghavan, H. G., Monteiro, G. A., Firestein, B. L., Shreiber, D. I. Neurite growth in 3d collagen gels with gradients of mechanical properties. Biotechnol Bioeng. 102 (2), 632-643 (2009).
- Wozniak, M. A., Chen, C. S. Mechanotransduction in development A growing role for contractility. Nat Rev Mol Cell Biol. 10 (1), 34-43 (2009).
- Wuerfel, J., et al. Mr-elastography reveals degradation of tissue integrity in multiple sclerosis. Neuroimage. 49 (3), 2520-2525 (2012).
- Zaari, N., Rajagopalan, P., Kim, S. K., Engler, A. J., Wong, J. Y. Photopolymerization in microfluidic gradient generators Microscale control of substrate compliance to manipulate cell response. Adv Mater. 16 (23-24), 2133-2137 (2004).

