Mince couche chromatographique (CCM) Séparations et essais biologiques d'extraits végétaux pour identifier des composés antimicrobiens
Summary
Des méthodes sont décrites pour chromatographie sur couche mince (CCM) la séparation d'extraits de plantes et le contact bioautographie pour identifier les métabolites antibactériens. Les méthodes sont appliquées à la sélection de composés phénoliques de trèfle rouge inhibant les bactéries hyper-production d'ammoniac (HAB) originaires de la panse de bovin.
Abstract
Un écran commun pour les composés antimicrobiens de plantes consiste en la séparation d'extraits de plantes en papier ou en chromatographie sur couche mince (PC ou TLC), ce qui expose les chromatogrammes de suspensions microbiennes (par exemple, de champignons ou de bactéries dans un bouillon ou la gélose), laissant du temps pour les microbes de se développer en un environnement humide, et la visualisation des zones de pas de croissance microbienne. L'efficacité de cette méthode de dépistage, connu sous le nom bioautographie, dépend à la fois de la qualité de la séparation chromatographique et le soin apporté aux conditions de cultures microbiennes. Ce document décrit les protocoles standards pour la CCM et le contact bioautographie avec une nouvelle application aux acides des bactéries d'acide de fermentation. L'extrait est séparé sur flexibles (support aluminium) des plaques de CCM de silice, et les bandes sont visualisées sous lumière ultraviolette (UV). Les zones sont découpées et incubées visage vers le bas sur de la gélose inoculé avec le micro-organisme d'essai. Bandes inhibitrices sont visualisés par coloration de la plaque de géloses avec tétrazolium rouge. Le procédé est appliqué à la séparation de trèfle rouge (Trifolium pratense cv. Kenland) des composés phénoliques et leur criblage pour l'activité contre Clostridium sticklandii, une bactérie produisant de l'ammoniac hyper (HAB) qui est natif de la panse de bovin. Les procédés de CCM s'appliquent à de nombreux types d'extraits de plantes et d'autres espèces bactériennes (aérobie ou anaérobie), ainsi que les champignons, peuvent être utilisés comme organismes d'essai, si les conditions de culture sont modifiées pour être compatibles avec les exigences de l'espèce de croissance.
Introduction
Le dosage de composés antimicrobiens dans des plantes nécessite la séparation des constituants d'un extrait de plante, l'exposition d'un micro-organisme d'essai à ces composants, et pour déterminer si la croissance du micro-organisme est inhibée par l'un quelconque des composés. Séparations par papier ou chromatographie sur couche mince (CCM ou PC) sont pratiques car de nombreux composés peuvent être séparés sur une surface plane. La séparation est basée sur la polarité, avec des composés de liaison étanche à l'adsorbant (cellulose dans le cas de PC, et une variété d'adsorbants dans le cas de la Chromatographie sur couche mince) et la migration de moins que les autres une. Figure 1 donne un exemple de la position relative des des composés phénoliques polaires et non polaires après la séparation sur une plaque de TLC de silice.
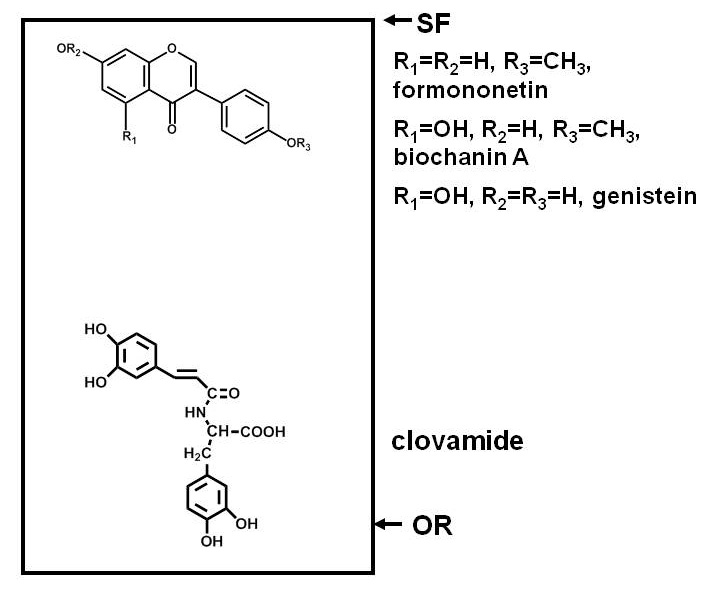
Figure 1. Diagramme illustrant la répartition des composés de polarités différentes après la séparation sur une couche mince de silice chromatographique (CCM) plaque. Composés phénoliques de trèfle rouge (Trifolium pratense L.) sont utilisés comme un exemple. Des composés polaires tels que le clovamide, ont une forte affinité pour un adsorbant polaire comme le silice et restent près de l'origine (OR), alors que moins de composés polaires, tels que les trois isoflavones près du front de solvant (SF), partition plus facilement dans les solvants (qui sont moins polaires que la silice à moins que l'eau, des acides ou des bases sont incluses) et de migrer plus haut sur la plaque.
Après séparation de l'extrait sur une plaque de CCM, les micro-organismes d'essai peuvent être exposés à tous les composés de la plaque, en accélérant ainsi l'identification des composants actifs de l'extrait 2. Si une culture fongique ou bactérienne est exposé au chromatogramme, la croissance microbienne se produit partout sauf sur les zones où la croissance inhibiteurcomposés y. Zones d'inhibition peuvent ensuite être visualisées en observant le contraste entre la croissance du mycélium et les zones de libre-croissance si les champignons ont été appliquées 3 ou par pulvérisation avec des composés qui changent de couleur lorsqu'ils sont réduits ou hydrolysé par des cellules vivantes 4. Bien que l'utilisation de papier ou couche mince chromatogrammes pour les tests antimicrobiens a été d'abord appliquée aux antibiotiques et fongicides 5 3,6, extraits de plantes sont maintenant souvent masqués pour les composés antimicrobiens avec cette méthode, souvent appelés bioautographie. Les protocoles décrits ici s'appliquent à bioautographie de chromatogrammes en couche mince. TLC est largement utilisé parce qu'il est relativement rapide et peut être effectué sur les différents adsorbants (par exemple, la silice, l'amidon, l'alumine), ainsi que de fournir une bonne résolution et une sensibilité.
Les extraits de plantes peuvent être préparés pour TLC dans de nombreuses façons. Les méthodes courantes comprennent le matériel végétal extraction dans alcdes mélanges tels que l'éthanol à 80% 7,8, éventuellement avec l'addition d'acide ou de base 9 ohol à l'eau. Suite à une extraction dans de tels solvants, qui contiennent un peu d'eau et sont peut-être acide ou basique, les extraits doivent être concentrées de sorte qu'ils peuvent être appliqués à des plaques de CCM dans un volume minimal. La concentration des extraits d'alcool dans l'eau peut être obtenue en divisant l'aide de solvants organiques non miscibles à l'eau 8 ou avec un mélange de tels solvants, tels que l'éther éthylique-acétate d'éthyle (1:1, v / v) 10,11. Métabolites de plantes différentes sont extraits dans différents solvants organiques, en fonction de leur polarité. Pour s'assurer que les acides ou les bases organiques végétaux sont extraits dans des solvants organiques, à ce stade, le pH d'un extrait d'alcool dans l'eau peut être élevé ou abaissé avec un acide ou une base soluble dans l'eau pour convertir les analytes dissociées en leurs formes non dissociée, qui sont ensuite soluble dans les solvants organiques neutres 9. La phase organique peut alors être evaporated sous pression réduite ou sous atmosphère d'azote et on ajuste le volume souhaité pour la CCM. Le pH de l'extrait est peu susceptible d'être létale pour les micro-organismes dans les essais biologiques en raison de la séparation des analytes dans des solvants neutres, petit volume final, et l'évaporation de l'extrait sur la plaque de CCM avant la séparation.
Les champignons et les bactéries sont utilisées comme des micro-organismes d'essai dans bioautographie d'extraits de plantes 2. Les spores de certains champignons tels que Cladosporium cucumerinum, germent sur des plaques de CCM (en dehors des zones avec des composés inhibiteurs) si pulvérisée sur les plaques dans une solution nutritive et on les incube dans un environnement humide pendant plusieurs jours 3. Le mycélium foncé de C. cucumerinum sur les zones non inhibitrice offre un contraste frappant avec les zones franches de la croissance du mycélium. Bien que les bactéries ont été appliquées à une Chromatographie sur couche mince (CCM) des plaques de la même manière 4,12, les bactéries sont également versé sur TLCsurfaces de la plaque de gélose superpositions 13,14. Levure, telle que Candida albicans, peut être appliquée dans les superpositions de gélose ainsi 14. Alternativement, des plaques de CCM peuvent être placés face vers le bas sur une gélose inoculée avec des bactéries ou des levures 10,15 8, un procédé connu sous le nom de contact bioautographie 2.
Nous décrivons une méthode pour le contact bioautographie pour cribler des composés phénoliques antimicrobiens du trèfle rouge (Trifolium pratense cv. Kenland). Le micro-organisme test est Clostridium sticklandii, une bactérie du rumen hyper ammoniac-production (HAB) et obliger anaérobie. Bien que les séparations utilisées ne résolvent pas tous les composants de l'extrait, elles facilitent l'identification des zones d'activité antimicrobienne, réduisant ainsi la piscine de composés antimicrobiens possibles. Le protocole utilise des procédures standard pour la CCM 1. Le protocole décrit également certaines des techniques requises pour la culture obligationsgrille anaérobies pour un tel essai, l'utilisation d'un bio-autographie de contacts 15 et un procédé de visualisation avec un sel de tétrazolium, qui colore les cellules vivantes 2,4.
Protocol
Representative Results
Discussion
Ce protocole décrit un procédé simple pour la séparation d'un extrait en sous-ensembles de composés et de dosage de ces sous-ensembles contact par bioautographie. Le procédé est tout à fait similaire à celui utilisé par Chomnawang et al. 15 pour cribler des inhibiteurs de métabolites de plantes à des bactéries responsables de la gonorrhée. Le type de bioautographie employé à l'écran pour les composés de plantes antimicrobiens dépend de nombreux facteurs, y compris la micro-…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous remercions le regretté Dr Norm Taylor, Département des plantes et de la science du sol à l'Université du Kentucky, pour nous permettre d'utiliser des échantillons de ses parcelles de trèfle rouge pour cette étude. Ce projet a été financé par le ministère de l'Agriculture des États-Unis.
Materials
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 × 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 × 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50-µL syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µL. Alternative sources are equivalent. |
| micropipets | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 × 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4-Watt or 6-Watt bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2 HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7 H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7 H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4 H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6 H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2 H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6 H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2 H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6 H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2 H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 |
References
- Stahl, E., Ashworth, M. R. F. . Thin-layer chromatography. , (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 .
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 .
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. . The Organic Constituents of Higher Plants. , (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 .
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 .
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).

