Tunnskiktskromatografisk (TLC) Separationer och Bioanalyser av växtextrakt för att identifiera antimikrobiella föreningar
Summary
Metoder beskrivs för tunnskiktskromatografisk (TLC) separation av växtextrakt och kontakt bioautografi att identifiera antibakteriella metaboliter. Metoderna tillämpas på screening av rödklöver fenolföreningar som hämmar hyper ammoniakproducerande bakterier (HAB) hemma i nötkreatur våmmen.
Abstract
En gemensam skärm för växtantimikrobiella föreningar består av separerande växtextrakt av papper eller tunn-skiktskromatografi (PC eller TLC), utsätta kromatogrammen till mikrobiala suspensioner (t.ex. svampar eller bakterier i buljong eller agar), vilket ger tid för mikroberna att växa i en fuktig miljö, och visualisera zoner utan mikrobiell tillväxt. Effekten av denna screeningmetod, kallad bioautografi, beror på både kvaliteten på den kromatografiska separationen och den omsorg med mikrobiella odlingsbetingelser. Detta dokument beskriver standardprotokoll för TLC och kontakt bioautografi med en ny ansökan till aminosyra-jäsande bakterier. Extraktet separeras på flexibla (aluminium-backed) kiseldioxid-TLC-plattor, och banden visualiserades under ultraviolett (UV) ljus. Zoner skärs ut och odlades sidan nedåt på agar inokuleras med testmikroorganismen. Hämmande band visualiseras genom färgning agarplattans med tetrazolium rött. Metoden tillämpas på separation av rödklöver (Trifolium pratense cv. Kenland) fenolföreningar och deras screening för aktivitet mot Clostridium sticklandii, en hyperammoniakproducerande bakterie (HAB) som hör hemma i nötkreatur våmmen. TLC-metoder som tillämpas på många typer av växtextrakt och andra bakteriearter (aeroba eller anaeroba), liksom svampar, kan användas som testorganismer om odlingsbetingelserna modifieras för att passa tillväxtkrav arten.
Introduction
Testmetoder för antimikrobiella föreningar i växter kräver separation av komponenterna i ett växtextrakt, utsätta en testmikroorganism till dessa komponenter, och bestämning av huruvida mikroorganismen tillväxt inhiberas av någon av föreningarna. Separationer av papper eller tunnskiktskromatografi (PC eller TLC) är praktiskt eftersom många föreningar kan separeras på en plan yta. Separation bygger på polaritet, med vissa föreningar binder hårt till adsorbenten (cellulosa vid datorn, samt en mängd olika adsorbenter i fallet med TLC) och migrerar mindre än andra 1. Figur 1 visar ett exempel på de relativa positionerna för polära och opolära fenolföreningar efter separation på en kvarts TLC-platta.
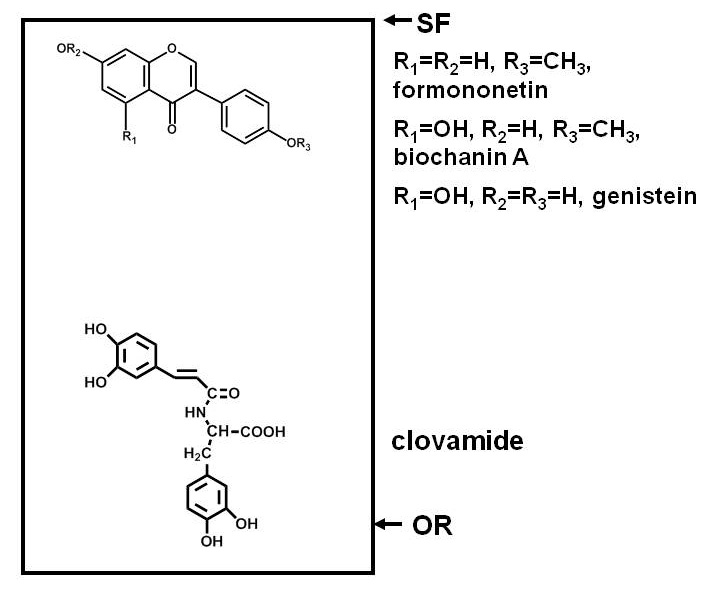
Figur 1. Diagram som visar fördelningarna av föreningar med olika polariteter efter separation på en kiseldioxid tunnskiktskromatografisk (TLC)-platta. Fenolföreningar av rödklöver (Trifolium pratense L.) används som ett exempel. Polära föreningar, såsom clovamide, har en stark affinitet för en polär adsorbent som kiseldioxid och förbli nära origo (OR), medan mindre polära föreningar, såsom de tre isoflavoner nära lösningsmedelsfronten (SF), partition lättare i lösningsmedlen (som är mindre polära än kisel om inte vatten, syror eller baser ingår) och vandrar längre upp plattan.
Efter separation av ett extrakt på en TLC-platta, kan testmikroorganismer utsättas för alla föreningar på plattan, vilket leder till snabbare identifiering av de aktiva komponenterna i ett extrakt 2. Om en svamp-eller bakterieodling utsätts för kromatogrammet kommer mikrobiell tillväxt inträffa överallt utom över områden med tillväxt-inhibitory föreningar. Zoner med inhibition då kan visualiseras genom att observera kontrasten mellan myceltillväxt och tillväxtfria områden om svampar har tillämpats 3 eller genom sprayning med föreningarna som ändrar färg när de reduceras eller hydrolyseras av levande celler 4. Även om användningen av papper eller tunnskikts kromatogram för antimikrobiella analyser var först på antibiotika 5 och svampmedel 3,6, är växtextrakt nu ofta screenas för antimikrobiella föreningar med denna metod, som ofta kallas bioautografi. De protokoll som beskrivs här gäller för bioautografi av tunnskikts kromatogram. TLC används ofta eftersom det är relativt snabb och kan utföras på olika adsorptionsmedel (t.ex. kiseldioxid, stärkelse, aluminiumoxid), samt att ge god upplösning och känslighet 1.
Växtextrakt kan förberedas för TLC på många sätt. Vanliga metoder är utvinna växtmaterial i alcohol-vattenblandningar, såsom 80% etanol 7,8, eventuellt med tillsats av syra eller bas 9. Efter en extraktion i sådana lösningsmedel, som innehåller lite vatten och som är eventuellt sur eller basisk, måste extrakten koncentreras, så att de kan tillämpas på TLC-plattor i en minimal volym. Koncentrationen av alkohol-vattenextrakt kan åstadkommas genom uppdelning av med vatten oblandbara organiska lösningsmedel 8 eller med en blandning av sådana lösningsmedel, såsom etylacetat-etyleter (1:01, vol / vol) 10,11. Olika växtmetaboliter utvinns i olika organiska lösningsmedel, beroende på deras polaritet. För att säkerställa att anläggningen organiska syror eller baser utvinns i organiska lösningsmedel i detta skede, kan pH-värdet av en alkohol-vattenextrakt höjas eller sänkas med en vattenlöslig syra eller bas för att omvandla dissocierade analyter i sina nondissociated former, som sedan löslig i neutralt organiska lösningsmedel 9. Den organiska fasen kan sedan evaporated under reducerat tryck eller under kväve och justerades till den önskade volymen för TLC. PH-värdet i extraktet är osannolikt att vara dödliga för bioassay mikroorganismer på grund av uppdelningen av analyter i neutrala lösningsmedel, liten slutlig volym, och avdunstning av extraktet på TLC-plattan före separationen.
Både svampar och bakterier används som test mikroorganismer i bioautografi av växtextrakt 2. Sporer av vissa svampar, t.ex. Cladosporium cucumerinum, gro på TLC-plattor (med undantag av områden med inhibitoriska föreningar) om sprayas på plattorna i en näringslösning och inkuberades i en fuktig miljö under flera dagar 3. Den mörka mycel av C. cucumerinum på noninhibitory zoner ger en skarp kontrast till zoner fria från myceltillväxt. Även om bakterier har använts för tunnskiktskromatografi (TLC)-plattor på samma sätt 4,12, är bakterier också hälls över TLCplåtytor i agar överdrar 13,14. Jäst, såsom Candida albicans, kan appliceras i agar-övertäckningar samt 14. Alternativt kan TLC-plattor placeras med framsidan nedåt på agar ympas med bakterier 10,15 eller jäst 8, en metod som kallas kontakt bioautografi 2.
Vi beskriver en metod för kontakt bioautografi att screena för antimikrobiella fenolföreningar från rödklöver (Trifolium pratense cv. Kenland). Testet mikroorganism är Clostridium sticklandii, en ruminal hyper ammoniakproducerande bakterien (HAB) och obligat anaerob. Även om separationer som används inte löser alla komponenter i extraktet, de underlättar identifiering av zoner av antimikrobiell aktivitet, vilket minskar den poolen av möjliga antimikrobiella föreningar. Protokollet använder standardprocedurer för TLC 1. Protokollet beskriver också några av de tekniker som krävs för odling skylgate anaerober för en sådan analys, en användning av kontakt bioautografi 15 och en visualiseringsmetod med ett tetrazoliumsalt, som färgar levande celler 2,4.
Protocol
Representative Results
Discussion
Detta protokoll beskriver en enkel metod för att separera ett extrakt i undergrupper av föreningar och analysera dessa underuppsättningar genom kontakt bioautografi. Metoden är ganska likt som användes av Chomnawang et al. 15 för att screena för växtmetaboliter hämmande för gonorré bakterier. Den typ av bioautografi används till skärmen för antimikrobiella ämnen från växter beror på många faktorer, bland annat testmikroorganismen, laboratoriet setup, och preferenser för den person…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar den sena Dr Norm Taylor, Dept Plant and Soil Science vid University of Kentucky, för att tillåta oss att använda prover från hans rödklöver tomter för denna studie. Projektet har finansierats av Förenta staternas Department of Agriculture.
Materials
| Silica F254 TLC plates, aluminum-backed, 0.2 mm thickness, 20 × 20 cm | EMD Chemicals | 5554/7 | These plates are coated with silica that contains an indicator fluorescing at 254 nm. Compounds absorbing at that wavelength appear dark on a fluorescent green background. Alternative sources include Analtech, Selecto Scientific, Fluka. Adsorbents other than silica may be needed. Plastic-backed plates may be suitable, depending on the solvents to be used. |
| Sharp, heavy-duty scissors | any sewing supply company | similar to Fiskars 175800-1002 | For cutting TLC plates. A paper cutter with a sharp blade can be used as well. Do not inhale silica dust. |
| Drying oven at 100 °C (mechanical convection) | Thermo Scientific | PR305225M | Quincy Lab, Inc, Chicago, IL (www.quincylab.com); Cascade Technical Sciences, Hillsboro, OR (www.cascadetek.com) |
| TLC chamber | Kimble Chase | 416180-0000 | Alternative sources: Aldrich. Pyrex beakers or preserving jars can be used for small plates (i.e. 5 × 10 cm). Cover with aluminum foil (jar lids may contain material extractable by solvent vapors). |
| 50-µL syringe with flat needle tip | Hamilton | 80965 | For loading amounts of standard or sample exceeding 5-10 µL. Alternative sources are equivalent. |
| micropipets | Drummond | 2-000-001 | For loading small amounts of standards or samples. Alternative sources: VWR. Also, Pasteur pipets can be stretched to a thinner diameter with a butane torch. |
| Filter paper (#1 grade) | Whatman | 1001 917 | Serves as a chamber wick. Other grades of filter paper are OK. This size can be trimmed for the chambers holding 20 × 20 cm plates. |
| Beaker tongs | Fisher Scientific | 15-186 | For putting plates in and out of a large TLC chamber. Alternate sources: VWR |
| Flat-edge forceps | Fisher Scientific | 10-275 | For putting plates in and out of a small chamber. Alternate sources: VWR |
| Small portable UV lamp with 4-Watt or 6-Watt bulbs for short- and long-wave UV light illumination (254 and 365 nm, respectively) | Ultraviolet Products | 95-0271-01 | Alternate sources: Spectronics Corporation (www.spectroline.net) |
| Viewing cabinet for use with hand-held UV lamp | Ultraviolet Products | Chromato-Vue C-10E | UV-active bands are more easily circled if plates can be set in here. Alternate sources: Spectronics Corporation. |
| Photodocumentation system with overhead UV lamp and visible lamp | Kodak | Gel Logic 200 | Alternate sources: Ultraviolet Products (www.uvp.com). See protocol for homemade alternative. |
| Anaerobic Chamber, Type A, Vinyl | Coy | 7150000 | This chamber is appropriate for anaerobic bacteria, like Clostridium sticklandii, as described. However, growth conditions must be tailored to organism used in the assay. A biosafety cabinet and other precautions should be taken if pathogenic organisms are used. Alternate sources: Anaerobe Systems, BioRad, Plas Labs, others |
| Tetrazolium red | Sigma-Aldrich | T8877 | Alternate sources: MP Biomedicals, Santa Cruz Biotechnology, Alfa Aesar |
| Ingredients for HAB media | |||
| Pyridoxamine · 2 HCl | Sigma-Aldrich | P9380 | For this and for all the other reagents in this table, alternative sources are equivalent. |
| Riboflavin | Sigma-Aldrich | R4500 | |
| Thiamine HCl | Sigma-Aldrich | T3902 | |
| Nicotinamide | Sigma-Aldrich | N3376 | |
| Calcium D-Pantothenate | Sigma-Aldrich | C8731 | |
| Lipoic Acid | Sigma-Aldrich | T5625 | |
| p-Aminobenzoic acid | Sigma-Aldrich | A9878 | |
| Folic acid | Sigma-Aldrich | F8798 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Cobalamine | Sigma-Aldrich | C3607 | |
| Pyridoxal HCl | Sigma-Aldrich | P9130 | |
| Pyridoxine | Sigma-Aldrich | P5669 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Iron sulfate · 7 H2O | Sigma-Aldrich | F8263 | |
| Zinc sulfate · 7 H2O | Sigma-Aldrich | Z0251 | |
| Manganese chloride · 4 H2O | Sigma-Aldrich | M8054 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Cobalt chloride · 6 H2O | Sigma-Aldrich | C8661 | |
| Copper chloride · 2 H2O | Sigma-Aldrich | 459097 | |
| Nickel chloride · 6 H2O | Sigma-Aldrich | 203866 | |
| Sodium molybdate · 2 H2O | Sigma-Aldrich | 331058 | |
| Trypticase (Pancreatic digest of casein) | Thermo Fisher | B11921 | |
| Potassium phosphate monobasic anhydrous | Thermo Fisher | P284 | |
| sodium carbonate · H2O | Thermo Fisher | S636 | |
| Agar | Thermo Fisher | 50841063 | |
| Magnesium sulfate · 6 H2O | Thermo Fisher | 7791-18-6 | |
| Calcium chloride · 2 H2O | Thermo Fisher | BP510 | |
| Cysteine HCl | Thermo Fisher | 19464780 | |
| Potassium phosphate dibasic anhydrous | Thermo Fisher | P290 | |
| Sodium chloride | Thermo Fisher | BP358 |
References
- Stahl, E., Ashworth, M. R. F. . Thin-layer chromatography. , (1969).
- Marston, A. Thin-layer chromatography with biological detection in phytochemistry. J. Chromatogr. A. 1218 (19), 2676-2683 .
- Homans, A. L., Fuchs, A. Direct bioautography on thin-layer chromatograms as a method for detecting fungitoxic substances. J. Chromatogr. 51, 327-329 .
- Lund, B. M., Lyon, G. D. Detection of inhibitors of Erwinia carotovora and E. herbicola on thin-layer chromatograms. J. Chromatogr. 110, 193-196 (1975).
- Betina, V. Bioautography in paper and thin-layer chromatography and its scope in the antibiotic field. J. Chromatogr. A. 78, 41-51 (1973).
- Weltzien, H. C. Ein biologischer Test für fungizide Substanzen auf dem Papierchromatogramm. Naturwissenschaften. 45, 288-289 (1958).
- Khurram, M., Khan, A. M., Hameed, A., Abbas, N., Quayum, A., Inayat, H. Antibacterial activities of Dodonaea viscosa using contact bioautography technique. Molecules. 14 (3), 1332-1341 (2009).
- Khurram, M., et al. Evaluation of anticandidal potential of Quercus baloot Griff. using contact bioautography technique. Afr. J. Pharm. Pharmacol. 5 (12), 1538-1542 (2012).
- Robinson, T. . The Organic Constituents of Higher Plants. , (1963).
- Kagan, I. A., Flythe, M. D. Factors affecting the separation and bioactivity of red clover (Trifolium pratense) extracts assayed against Clostridium sticklandii, a ruminal hyper ammonia-producing bacterium. Nat. Prod. Commun. 7 (12), 1605-1608 (2012).
- Mattila, P., Kumpulainen, J. Determination of free and total phenolic acids in plant-derived foods by HPLC with diode-array detection. J. Agric. Food Chem. 50 (13), 3660-3667 (2002).
- Hamburger, M. O., Cordell, G. A. A direct bioautographic TLC assay for compounds possessing antibacterial activity. J. Nat. Prod. 50 (1), 19-22 (1987).
- Flythe, M., Kagan, I. Antimicrobial effect of red clover (Trifolium pratense) phenolic extract on the ruminal hyper ammonia-producing bacterium, Clostridium sticklandii. Curr. Microbiol. 61, 125-131 .
- Rahalison, L., Hamburger, M., Hostettmann, K., Monod, M., Frenk, E. A bioautographic agar overlay method for the detection of antifungal compounds from higher plants. Phytochem. Anal. 2 (5), 199-203 (1991).
- Chomnawang, M. T., Trinapakul, C., Gritsanapan, W. In vitro antigonococcal activity of Coscinium fenestratum stem extract. J. Ethnopharmacol. 122, 445-449 (2009).
- Stahl, E., Kaldewey, H. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-Seyler’s Z. Physiol. Chem. 323, 182-191 .
- Kagan, I. A., Hammerschmidt, R. Arabidopsis ecotype variability in camalexin production and reaction to infection by Alternaria brassicicola. J. Chem. Ecol. 28 (11), 2121-2140 (2002).
- Kline, R. M., Golab, T. A simple technique in developing thin-layer bioautographs. J. Chromatogr. 18, 409-411 (1965).
- Wedge, D. E., Nagle, D. G. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J. Nat. Prod. 63 (8), 1050-1054 (2000).
- Beck, A. B., Knox, J. R. The acylated isoflavone glycosides from subterranean clover and red clover. Aust. J. Chem. 24 (7), 1509-1518 (1971).
- Kahn, R. A., Bak, S., Svendsen, I., Halkier, B. A., Møller, B. L. Isolation and reconstitution of cytochrome P450ox and in vitro reconstitution of the entire biosynthetic pathway of the cyanogenic glucoside dhurrin from sorghum. Plant Physiol. 115 (4), (1997).
- Peterson, C. A., Edgington, L. V. Quantitative estimation of the fungicide benomyl using a bioautograph technique. J. Agr. Food Chem. 17 (4), 898-899 (1969).

