الساخنة البيولوجية الحفز: متساوي الكالوري المعايرة لوصف التفاعلات الإنزيمية
Summary
متساوي التدابير الكالوري المعايرة تدفق الحرارة المنطلقة أو الممتصة في التفاعلات الكيميائية. هذه الطريقة يمكن استخدامها لقياس انزيم الحفز. في هذه الورقة، وبروتوكول لإعداد مفيدة، يوصف عموما تجربة تشغيل، وتحليل البيانات، وتطبيقها على توصيف الأنزيمية اليوريا التحلل بواسطة جاك الفول اليورياز.
Abstract
متساوي الكالوري المعايرة (ITC) هو أسلوب وصفها جيدا أن يقيس الحرارة المنطلقة أو الممتصة خلال تفاعل كيميائي، وذلك باستخدام مسبار على أنها جوهرية لتوصيف الواقع كل عملية كيميائية. في الوقت الحاضر، يتم تطبيق هذه التقنية على نطاق واسع لتحديد المعلمات الحرارية من التوازنات ملزمة الجزيئية البيولوجية. بالإضافة إلى ذلك، فقد ثبت ITC لتكون قادرة على قياس حركية مباشرة والمعلمات الحرارية (ك القط، K M، ΔH) من التفاعلات الإنزيمية، حتى وإن كان هذا التطبيق لا يزال غير مستغلة. كما تحدث تغيرات الحرارة بشكل عفوي خلال الحفز الأنزيمي ومركز التجارة الدولية لا يتطلب أي تعديل أو وسم نظام قيد التحليل ويمكن أن يؤديها في الحل. وعلاوة على ذلك، فإن هذه الطريقة تحتاج كمية قليلة من المواد. هذه الخصائص تجعل ITC أداة لا تقدر بثمن، قوية وفريدة من نوعها لدراسة حركية الانزيم في العديد من التطبيقات، مثل، على سبيل المثال، واكتشاف المخدرات.
<p cمعشوقة = "jove_content"> في هذا العمل أسلوب التجريبي القائم ITC-لقياس حركية والديناميكا الحرارية من التفاعلات الإنزيمية يوصف بدقة. يتم تطبيق هذا الأسلوب لتحديد ك القط وK M من الإنزيمية من اليوريا التي كتبها الخنجري Canavalia (جاك الفول) اليورياز. يتم إجراء حساب المحتوى الحراري المولي الجوهرية (ΔH كثافة) من رد الفعل. القيم التي تم الحصول عليها وبالتالي تتفق مع البيانات السابقة التي أعلن عنها في الأدب، مما يدل على موثوقية المنهجية.Introduction
تقرير الكمي من التفاعلات الكيميائية الحيوية يوفر نظرة ثاقبة العمليات البيولوجية في أساس الحياة. الكالوري يقدم منهجية خالية من التسمية لوصف كميا كل تفاعل كيميائي تقريبا في الحل. يقيس هذا الأسلوب الحرارة المنطلقة أو الممتصة مع مرور الوقت، وبالتالي فهو نظام الكشف الشامل ومنهجية مريحة للغاية لقياس كمية من رد فعل جزيئات (أي الديناميكا الحرارية ملزمة)، وكذلك لقياس معدل التفاعل (أي حركية). على وجه الخصوص، اعتمد متساوي الكالوري المعايرة (ITC) وطريقة الاختيار لتوصيف الديناميكا الحرارية من التوازنات الجزيئية البيولوجية، التي تنطوي على البروتين يجند، البروتين البروتين، البروتين أيونات المعادن والتفاعلات الحمض النووي البروتين 1-6. بالإضافة إلى ذلك، قدرة المركز على توفير المعلومات الحركية يجعل من نظام قوي جدا لقياس انزيم الحفز، على الرغم من أن إمكانات هذا التطبيق لا يزالالتقليل 7-9.
المعادلة ميكايليس-مينتن 10 هو الوصف الكمي من التفاعلات الإنزيمية، كما أنها توفر علاقة بين معدل التفاعل وتركيز الركيزة، اعتمادا على معلمتين الحركية: ثابت ميخائيل (K M) وثابت معدل الحفاز (ك القط) . القط ك / يشار نسبة K M كما كفاءة الحفاز للانزيم. في الممارسة العملية، وتحديد K M وك القط لردة فعل معينة ويقدم وصفا كاملا للالحفز.
في رد فعل الأنزيمية نموذجي (الشكل 1)، وهي الركيزة (S) يتفاعل مع انزيم (E) تشكيل مجمع انزيم الركيزة (ES)، والتي يتم تفعيلها لاحقا في الحالة الانتقالية (ES *). يتم تحويل هذا الأخير إلى الإنزيم المنتج (EP) المعقدة التي تنأى في نهاية المطاف. هذه الخطوةموصوفة و من رد الفعل التالية.
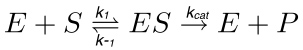 (1)
(1)
حيث ك 1 هو ثابت معدل لتشكيل مجمع ES، ك -1 هو ثابت معدل لتفكك المجمع ES، في حين ك القط هو ثابت معدل الحفاز أو عدد دوران.
وفقا للمعادلة ميكايليس-مينتن 10، ومعدل التفاعل يمكن أن تحسب على النحو التالي:
 (2)
(2)
التي K M = (ك + ك -1 القط) / ك 1 ك والقط = V ماكس / [E]، مع V ماكس كونها السرعة القصوى عندما وصلت كل انزيم منضما إلى الركيزة.
المعايرة المسعر متساوي هو الأداة المستخدمة في هذه الدراسة لوصف الإنزيمية من اليوريا. يرصد هذا الصك من درع ثابت الحرارة التي تحتوي على اثنين صاغ شكل خلايا (الشكل 1). وترتبط هذه إلى الخارج مع أنابيب الوصول الضيقة. يتم تحميل خلية العينة (حوالي 1.4 مل) مع الحل الانزيم، في حين يتم تعبئة الخلية المرجعية عموما مع الماء أو مع المذيبات المستخدمة في التحليل. A حقنة بالتناوب مع إبرة طويلة ومجداف ضجة المرفقة، التي تحتوي عادة كاليفورنيا. 0.3 مل من محلول الركيزة، هي التي شنت على الخلية العينة. يقيس جهاز الحرارية الفرق في درجة الحرارة بين العينة والخلية المرجعية و، وذلك باستخدام "شبكة ردود الفعل الخلية"، فإنه يحافظ على هذا الفارق في صفر عن طريق إضافة أو طرح الحرارة. أثناء التجربة، يتم حقن الركيزة في حل الانزيم عند درجة حرارة اختار ثابتة. عندما ENيأخذ رد فعل zymatic مكان، وكمية الحرارة المنطلقة أو الممتصة يتناسب مع عدد جزيئات الركيزة التي يتم تحويلها إلى جزيئات المنتج. بالإضافة إلى ذلك، فإن معدل تدفق الحرارة ويرتبط مباشرة إلى معدل التفاعل. البيانات المقاسة، والتي تظهر على أنها انحراف من أثر الحرارة من خط الأساس الأولي (الشكل 1)، وتمثل الطاقة الحرارية (μcal / ثانية) التي قدمتها الصك إلى الخلية عينة، والتي تتناسب مع تدفق الحرارة التي تحدث في الخلية عينة مع مرور الوقت.

الشكل 1. التمثيل التخطيطي من المسعر المعايرة متساوي لدراسة التفاعلات الإنزيمية. رد الفعل الأنزيمية التي تحدث عند المعايرة الركيزة (في حقن حقنة) في حل انزيم (في الخلية العينة) النتائج في تغيير ذرقوة القانون النموذجي للتحكيم صادر عن مسعر، اللازمة للحفاظ على الفرق في درجة الحرارة بين الخلية عينة وثابت مرجع الخلية. اضغط هنا لمشاهدة صورة أكبر.
وعموما، فإن تغير الحرارة (س) يتناسب مع المحتوى الحراري المولي للتفاعل (ΔH) وعدد الشامات من الناتج لدت (ن)، والتي بدورها تعطى من قبل مجموع مرات حجم تركيز:
 (3)
(3)
تشكيل المنتج مع مرور الوقت (DP / دينارا)، والتي تتطابق مع معدل التفاعل، وبالتالي يمكن أن تكون ذات صلة لكمية من الحرارة المتولدة مقارنة بنفس الفترة من (DQ / ت) من خلال العلاقة:
 (4)
(4)
وفقا لهذه المعادلة، من أجل الحصول على ميكايليس-منتن مؤامرة فمن الضروري لقياس ط) مجموع المحتوى الحراري ΔH الرحى، والثاني) الحرارة تدفق DQ / دينارا بتركيزات الركيزة مختلفة. عادة، هذه تتم في تجربتين مختلفتين: في التجربة الأولى (الطريقة 1، M1)، يتم حقن الركيزة في حل الانزيم ويتم قياس الحرارة لاستكمال تحويل الركيزة؛ في التجربة الثانية (الطريقة 2، M2)، يتم تنفيذ الحقن متعددة من الركيزة ويقاس معدل إنتاج الحرارة في تركيزات الركيزة مختلفة. هاتين المجموعتين من المعطيات كافية لاستخلاص المعلمات الحركية K M وك القط.
في هذه المادة، يتم وصف بروتوكول العامة لتحديد معالم الحركية للتفاعلات الأنزيمية تنفيذها باستخدام مركز التجارة الدولية. طبقنا طريقة لاليوريا التحلل بواسطة Canavalia الخنجري اليورياحد ذاتها، ونظام مرجعي. اتفاق جيد بين النتائج التي تم الحصول عليها باستخدام هذه الطريقة والبيانات المبلغ عنها في الأدب يدل على موثوقية هذا النهج.
Protocol
Representative Results
Discussion
أهمية المركز لدراسة النشاط الأنزيمي فيما يتعلق بأساليب القائمة
بالإضافة إلى التطبيقات الكلاسيكية لدراسة التوازنات ملزمة، متساوي الكالوري المعايرة يوفر طريقة موثوقة وسريعة لتوصيف التفاعلات الإنزيمية في حل باستخدام ح…
Disclosures
The authors have nothing to disclose.
Acknowledgements
واعترفت شركة الأسمدة منتجات متميزة (SFP) لتوفير الأموال اللازمة لهذه الدراسة.
Materials
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
References
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research–survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).

