DNA-Affinitäts-gereinigten Chip (DAP-Chip)-Methode, um Gene für bakterielle Ziele fest, Zwei-Komponenten-Systeme Regulatory
Summary
Dieses Video Artikel beschreibt ein in vitro-Mikroarray-basierte Methode, um die Gen-Targets und Bindungsstellen für Zweikomponentensystem Antwortregulatoren bestimmen.
Abstract
In-vivo-Methoden wie Chip-Chip sind etablierte Techniken zur globalen Zielgene für Transkriptionsfaktoren zu bestimmen. Von begrenztem Nutzen sind sie jedoch in der Erforschung bakteriellen Zwei-Komponenten-Regulationssysteme mit charakterisierter Aktivierungsbedingungen. Solche Systeme regulieren die Transkription nur, wenn in Gegenwart von eindeutigen Signalen aktiviert. Da diese Signale oft unbekannt sind, können in diesem Video-Artikel beschriebene in vitro-Mikroarray-basierten Verfahren verwendet werden, um Gen-Targets und Bindungsstellen für Antwortregulatoren zu bestimmen. Diese DNA-Affinitäts-gereinigten-Chip-Verfahren kann für jede gereinigte Regler in jedem Organismus mit einem sequenzierten Genom verwendet werden. Das Protokoll beinhaltet wodurch die gereinigte markierte Protein zu scher genomische DNA binden und Affinitätsreinigung des proteingebundenen DNA, gefolgt von der fluoreszierenden Markierung der DNA und Hybridisierung an eine individuelle Unterteilung Array. Vorhergehenden Schritte, die verwendet werden, um den Test zu optimieren Spezifikationen werden könnenc Regler werden ebenfalls beschrieben. Die von der Array-Daten-Analyse erzeugten Peaks werden verwendet, um Bindungsstelle Motive, die dann experimentell validiert werden vorherzusagen. Die Vorhersagen Motiv kann weiter verwendet werden, um Gen-Targets orthologer Antwortregulatoren in nahe verwandten Arten zu bestimmen. Wir zeigen die Anwendbarkeit dieser Methode durch Bestimmung der Gen-Targets und-Bindungsstelle Motive und damit die Vorhersage der Funktion für ein sigma54 abhängige Antwortregulator DVU3023 in der Umwelt Bakterium Desulfovibrio vulgaris Hildenborough.
Introduction
Die Fähigkeit der Bakterien zu überleben und zu gedeihen ist kritisch davon abhängig, wie gut sie in der Lage zu erkennen und zu reagieren, um Störungen in ihrer Umgebung sind, und diese wiederum ist abhängig von der Signalübertragungssysteme. Die Anzahl der Signalanlagen ein Bakterium kodiert wurde seine "mikrobielle IQ" bezeichnet und kann ein Hinweis sowohl Variabilität der seine Umwelt und seine Fähigkeit, mehrere Signale zu erfassen und eine Feinabstimmung seiner Antwort 1 sein. Zwei-Komponenten-Signalübertragungssystemen (ASR) sind die am weitesten verbreiteten Signalsysteme von Bakterien verwendet werden, und sie bestehen aus einem Histidin-Kinase (HK), der das externe Signal erfasst und überträgt über die Phosphorylierung an ein Effektor-Antwortregulator (RR) 2 bestehen. RR kann eine Vielzahl von Ausgangsdomänen und damit unterschiedliche Effektor-Modi, aber die häufigste Antwort Transkriptionsregulation über eine DNA-bindende Domäne 1. Die erfassten Signale und die entsprechenden Funktionen des Vast Mehrheit der FKS vor unbekannt.
Obwohl in vivo-Methoden wie Chip-Chip werden routinemäßig für die Bestimmung von genomischen Bindungsstellen von Transkriptionsfaktoren 3 verwendet wird, kann sie nur für bakterielle Zweikomponentensystem-Ressourceneinträge verwendet, wenn die Aktivierungsbedingungen oder Signale bekannt sind. Oft sind die Umweltreize, die einen TCS aktivieren sind härter als ihre Gen-Targets zu bestimmen. Die in vitro-Mikroarray-basierten hier beschriebene Assay kann verwendet werden, um die Gen-Targets wirksam und schnell zu bestimmen und vorherzusagen Funktionen FKS werden. Dieser Assay nutzt die Tatsache, dass RRS phosphoryliert und somit mit kleinen Molekülen wie Acetyl Geber Phosphat 4 in vitro aktiviert.
Bei diesem Verfahren, genannt DAP-DNA-Chip für affinitätsgereinigtem-Chip (1), das RR-Gen von Interesse mit einem His-Tag kloniert, in E. coli, und eine anschließend gereinigt markierte Protein wird bi erlaubtnd genomische DNA geschert. Die an Protein gebundene DNA wird dann durch Affinitätschromatographie-Aufreinigung angereichert werden die angereicherten und Input-DNA amplifiziert, fluoreszenzmarkierten, gepoolt und auf ein Array, das individuelle Fliesen auf den Organismus von Interesse (1) hergestellt wird, hybridisiert. Mikroarray-Experimenten unterliegen Artefakte und daher zusätzliche Schritte verwendet werden, um den Assay zu optimieren. Ein solcher Schritt ist, zu versuchen, ein Ziel zu bestimmen, unter der RR-Studie unter Verwendung von elektrophoretischen Mobilitätsverschiebungstests (EMSA) (siehe Arbeitsablauf in Fig. 2). Dann, nach der Bindung an genomische DNA und die DAP Schritte, die proteingebundene und die Input-DNA durch qPCR untersucht, ob die positive Ziel in der proteingebundenen Fraktion gegenüber dem Eingangsfraktion angereichert, wodurch bestätigt optimaler Bindungsbedingungen für die RR (Fig. 2). Anordnung nach Hybridisierung werden die Daten analysiert, um Peaks höherer Intensität anzeigendes Signal genomischen Loci zu finden, wo das Protein had gebunden. Funktionen für die RR auf der Grundlage der vorhergesagten Gen-Targets erhalten werden. Die Ziel-Loci verwendet werden, um Bindungsstelle Motive, die dann experimentell mit EMSA (Abbildung 2) bestätigt werden vorherzusagen. Die Funktionsvorhersagen und Gen-Targets für die RR kann dann verlängert werden, um eng verwandte Arten, die orthologen RRs kodieren durch das Scannen dieser Genome für ähnliche Bindungsmotive (Abbildung 2). Der DAP-Chip-Verfahren kann eine Fülle von Informationen für ein TCS wo vorher da war keiner zu liefern. Das Verfahren kann auch für jede Transkriptionsregulator verwendet werden, wenn das Protein gereinigt und DNA-Bindungsbedingungen bestimmt werden können, und für jeden Organismus von Interesse mit einer Genomsequenz vorhanden.
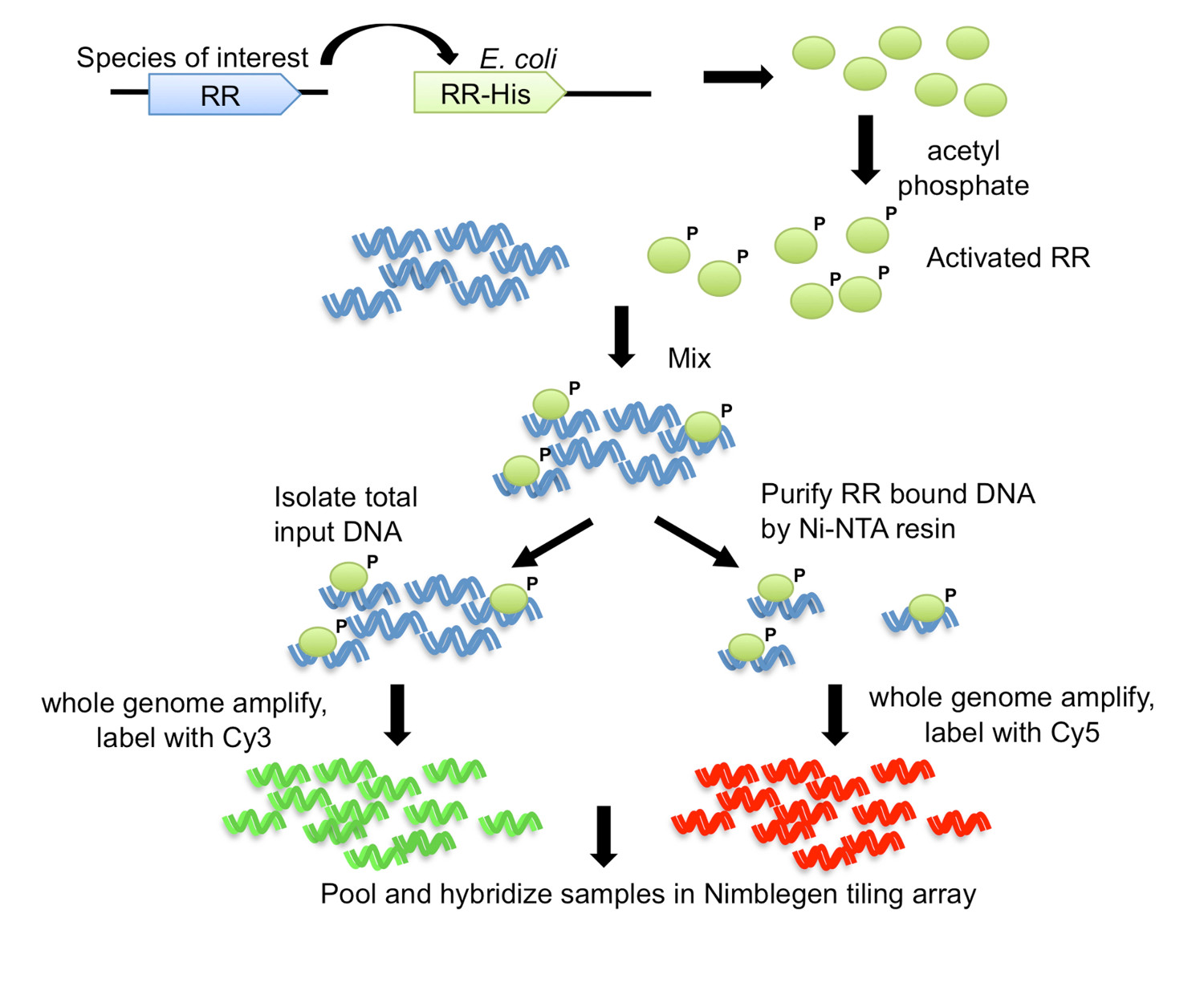
Abbildung 1. Die DNA-Affinitäts-gereinigten-Chip-(DAP-Chip)-Strategie 7. Die RR-Gens aus dem Organismus von Interesse ist mit einem Carboxy-terminalen His-Tag in einen E. kloniert coli Expressionsstamm. Gereinigte His-markierte Protein durch Phosphorylierung mit Acetylphosphat aktiviert und mit geschnittenen genomischen DNA gemischt. Ein Aliquot der Bindungsreaktion als Eingangs DNA gespeichert, während der Rest der Affinitätsreinigung unter Verwendung von Ni-NTA-Harz unterzogen. Der Eingang und der RR-gebundene DNA sind ganze Genom amplifiziert und mit Cy3 bzw. Cy5 markiert. Die markierte DNA wird zusammen gebündelt und zu einem Kachelanordnung, die dann analysiert wird, um die Gen-Targets zu bestimmen, hybridisiert. Abbildung modifiziert und neu aufgelegt mit der Creative-Commons-Lizenz von 7.
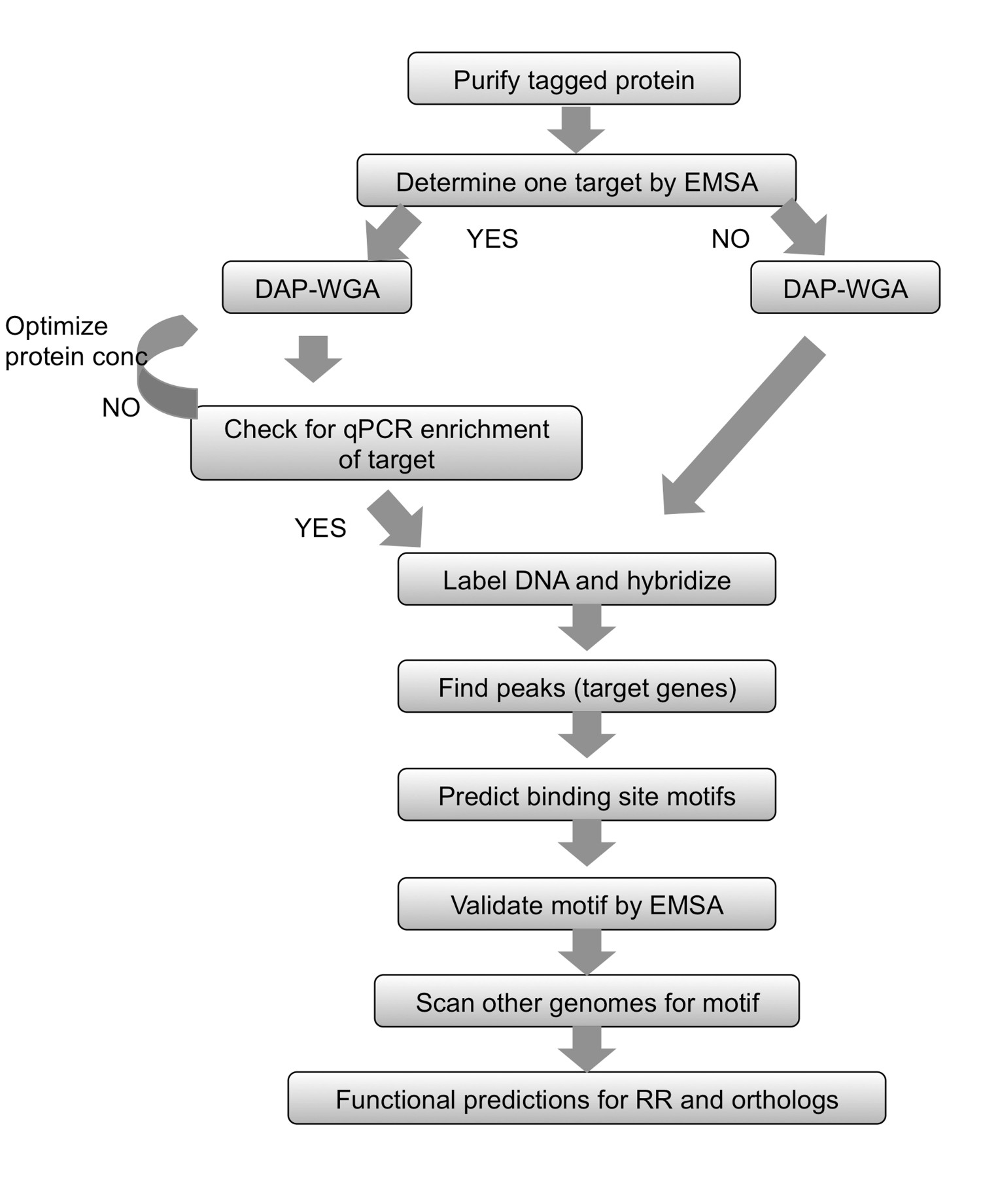
Abbildung 2. Zusammenfassung der Workflow. Für gereinigt getaggt protein, beginnen mit der Bestimmung eines Ziel mittels EMSA. Lassen Protein, um genomische DNA und DNA-Affinität-Entschlackung (DAP) und des gesamten Genoms binden verstärken (WGA) angereichert und die Input-DNA. Wenn ein Ziel-Gen bekannt ist, verwenden qPCR um sicherzustellen, daß der bekannte Target in der proteingebundenen Fraktion angereichert. Wenn kein Ziel ermittelt werden konnte, gehen Sie direkt zur DNA-Markierung und Array-Hybridisierung. Wenn Anreicherung durch qPCR konnte nicht beobachtet werden, wiederholen Sie den Protein-gDNA-Bindung und DAP-WGA Schritte mit unterschiedlichen Proteinmengen. Verwenden Array-Analyse Spitzen finden und sie den Zielgene. Verwenden Sie die vorgelagerten Bereiche des Zielgene zu Bindungsstelle Motive vorherzusagen. Bestätigen Sie die Motive experimentell unter Verwendung EMSAs. Verwenden Sie das Motiv, die Genome verwandter Arten Orthologe des RR-Studie unter Codierung zu scannen, und vorherzusagen, Gene in diesen Zielarten als gut. Basierend auf den Gen-Targets erhalten werden, kann die physiologische Funktion des RR und ihre Orthologe vorhergesagt werden. Abbildung modifiziert und neu aufgelegt mit der kreativen commons Lizenz von 7.
Protocol
Representative Results
Discussion
Die hier beschriebene DAP-Chip-Methode wurde erfolgreich eingesetzt, um die Gen-Targets für mehrere RRS in Desulfovibrio vulgaris Hildenborough 7, von denen eine hier als repräsentatives Ergebnis gezeigt zu bestimmen. Für RR DVU3023, die Wahl eines Kandidaten-Gen Ziel war einfach. DVU3025 ist unmittelbar stromabwärts von der RR-Gen und die RR-und Zielgene werden in mehreren Desulfovibrio-Arten konserviert sind, und zusätzlich eine vorhergesagte DVU3025 sigma54-abhängigen Promotor. Die …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Wir danken Amy Chen für ihre Hilfe bei der Vorbereitung der Videodreh und zur Demonstration der Technik. Diese Arbeit von ENIGMA durchgeführt: Ökosysteme und Netzwerke integriert mit Gene und molekulare Baugruppen (http://enigma.lbl.gov), ein Scientific Focus Area Programm am Lawrence Berkeley National Laboratory, wurde durch das Amt für Wissenschaft, Amt für Biologische und unterstützt Umweltforschung, des US Department of Energy unter Vertrag Nr. DE-AC02-05CH11231.
Materials
| Name of Material/Equipment | Company | Catalog number | Comments |
| HisTrapFF column (Ni-Sepharose column) | GE Lfe Sciences, Pittsburgh, PA, USA | 17-5255-01 | |
| Akta explorer (FPLC instrument) | GE Lfe Sciences, Pittsburgh, PA, USA | ||
| HiPrep 26/10 Desalting column | GE Lfe Sciences, Pittsburgh, PA, USA | 17-5087-01 | |
| Qiaquick Gel extraction kit | Qiagen Inc, Valencia, CA, USA | 28704 | |
| Biotin-labeled oligonucleotides | Integrated DNA Technologies | N/A | |
| 6% polyacrylamide-0.5X TBE precast mini DNA retardation gel | Life Technologies, Grand Island, NY, USA | EC63652BOX | Alternately, you can pour your own gel. |
| Nylon membrane | EMD Millipore, Billerica, MA, USA | INYC00010 | |
| Trans-Blot SD Semi-dry electrophoretic transfer cell | Biorad, Hercules, CA, USA | 170-3940 | |
| Extra thick blot paper, 8 x 13.5 cm | Biorad, Hercules, CA, USA | 170-3967 | |
| UV crosslinker Model XL-1000 | Fisher Scientific | 11-992-89 | |
| Nucleic Acid chemiluminescent detection kit (Pierce) | Thermo fisher Scientific, Rockford, IL, USA | 89880 | |
| Ni-NTA agarose resin | Qiagen Inc, Valencia, CA, USA | 30210 | |
| GenomePlex Whole genome amplification kit (Fragmentation buffer, library preparation buffer, library stabilization solution, library preparation enzyme, 10X amplification master mix, WGA polymerase ) | Sigma-Aldrich, St. Louis, MO, USA | WGA2-50RXN | |
| Nanodrop ND-1000 | Thermo Scientific, Wilmington, DE, USA | For quantitation of DNA | |
| Perfecta Sybr Green SuperMix, with ROX | Quanta biosciences | 95055-500 | Any Sybr Green PCR mix may be used |
| PlateMax Ultra clear heat sealing film for qPCR | Axygen | ||
| 96 well clear low profile PCR microplate | Life Technologies, Grand Island, NY, USA | PCR-96-LP-AB-C | |
| Applied Biosystems StepOne Plus Real time PCR system | Life Technologies, Grand Island, NY, USA | 4376600 | Any real time PCR system may be used |
| Qiaquick PCR purification kit | Qiagen Inc, Valencia, CA, USA | 28104 | Any PCR clean up kit may be used |
| Cy3/Cy5-labeled nonamers | Trilink biotechnologies, San Diego, CA, USA | N46-0001, N46-0002 | |
| Klenow polymerase 50,000U/ml, 3'-5' exo- | New England Biolabs, Ipswich, MA | M0212M | |
| Hybridization system | Roche-Nimblegen, Madison, WI, USA | N/A | This company no longer makes arrays or related items, so alternate sources such as Agilent or Affymetrix will need to be used, |
| Custom printed microarrays and mixers | Roche-Nimblegen, Madison, WI, USA | N/A | |
| Hybridization kit (2X Hybridization buffer, Hybridization component A, Alignment oligo) | Roche-Nimblegen, Madison, WI, USA | N/A | |
| Wash buffer kit (10X Wash buffer I, II, III, 1 M DTT) | Roche-Nimblegen, Madison, WI, USA | N/A | |
| GenePix 4200A microarray scanner | Molecular Devices, Sunnyvale CA, USA | This model has been replaced by superior ones | |
| GenePix Pro microarray software | Molecular Devices, Sunnyvale CA, USA | ||
| Nimblescan v.2.4, ChIP-chip analysis software | Roche-Nimblegen, Madison, WI, USA | N/A | |
References
- Galperin, M. Y. Diversity of structure and function of response regulator output domains. Curr Opin Microbiol. 13, 150-159 (2010).
- Casino, P., Rubio, V., Marina, A. The mechanism of signal transduction by two-component systems. Curr Opin Struct Biol. 20, 763-771 (2010).
- Aparicio, O., Geisberg, J. V., Struhl, K. Chromatin immunoprecipitation for determining the association of proteins with specific genomic sequences in vivo. Curr Protoc Cell Biol. 17 (17), (2004).
- McCleary, W. R., Stock, J. B. Acetyl phosphate and the activation of two-component response regulators. J Biol Chem. 269, 31567-31572 (1994).
- Novichkov, P. S., et al. RegPrecise web services interface: programmatic access to the transcriptional regulatory interactions in bacteria reconstructed by comparative genomics. Nucleic Acids Res. 40, 604-608 (2012).
- Studholme, D. J., Buck, M., Nixon, T. Identification of potential sigma(N)-dependent promoters in bacterial genomes. Microbiology. 146 (12), 3021-3023 (2000).
- Rajeev, L., et al. Systematic mapping of two component response regulators to gene targets in a model sulfate reducing bacterium. Genome Biol. 12, 99 (2011).
- Crooks, G. E., Hon, G., Chandonia, J. M., Brenner, S. E. WebLogo: a sequence logo generator. Genome Res. 14, 1188-1190 (2004).
- Barbieri, C. M., Mack, T. R., Robinson, V. L., Miller, M. T., Stock, A. M. Regulation of response regulator autophosphorylation through interdomain contacts. J Biol Chem. 285, 32325-32335 (2010).
- Bourret, R. B. Receiver domain structure and function in response regulator proteins. Curr Opin Microbiol. 13, 142-149 (2010).
- Gao, R., Stock, A. M. Molecular strategies for phosphorylation-mediated regulation of response regulator activity. Curr Opin Microbiol. 13, 160-167 (2010).
- Hung, D. C., et al. Oligomerization of the response regulator ComE from Streptococcus mutans is affected by phosphorylation. J Bacteriol. 194, 1127-1135 (2012).
- Ladds, J. C., et al. The response regulator Spo0A from Bacillus subtilis is efficiently phosphorylated in Escherichia coli. FEMS Microbiol Lett. 223, 153-157 (2003).
- Wen, Y., Feng, J., Scott, D. R., Marcus, E. A., Sachs, G. Involvement of the HP0165-HP0166 two-component system in expression of some acidic-pH-upregulated genes of Helicobacter pylori. J Bacteriol. 188, 1750-1761 (2006).
- Liu, X., Noll, D. M., Lieb, J. D., Clarke, N. D. DIP-chip: rapid and accurate determination of DNA-binding specificity. Genome Res. 15, 421-427 (2005).
- Gossett, A. J., Lieb, J. D. DNA Immunoprecipitation (DIP) for the Determination of DNA-Binding Specificity. CSH Protoc. 2008, (2008).
- Mascher, T., et al. The Streptococcus pneumoniae cia regulon: CiaR target sites and transcription profile analysis. J Bacteriol. 185, 60-70 (2003).
- Park, P. J. ChIP-seq: advantages and challenges of a maturing technology. Nat Rev Genet. 10, 669-680 (2009).
- Lefrancois, P., Zheng, W., Snyder, M. ChIP-Seq using high-throughput DNA sequencing for genome-wide identification of transcription factor binding sites. Methods Enzymol. 470, 77-104 (2010).
- Ho, J. W., et al. ChIP-chip versus ChIP-seq: lessons for experimental design and data analysis. BMC Genomics. 12, 134 (2011).
- Liu, X., Lee, C. K., Granek, J. A., Clarke, N. D., Lieb, J. D. Whole-genome comparison of Leu3 binding in vitro and in vivo reveals the importance of nucleosome occupancy in target site selection. Genome Res. 16, 1517-1528 (2006).

