Bir nanometre Hassasiyet Floresans Görüntüleme (Fiona)
Summary
Tek flüoroforlar FIONA'sı kullanarak nanometre hassasiyetle lokalize edilebilir. Burada FIONA tekniğin bir özet bilgi ve nasıl Fiona deneyleri tarif edilir.
Abstract
Bir nanometre doğruluk (Fiona) ile floresan görüntüleme xy düzleminde nanometre hassasiyetle tek florosforlar lokalize için basit ama kullanışlı bir tekniktir. Burada FIONA tekniğin bir özeti ve rapor edilir FIONA'sı kullanılarak yapılmıştır araştırma örnekleri kısaca tarif edilmektedir. İlk olarak, nasıl optik hizalama hakkında ayrıntılar yani Fiona deneylerde, toplam iç yansıma floresan mikroskobu (TIRFM) için gerekli ekipman kurmak, tarif edilir. O kadar bir kuantum nokta ile işaretlenmiş tek bir tepe bölümü kesik miyozin Va motorun 36 nm Adım boyutunu ölçmek için FIONA kullanılması, ardından uygun olan protokolü kullanılarak immobilize Cy3 DNA tek molekülleri lokalize basit Fiona deneyi yürütmek için görüntülenmiştir. Son olarak, kalın örnekleri FIONA uygulama genişletmek için son çaba bildirilmiştir. > (Bu bir suya daldırma objektif kullanılarak, olduğu gösterilmiştir ve kuantum noktaları, sol-jel ve tavşan gözü kornealar derin batırılmış200 um), 2,3 nm yeri hassas elde edilebilir.
Introduction
1882 civarında, Ernst Abbe bir görünür ışık mikroskobu çözünürlüğü olduğu bulundu ~ λ / 2NA, (λ dalga boyu ve NA sayısal açıklık olduğu) 1,2 ~ 200 nm veya. Bu nedenle, bu boyutundan daha küçük bir amacı, bir optik mikroskop bir kırınım sınırlı bir leke olarak görülecektir. Bununla birlikte, daha yüksek bir hassasiyet ile 3, bir nokta merkezini, nesnenin konumunu belirlemek mümkündür. Bir nanometre doğruluk (Fiona) ile floresan görüntüleme xy düzleminde 4 nanometre hassasiyetle tek florosforlar lokalize için basit ama kullanışlı bir tekniktir. Lokalizasyon hassasiyet, σ μ (yani, ortalamanın standart hatası) toplandı, fotonların sayısına bağlıdır 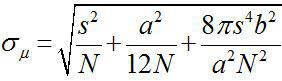 N foton sayısı olduğu, s floresan noktanın standart sapmasıdır, a,piksel görüntü detektörünün büyüklüğü, ve b, 3,4 arka standart sapmasıdır. ~ 10.000 fotonları yayan bir flüorofora için, Fiona ~ 1 nm hassasiyet 4 elde edebilirsiniz.
N foton sayısı olduğu, s floresan noktanın standart sapmasıdır, a,piksel görüntü detektörünün büyüklüğü, ve b, 3,4 arka standart sapmasıdır. ~ 10.000 fotonları yayan bir flüorofora için, Fiona ~ 1 nm hassasiyet 4 elde edebilirsiniz.
FIONA hassas bir şekilde sabit bir yayıcı konumunu, ya da (yeterince hızlı alınabilir görüntü varsayılarak) hareketli bir belirlemek için kullanılabilir. Fiona filmin kareleri sırayla uygulanan ve böylece tek bir molekülün 4 8 hareketini takip edilebilir. Foto-koruyucu reaktifler örnek ışıkla olmamasını sağlamak için gerekli olabilir. Ayrıca, flüoresan nesnenin kendisi herhangi bir boyutta olabilir, örneğin kısıtlayıcıları kırınım daha küçük ya da daha büyük, kendi zar üzerinde dağıtılmış çok sayıda floresan proteinleri ile bir organel (~ 1 mm) teşekkül edebilir. Fiona hala ortalama merkezden-of-kütlesinin çok doğru (nanometre) ortalama verim kullanma. FIONA tarafından yerelleştirme hassasiyetle büyük bir gelişme nanome çözme sağlarzaman içinde tert-ölçekli hareketleri. Bu moleküler uzunluk ölçüsü 4 8 içine mikroskopi itti.
Onun icadından bu yana, Fiona çeşidi geliştirilmiştir. Örneğin, parlak-alan bir-nanometre doğruluk (bFIONA) 9, FIONA hafif bir varyantı, görüntüleri ile görüntüleme ve iletilen ışık ile böyle Melanozomlar in vivo (pigment melanin içeren koyu nesneler) gibi yoğun nesneleri lokalize. Buna ek olarak, birden fazla boyayı Fiona gidermek için kullanılmıştır. Örneğin, ışıkla ağartma (karides) ile birlikte tek bir molekül yüksek çözünürlüklü bir 10,11 veya tek molekül yüksek çözünürlüklü ko (SHREC) 12 yaklaşık 10 nm olan, iki boya çözmek için geliştirilmiştir. (Bu kararın bu bir arayla aynı boyaları söyleyebilirim ne kadar doğru, yani dikkat edin.) Daha yakın zamanlarda, Fiona analizi bazı süper çözünürlük mikroskopi yerelleştirme sürecine katkıda böyle Stokastik optik reco gibinstruction mikroskobu (STORM) 13-15 ve geçici koyu flüoroforlar heyecan ve floresan lokalize edildiği fotoaktif localisation mikroskobu (PALM) 16,. Defalarca heyecanlı oldukça düşük boyaların yoğunluğu (az bir başına kırılma sınırlı nokta), ve daha sonra FIONA her bunların analiz, floresan toplayarak, tek bir yüksek çözünürlüklü haritayı kurabilirsiniz. Çözünürlüğü sonra sadece her bir boya dışarı koyar fotonların sayısı, yanı sıra satın alma sırasında (örneğin dahil, mikroskop sahne) numune sabit tutmak gibi şeyler sınırlıdır.
Bu makalede, bir Fiona tekniğin bir özeti ve kısaca Fiona bildirilmektedir kullanılarak yapılmıştır araştırma örneklerini tarif eder. İlk olarak, nasıl optik hizalama hakkında ayrıntılar yani Fiona deneylerde, toplam iç yansıma floresan mikroskobu (TIRFM) için gerekli ekipman kurmak, tarif edilir. Sonra nasıluygun protokolleri kullanarak hareketsiz Cy3-DNA tek moleküllerini lokalize basit Fiona deneyi yürütmek, gösterilmektedir. Bundan sonra, Fiona'yla kullanımı kuantum nokta ile işaretlenmiş tek bir tepe bölümü kesik miyozin Va motorun 36 nm aşaması boyutunu ölçmek için sunulmuştur. Miyozin Va aktin filamentler boyunca translocating Hücresel kargo taşıyan bir temel süreçsel motoru proteindir. Burada Va kesik oluşturmak miyozin adım boyutuyla ilgisiz etki ayrılması için kullanılan ve bir FLAG etiketi C-terminaline ilave Anti-Flag antikorları ile işlevselleştirilmiş kuantum noktaları ile etiketleme kolaylığı sağlamak için. Bu deney miyozini yavaşlatmak ve her karede iyi bir foton sayısı almak için yeterince uzun pozlama süreleri kullanımına izin düşük ATP altında yapılır. Herhangi yeterince parlak floresan etiket aşağıdaki protokolde ikame edilebilir. Son olarak, kalın örnekleri FIONA uygulamasını uzanan son çaba bildirdi. Proof-of-prensip olarak, kuantum noktalar batırılmışSol-jel ve tavşan gözü kornealar ve sonra yansıması ve FIONA'sı kullanılarak lokalize. Görüntüleme için, NA ile 60X su daldırma objektif bu hedefi daha önceden kullanılan 100X immersiyon yağı hedefi daha uzun çalışma mesafesi vardır, çünkü 1.2 kullanıldı =. Objektifine büyütmede kaybını telafi etmek için fazladan bir büyütme merceği (3.3X veya 4.0x) emisyon yoluna yerleştirilen edilmiştir. Buna ek olarak, epi-floresans (değil TIR) mikroskopisi kalın örneklerde derin bölgeleri ulaşmak için kullanılması gerekir. Bu sol-jel ve 2-3 nm hassasiyetle lokalize edilebilir tavşan gözü kornealar (Z> 200 mikron) derin batırılmış kuantum noktalar gösterilmiştir.
Protocol
Representative Results
Discussion
Fiona 1 msn 4 8 aşağı nanometre hassas ve zamansal çözünürlüğe sahip bir floresan yayıcı (organik flüorofor ya da kuantum nokta) konumunu lokalize bir tekniktir. Yeterli fotonlar toplandığı zaman, bu tekniğin çok daha doğru kırılma sınırı (~ 200 nm) daha floresan emitörün konumunu belirlemek için izin verir ve bu nedenle bu tekniği geleneksel / konvansiyonel optik mikroskopi 4 ile görülmemiştir ne gözlemlemek için bir yol açar – 8. Onun icadından bu yana…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma NIH Hibe 068.625, NSF Bağış 1063188 ve 0822613. Özel teşekkür tavşan gözlerinde hediye için İleri Bilim ve Teknoloji Beckman Enstitüsü'nün Dr Marina Marjanovic gitmek Yaşayan Hücrelerinin Fizik Merkezi tarafından desteklenmiştir.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
References
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

