Primer til Immunhistokemi på Cryosectioned Rat Brain Tissue: Eksempel farvning for Mikroglia og Neuroner
Summary
This introductory level protocol describes the reagents, equipment, and techniques required to complete immunohistochemical staining of rodent brains, using markers for microglia and neuronal elements as an example.
Abstract
Immunhistokemi er en meget anvendt teknik til påvisning af tilstedeværelsen, placering og relative forekomst af antigener in situ. Denne indledende niveau protokol beskriver de reagenser, udstyr og teknikker, der kræves for at gennemføre immunhistokemisk farvning af gnavere hjernevæv, hjælp markører for mikroglia og neuronale elementer som et eksempel. Konkret dette papir er en trin-for-trin-protokollen for fluorescerende visualisering af mikroglia og neuroner via immunhistokemi for Iba1 og Pan-neuronal hhv. Fluorescens dobbelt-mærkning er særlig nyttig til lokalisering af flere proteiner i den samme prøve, hvilket giver mulighed for nøjagtigt at observere interaktioner mellem celletyper, receptorer, ligander, og / eller den ekstracellulære matrix i forhold til hinanden såvel som protein co- lokalisering inden for en enkelt celle. I modsætning til andre visualiseringsteknikker, kan fluorescens immunohistokemi farvningsintensitet falde iugerne til måneder efter farvning, medmindre der tages passende forholdsregler. Trods denne begrænsning ved mange anvendelser fluorescens dobbelt-mærkning foretrækkes fremfor alternativer såsom 3,3'-diaminobenzidintetrahydrochlorid (DAB) eller alkalisk phosphatase (AP), som fluorescens er mere tid effektivt og giver mulighed for mere præcis differentiering mellem to eller flere markører. Diskussionen omfatter tips og råd til at fremme succes fejlfinding.
Introduction
Immunhistokemi er en proces til påvisning af antigener (dvs. proteiner) i vævssnit ved hjælp af primære antistoffer som binder specifikt til de antigener af interesse. Immunhistokemi blev udviklet af JR Marrack i 1934, da han besluttede at antistoffer kunne lokalisere antigener med stor specificitet 1. Begyndende i 1942, var nogle af de første in vitro undersøgelser med anvendelse af fluorescerende antistoffer til at visualisere immunhistokemi publiceret 2,3, hvorefter den første in vivo histokemisk undersøgelse blev offentliggjort 4. I løbet af 1960'erne, tre årtier efter starten af immunhistokemiske metoder, begyndte enzym-konjugerede antistoffer, der skal anvendes som sekundære reagenser. Disse metoder blev samtidigt og uafhængigt udviklet i Frankrig og USA 5,6. I dag er en bred vifte af antistoffer giver uendelige muligheder for immunhistokemiske undersøgelser 7.
"> Det overordnede mål med denne korrespondance er at give en kort indføring i immunhistokemisk farvning, det er ikke meningen at være en omfattende og udtømmende gennemgang af denne teknik i metoden, er immunhistokemiske teknikker til to antigener præsenteret (markører for microglia og. neuroner) til farvning af paraformaldehyd perfunderet, sucrose kryobeskyttet, cryosectioned rottehjerne. Immunohistokemisk farvning begynder med at blokere ikke-specifik antigenbinding at reducere baggrundsfarvning. Dernæst inkubering med primært antistof tillader binding til et specifikt antigen i vævet. Efter det primære antistof, et andet antistof, betegnet sekundære antistof, der anvendes til at forbinde det primære antistof til et konjugeret visualisering signal 8. Det sekundære antistof rettet mod immunoglobulin G (IgG) domæne specifikke arter, hvor det primære antistof blev rejst. Det sekundære antistof forstærker signalet af det primære antistof, eftersom Fab regioner than sekundært antistof binder til flere steder på IgG-domænet i det primære antistof. Enten enzymer eller fluorescerende molekyler konjugeret til F c regioner af det sekundære antistof aktivere visualisering. For eksempel et kanin-anti-Iba1 primære antistof er et kanin-IgG-molekyle specifikt for Iba1. Når æsel anti-kanin IgG anvendes som et sekundært antistof, vil det genkender og binder til multiple regioner af kanin-anti-Iba1 IgG (se figur 1). Æsel antistof kan visualiseres ved forskellige fremgangsmåder. Denne korrespondance fokuserer på påvisning af en fluorofor konjugeret til det sekundære antistof, der genkender det primære antistof, til visualisering af fluorescerende mikroskopi. I fluorescerende immunhistokemi, kan en nuklear plet såsom Hoechst eller DAPI benyttes til at visualisere alle kerner.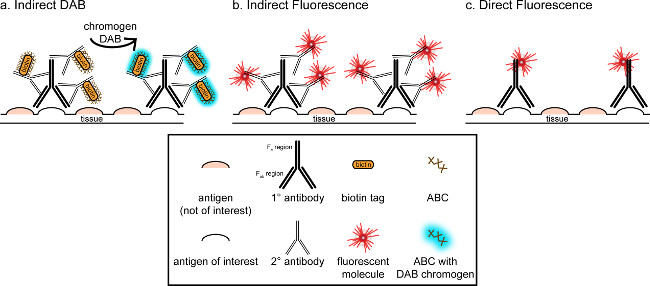
Figur 1: Schematic repræsentation af direkte vs. indirekte antistof-mærkningsteknikker. Antistoffer binder til antigenet af interesse og kan forstærkes ved sekundære antistoffer dannet mod arterne af de primære antistoffer. Denne teknik kan udføres under anvendelse af avidin-biotin-kompleks (ABC) til amplifikation og DAB til visualisering (A) eller et direkte konjugeret fluorescerende sekundært antistof (B). Alternativt kan primære antistoffer direkte konjugeret med mange forskellige mærker, herunder biotin eller en fluorofor (C). Klik her for at se en større version af dette tal.
En alternativ fremgangsmåde til visualisering af immunhistokemisk farvning anvender 3,3'-diaminobenzidintetrahydrochlorid (DAB, se figur 1 og 2). Dette adskiller sig fra fluorescens ved anvendelse af et biotinyleret ellerpeberrodsperoxidase (HRP) konjugeret sekundært antistof, som tilvejebringer et enzym til at konvertere DAB til et bundfald, der er synlig under lysfeltmikroskopi. I tilfælde, hvor et enkelt antigen er af interesse eller farvning er forpligtet til at være langtidsholdbare, kan DAB være mere passende end fluorescerende farvning. Imidlertid DAB-farvning er ikke velegnet til differentiering mellem flere markører, især hvis to nukleare antigener er af interesse. For information om DAB materialer og protokol modifikationer, konsultere tabel 1. Alternativt kan nitro blue tetrazolium chlorid / 5-brom-4-chlor-3-indolyl-phosphat (NBT / BCIP) anvendes til at visualisere et alkalisk phosphatase (AP) konjugeret sekundært antistof.
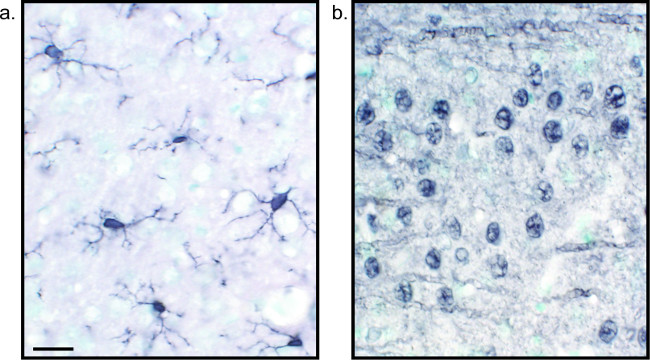
Figur 2:. Repræsentative billeder af nikkel-forstærket DAB single-mærket rotte hjerne vævssnit Rat hjerne SEKTIONER der er mærket med nikkel-forstærket DAB for Iba1 (A) og Pan-neuronal (B) giver mulighed for langvarig analyse af mikroglia eller neuroner alene. Scale bar 20 um. Klik her for at se en større version af dette tal.
Man må overveje den anslåede overflod af antigenet af interesse inde i vævet, der analyseres. Indirekte metoder (som beskrevet ovenfor) er nyttige for mål med lav tæthed. Når antigenet af interesse er i høj overflod, kan påføres direkte metoder. Direkte metoder involverer et primært antistof, der er direkte konjugeret til en visualisering signal, og dermed ingen sekundære antistof er påkrævet. Denne metode forenkler farvningen processen, men eliminerer amplifikation opnås ved indirekte metoder. Ved anvendelse af en direkte konjugeret primært antistof fjerner også krydsreaktivitet af sekundære antistoffernår dobbelt-mærkning.
Denne meddelelse beskriver protokollen for dobbelt-mærkning med Iba1 og Pan-neuronale (detaljer i tabel 1). Iba1 farver mikroglia i mange aktivering stater, herunder forgrenet, hyper-forgrenet, aktiveret, amoeboid og stang. Pan-neuronale pletter neuronal axoner, dendritter, og Soma. Siden Iba1 pletter fleste mikroglia og Pan-neuronale mål neuron, denne kombination af pletter er nyttig i at få en bred forståelse af mikroglia-neuron interaktioner.
Kort sagt immunhistokemisk farvning afhængig af omhyggelig udvælgelse af antistoffer. Som forskningsspørgsmålet bliver mere specifikke, kan antistoffer rejst til alternative antigener ønske. At målrette en specifik mikroglial aktivering tilstand, kan man vælge at anvende CD45 eller CD68-antistoffer, snarere end Iba1. Yderligere, at arbejde med mus, kan F4 / 80 levere de nødvendige resultater. Ligeledes kan neuronale elementer specifikt målrettet med antistoffer raserede mod kernen, synapse (præ- eller post-), axon, og væksten kegle. Derudover er der andre markører, som differentierer alder neuron (Double-cortin, NeuN) og neuronal regenerering (GAP-43).
Protocol
Representative Results
Discussion
Det overordnede mål med denne meddelelse var at indføre immunhistokemi procedurer til læseren. For dette, at eksemplet med dobbelt-mærkning med Iba1 og Pan-neuronale antigener observere mikroglia og neuroner i paraformaldehyd perfunderet, blev saccharose kryobeskyttet, cryosectioned rottehjerne brugt.
Denne teknik kan tilpasses til at tjene endeløse formål. En række forskellige antigener i en række forskellige vævstyper, såsom, men ikke begrænset til hjerne, lunge, lever, nyre og …
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors would like to thank Mr. Ryan Hart and Mr. Arriz Lucas for their invaluable feedback on this communication. This work was supported by NIH NINDS R01 NS065052 and Phoenix Children’s Hospital Mission Support Funds.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Fisherbrand Superfrost Plus Glass Slides | Fisher Scientific | 22-034-979 | Used for tissue mounting (1.2.2) |
| Oven | Thermo Scientific | 51028112 | Used for tissue drying (2.1.1) |
| Mini Pap pen | Life Technologies | 00-8877 | Used in step 2.2.2 |
| Andwin Scientific Tissue-tek Slide Staining Dish | Fisher Scientific | 22-149-429 | Used for all washes during staining (2.2), as well as the Hoechst step (2.2.8) |
| Kimwipes | Fisher Scientific | 06-666-A | Used for drying slides (2.2) |
| Black Staining Box | Ted Pella | 21050 | Used for blocking and staining steps (2.2) |
| Normal Donkey Serum | Fisher Scientific | 50-413-253 | Used for block and antibody incubation (2.2) |
| Mouse α-Pan-neuronal | Millipore | MAB2300 | Used for primary antibody (2.2.4) |
| Rabbit α-Iba1 | Wako Chemical | 019-19741 | Used for primary antibody (2.2.4) |
| Donkey α-Rabbit 594 | Jackson ImmunoResearch | 711-585-152 | Used for secondary antibody (2.2.6) |
| Donkey α-mouse 488 | Jackson ImmunoResearch | 715-545-150 | Used for secondary antibody (2.2.6) |
| Caterer's foil | Any | N/A | Used in steps 1.2.2 and 2.3.2 |
| Fluoromount-G | Southern Biotech | 0100-01 | Used for coverslipping (2.2.8) |
| Coverslips | Fisher Scientific | 12544E | Used for coverslipping (2.2.8) |
| Clear Nail Polish | Any | N/A | Used for coverslipping (2.2.8) |
| Axio Observer.Z1 and LSM 710 (laser scanning, confocal) | Carl Zeiss | N/A | Used for imaging (3) |
| Axioskop A2 | Carl Zeiss | N/A | Used for imaging (3) |
| CitriSolv | FisherScientific | For DAB protocol | |
| ABC | Vector Laboratories | PK-6100 | For DAB protocol |
| DAB Peroxidase kit | Vector Laboratories | SK-4100 | For DAB protocol |
| Biotinylated horse α-rabbit IgG | Vector Laboratories | BA-1100 | For DAB protocol |
| Biotinylated horse α-mouse IgG | Vector Laboratories | BA-2001 | For DAB protocol |
| 30% Hydrogen Peroxide | FisherScientific | H325-500 | For DAB protocol |
| Wheaton slide racks and staining dishes | TedPella | 21043 | For DAB protocol |
| Masterflex perfusion pump and tubing | Cole-Parmer | Used for perfusion (1.1.1 and 1.1.2) | |
| Andwin scientific tissue-tek CRYO-OCT compound (case of 12) | Fisher Scientific | 14-373-65 | Used for tissue freezing (1.2.1) |
| Thermometer (-50 to 50 C) | Fisher Scientific | 15-059-228 | Used for tissue freezing (1.2.1) |
| Cryostat | Leica | CM3500S | Used for tissue sectioning (1.2.2) |
| Staining Dish, Plastic with 2 Lids | Grale Scientific | 353 | For antigen retrival |
| 20 Place Staining Rack, Slides Horizontal | Grale Scientific | 354 | For antigen retrival |
| Microwave | Any | N/A | For antigen retrival |
References
- Marrack, J. R. Chemistry of antigens and antibodies. Nature. 134, 468-469 (1934).
- Coons, A. H., Creech, H. J., Jones, R. N., Berliner, E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 45, 159-170 (1942).
- Marshall, J. M. Localization of adrenocorticotropic hormone by histochemical and immunochemical methods. The Journal of experimental medicine. 94, 21-30 (1951).
- Mellors, R. C. Histochemical demonstration of the in vivo localization of antibodies: antigenic components of the kidney and the pathogenesis of glomerulonephritis. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 3, 284-289 (1955).
- Nakane, P. K., Pierce, G. B. Enzyme-labeled antibodies: preparation and application for the localization of antigens. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 14, 929-931 (1966).
- Avrameas, S., Uriel, J. Method of antigen and antibody labelling with enzymes and its immunodiffusion application. Comptes rendus hebdomadaires des seances de l’Academie des sciences. Serie D: Sciences naturelles. 262, 2543-2545 (1966).
- Cuello, A. C. . Immunohistochemistry. , (1983).
- Junqueira, L. C. U., Mescher, A. L. . Junqueira’s basic histology : text and atlas. , (2013).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of visualized experiments : JoVE. , (2012).
- Christensen, N. K., Winther, L., Kumar, G. L., Rudbeck, L. . Education Guide: Immunohistochemical (IHC) staining methods. , 103-108 (2009).
- Wang, G., Achim, C. L., Hamilton, R. L., Wiley, C. A., Soontornniyomkij, V. Tyramide signal amplification method in multiple-label immunofluorescence confocal microscopy). Methods. 18, 459-464 (1999).
- Feldengut, S., Del Tredici, K., Braak, H. Paraffin sections of 70-100 mum: a novel technique and its benefits for studying the nervous system. Journal of neuroscience methods. 215, 241-244 (2013).

