Gentransfektion mot sfäroid Celler på Micropatterned odlingsplattor för genetiskt modifierade celltransplantation
Summary
This protocol describes a cell transplantation system using genetically modified, injectable spheroids. Cell spheroids are cultured on micropatterned culture plates and recovered after gene introduction using polyplex nanomicelles. This system facilitates prolonged transgene expression from the transplanted cells in host animals while maintaining the innate function of the cells.
Abstract
För att förbättra den terapeutiska effekten av celltransplantation, var en transplantation system av genetiskt modifierade, injicerbara sfäroider utvecklas. Cell sfäroiderna framställes i ett odlingssystem på micropatterned plattor belagda med en termosensitiv polymer. Ett antal sfäroider bildas på plattorna, som motsvarar de cellvidhäftningsområdena 100 | im i diameter som regelbundet grupperade i en tvådimensionell sätt, omgiven av icke-vidhäftande områden som är belagda med en polyetylenglykol (PEG) matris. Sfäroiderna kan lätt utvinnas som en flytande suspension genom sänkning av temperaturen hos plattorna, och deras struktur är väl underhållen genom att passera dem genom injektionsnålar med en tillräckligt stor kaliber (över 27 G). Genetisk modifiering uppnås genom gentransfektion med den ursprungliga icke-viral gen bärare, Polyplex nanomicelle, som har förmåga att introducera gener i celler utan att störa sfäroid strukturen. För primary hepatocyt sfäroider transfekterade med en luciferas-uttryckande genen, luciferas hållbart erhållen i transplanterade djur, tillsammans med konserverade hepatocyt-funktion, såsom anges med albumin uttryck. Detta system kan tillämpas på en mängd olika celltyper inklusive mesenkymala stamceller.
Introduction
Celltransplantation terapi har rönt stor uppmärksamhet för behandling av olika svåra sjukdomar. Aktiviteten och halveringstiden av bioaktiva faktorer som utsöndras av de transplanterade cellerna är avgörande för förbättrad terapeutisk effektivitet av en celltransplantation system. Genetisk modifiering av cellerna före transplantation är en fördelaktig teknik för att reglera och manipulera cellulära funktioner, inklusive utsöndring av bioaktiva faktorer. Det är också viktigt att upprätthålla en gynnsam mikro för cellerna för att undvika celldöd eller förlust av cellaktivitet. Tredimensionell (3D) sfäroid cellkultur, i vilken cell-till-cell interaktioner välbevarade, är lovande för detta ändamål, till exempel för att förbättra albumin utsöndringen från primära hepatocyter och främja flera härstamning differentiering från mesenkymala stamceller (MSC ) 1-7.
I denna studie, en ny kombination system spheroid kultur och gentransfektion används för att fungera som en plattform för genetiskt modifierade celltransplantation. För att skapa sfäroida celler, en sfäroid odlingssystem på micropatterned odlingsplattor används. På dessa plattor, är cellvidhäftningsområdena 100 | im i diameter regelbundet ordnade i ett tvådimensionellt sätt och är omgivna av icke vidhäftande områden belagda med ett PEG-matris 3. Genom att ympa ett lämpligt antal celler, är uppsättningar av 3D-sfäroider av 100 | j, m i diameter som bildas som motsvarar den Micropatterned odlingsbädden.
Sfäroiderna återvinns utan att störa deras 3D-struktur genom användning av värmekänsliga cellkulturplattor, som var belagda med en termosensitiv polymer, poly (iso-propylakrylamid) (PIPAAm) 8-10. Den micropatterned arkitekturen är uppbyggd på värmekänsliga plattorna (specialbyggd). Genom att helt enkelt sänka temperaturen hos plattorna, är sfäroiderna lossnat från odlings bädden och dispergerad i fosfatbuffrad saltlösning (PBS). Således kan ett stort antal av sfäroider med en enhetlig storlek av 100 ^ m erhållas i form av en injicerbar suspension.
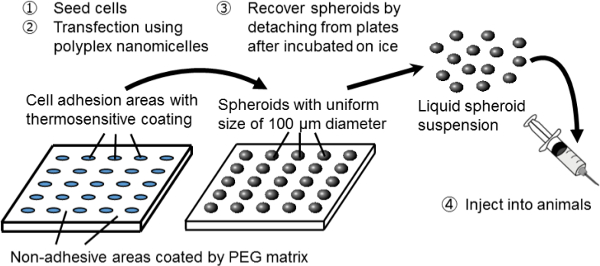
Figur 1. Schematisk representation av sfäroid odlingssystemet på en Micropatterned platta. Genetisk modifiering uppnås genom gentransfektion med den ursprungliga icke-viral gen bärare, Polyplex nanomicelle. Den består av plasmid-DNA (pDNA) och polyetylenglykol (PEG) -polycation segmentsampolymerer 11. Dessa har en karakteristisk kärna-skalstruktur bestående av en PEG skal och en inre kärna av kondenserad pDNA, möjliggör en säker och effektiv genintroduktion i celler för terapeutiska ändamål 11. Klicka här för att se en större version av this siffra.
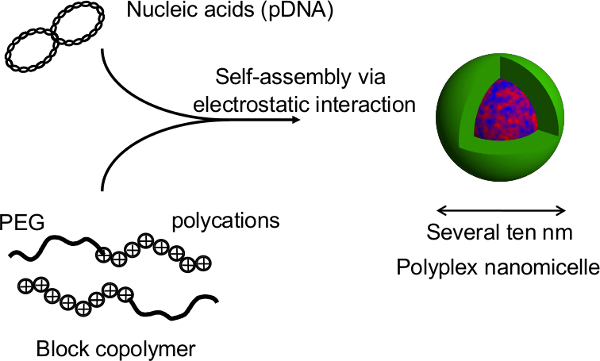
Figur 2. Uppbyggnad av Polyplex nanomicelle bildas av komplex av nukleinsyror och PEG-blocket-polykatjon segmentsampolymerer. I denna studie är den primära fördelen med denna teknik att den sfäroid strukturen inte störs under gentransfektion av nanomicelles. Efter nanomicelle-medierad transfektioner av rått primära hepatocyt sfäroider, förlängs transgenuttryck erhållas för mer än en månad med kontinuerlig albumin utsöndringen från hepatocyterna på en nivå som är jämförbar med den hos otransfekterade sfäroider 12. Den transgenexpression och albuminutsöndring från sfäroiderna också bibehållas efter återhämtning från värmekänsliga plattorna. Det är uppenbart att nanomicelles säkert kan underlätta genintroduktion utan att försämra de inneboende funktionerna hos hepatocytes. Således, en kombination av sfäroida celler odlade på värmekänsliga micropatterned plattor med genintroduktion använder nanomicelles är en lovande plattform för genetiskt modifierade cellstransplantation. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
I detta protokoll är det viktigt att behålla 3D-strukturen av sfäroider under stegen genintroduktion och sfäroid återhämtning. Det är viktigt att upprätthålla en gynnsam mikromiljöer för cellerna att undvika celldöd eller förlust av cellaktivitet. Till exempel, albumin utsöndring, ett representativt inneboende funktion av leverceller, är väl bevarad i levercell sfäroiderna, medan hepatocyter i den konventionella monokultur förlorar snabbt sin sekretoriska kapacitet några dagar efter sådd 12.</su…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi uppskattar djupt Dr. Takeshi Ikeya och teknisk personal i Toyo Gosei, Tokyo, Japan för att ge värmekänsliga micropatterned odlingsplattor samt vetenskapliga råd. Vi vill också tacka Ms Satomi Ogura, Ms Sae Suzuki, Ms Asuka Miyoshi och Ms. Katsue Morii för tekniskt bistånd med djurförsök. Detta arbete stöds ekonomiskt delvis av JSPS KAKENHI Grant-i-Stöd för vetenskaplig forskning, Centrum för innovation (COI) Program och S-innovationsprogram från Japan Science and Technology Agency (JST), och JSPS Core- till kärnor Program, A. Advanced Research Networks.
Materials
| Pen-Strep-Glut | GIBCO | ||
| Dexamethasone | Wako Pure Chemical Industries | 041-18861 | |
| Nicotinamide | Wako Pure Chemical Industries | 141-01202 | |
| Hank’s buffered salt and L-ascorbic acid 2-phosphate (Asc-2P) | Sigma-Aldrich | A8960 | |
| Human epidermal growth factor (hEGF) | Toyobo | PT10015 | |
| Cell-able multi-well plates | Toyo Gosei | PP-12 | |
| Thermosensitive cell culture plates (Upcell) | CellSeed Inc | The micropatterned architecture is constructed on the thermosensitive plates (custom-built by Toyo Gosei) | |
| Lipid-based transfection reagent (FuGENE HD) | Promega | E2311 | |
| Renilla Luciferase Assay System | Promega | E2810 | |
| pGL4 Luciferase Reporter Vector | Promega | E6651 | |
| pDNA expressing Gaussia luciferase | New England BioLabs | N8082S | |
| Mouse erhthropoietin-expressing vector | Origene | MC208445 | |
| pCAG-GS | Kindly provided by Laboratory for Pluripotent Cell Studies, Center for Developmental Biology, RIKEN | ||
| Escherichia coli DH5α competent cells | Takara | 9057 | |
| Endotoxin-free plasmid DNA purification system | Nippon Genetics | NucleoBond Xtra EF | |
| collagenase | Wako Pure Chemical Industries | 639-00951 | |
| trypsin inhibitor | GIBCO | R-007-100 | |
| Luminometer | Promega | GloMax™ 96 Microplate Luminometer | |
| IVIS Imaging System | Xenogen Corp. | Xenogen IVIS Spectrum in vivo imaging system | |
| blood sample analyzer | Sysmex | pocH-100i Automated Hematology Analyzer |
References
- Landry, J., Bernier, D., Ouellet, C., Goyette, R., Marceau, N. Spheroidal aggregate culture of rat liver cells: histotypic reorganization, biomatrix deposition, and maintenance of functional activities. J Cell Biol. 101 (3), 914-923 (1985).
- Yuasa, C., Tomita, Y., Shono, M., Ishimura, K., Ichihara, A. Importance of cell aggregation for expression of liver functions and regeneration demonstrated with primary cultured hepatocytes. J Cell Physiol. 156 (3), 522-530 (1993).
- Otsuka, H., et al. Two-dimensional multiarray formation of hepatocyte spheroids on a microfabricated PEG-brush surface. Chembiochem. 5 (6), 850-855 (2004).
- Wang, W., et al. 3D spheroid culture system on micropatterned substrates for improved differentiation efficiency of multipotent mesenchymal stem cells. Biomaterials. 30 (14), 2705-2715 (2009).
- Bartosh, T. J., et al. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties. Proc Natl Acad Sci U S A. 107 (31), 13724-13729 (2010).
- Frith, J. E., Thomson, B., Genever, P. G. Dynamic three-dimensional culture methods enhance mesenchymal stem cell properties and increase therapeutic potential. Tissue Eng Part C Methods. 16 (4), 735-749 (2010).
- Nakasone, Y., Yamamoto, M., Tateishi, T., Otsuka, H. Hepatocyte spheroids underlayered with nonparenchymal cells for biomedical applications. IEICE Transactions on Electronics. E94, 176-180 (2011).
- Nishida, K., et al. Corneal reconstruction with tissue-engineered cell sheets composed of autologous oral mucosal epithelium. N Engl J Med. 351 (12), 1187-1196 (2004).
- Ohashi, K., et al. Engineering functional two- and three-dimensional liver systems in vivo using hepatic tissue sheets. Nat Med. 13 (7), 880-885 (2007).
- Sekine, H., et al. Cardiac cell sheet transplantation improves damaged heart function via superior cell survival in comparison with dissociated cell injection. Tissue Eng Part A. 17 (23-24), 2973-2980 (2011).
- Itaka, K., Kataoka, K. Progress and prospects of polyplex nanomicelles for plasmid DNA delivery. Curr Gene Ther. 11 (6), 457-465 (2011).
- Endo, T., Itaka, K., Shioyama, M., Uchida, S., Kataoka, K. Gene transfection to spheroid culture system on micropatterned culture plate by polyplex nanomicelle: a novel platform of genetically-modified cell transplantation. Drug Deliv and Transl Res. 2 (5), 398-405 (2012).
- Howard, R. B., Christensen, A. K., Gibbs, F. A., Pesch, L. A. The enzymatic preparation of isolated intact parenchymal cells from rat liver. J Cell Biol. 35 (3), 675-684 (1967).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Tateno, C., Yoshizato, K. Long-term cultivation of adult rat hepatocytes that undergo multiple cell divisions and express normal parenchymal phenotypes. Am J Pathol. 148 (2), 383-392 (1996).
- Kanayama, N., et al. A PEG-based biocompatible block catiomer with high buffering capacity for the construction of polyplex micelles showing efficient gene transfer toward primary cells. ChemMedChem. 1 (4), 439-444 (2006).
- Itaka, K., Ishii, T., Hasegawa, Y., Kataoka, K. Biodegradable polyamino acid-based polycations as safe and effective gene carrier minimizing cumulative toxicity. Biomaterials. 31 (13), 3707-3714 (2010).
- Uchida, S., et al. PEGylated Polyplex With Optimized PEG Shielding Enhances Gene Introduction in Lungs by Minimizing Inflammatory Responses. Mol Ther. 20 (6), 1196-1203 (2012).
- Golde, W. T., Gollobin, P., Rodriguez, L. L. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet. Lab Anim (NY). 34, 39-43 (2005).
- Uchida, S., et al. An injectable spheroid system with genetic modification for cell transplantation therapy. Biomaterials. 35 (8), 2499-2506 (2014).

