静的器官培養を使用して口蓋の融合を研究の方法
Summary
口蓋開発の研究は、口蓋裂、驚異的な健康の負担を課し、外観を損なうを持続残すことができ先天異常の発生率が動機とされています。ここでは口蓋の開発および融合に関与する種々のシグナル伝達経路を研究するために使用することができる培養口蓋棚の技術を実証します。
Abstract
口唇口蓋裂は、すべての先天性欠損症の最も一般的なの一つです。正中上皮縫い目を形成するために付着上皮で覆われた間葉系の棚からの二次口蓋の形(MES)。理論は、MESの細胞が融合した口蓋1を作り、間葉移行(EMT)、アポトーシスおよび移行に対する上皮に従うことを示唆しています。 MESの完全な崩壊は、間葉系細胞とその周辺口蓋合流の最終不可欠相です。私たちは、口蓋の器官培養のための方法を提供します。 試験管プロトコルで開発された溶融中に生物学的および分子プロセスの研究を可能にします。この技術の用途は、外因性の化学薬剤に対する応答を評価するなど、規制および増殖因子と特定のタンパク質の効果数多くあります。口蓋器官培養は 、インビボ研究で使用したことはできない開発の様々な段階での操作を含む、多くの利点を有します。
Introduction
口腔顔面裂が最も優勢な頭蓋顔面の先天性欠損症です。また、考慮して可能なすべての頭蓋顔面の欠陥を取って、これらは、新生児2における第二の最も一般的な先天異常があります。裂口蓋は毎年約1米国ではすべての700の出産(米国)で発生し、口蓋裂の発生率は、裂け目月額味覚または3日目あたり裂と15人の子供を持って生まれた475人の子供に等しいです。毎年の展示世界中で生まれた子供の約1%頭蓋顔面異形学のいくつかのフォーム。
口蓋や唇の裂け目は、この異常を有する患者のための生涯の影響で非常に高価で複雑な手続きが必要です。経口裂と各患者の推定コストはおよそ$ 100,000個の4です。口唇口蓋裂を有する患者の治療は、頭蓋顔面外科医、耳鼻咽喉科医、遺伝学者、麻酔科医を含む医師のチームを必要とします音声言語病理学者、栄養士、歯科矯正医、補綴、心理学者、神経外科医、および眼科医。
palatogenesisでは、二次口蓋は最初垂直方向に成長し、舌の背の上口蓋棚の上昇を受けて対になった派生物として発生します。標高に続いて、対になった口蓋棚は(ヒトではマウスではE14.5 -E15で週9)正中線に向かって成長します。棚の先端をカバー内側縁上皮(MEE)は正中上皮縫い目を形成する接着します。
これは間葉合流を可能にするために間葉移行、および/またはアポトーシスの上皮が続きます。 MEEに反対の接着は、その変更口蓋裂の原因となる不可欠なイベントです。しかし、研究はわずか口蓋棚5の初期接着性を検討しました。骨芽細胞への間葉細胞の分化により硬口蓋フォーム。音部記号を生成することができます口蓋の発達異常tはまたは唇の関与なしに味覚。
口蓋器官培養技術は、過去30年間6,7に比べて多くのラボのために広く使用されていました。
このプロトコルでは、詳細に口蓋解剖し、静的な器官培養する方法を説明します。静止器官培養の利点は、口蓋棚の融合を可能にすることです。この技術は、多くの融合とシグナル伝達の実験8,9のために私たちの研究室で首尾よく使用されていました。しかし、技術の範囲は膨大であり、静的な器官培養系は、外因性の化学薬剤に対する応答の評価、異なる経路および特定のタンパク質における調節増殖因子の効果を含めて、必要なときにいつでも使用することができます。
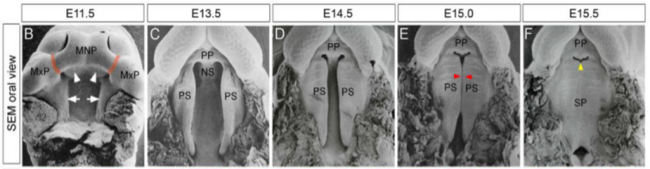
図1.マウスPalatogenesis。マウス口蓋の発達段階。(BF)走査 ELE代表的な発達時期に二次口蓋のCTRON顕微鏡写真(SEM)。赤矢印:口蓋接着および融合の最初の部分を示しています。黄色の矢印:ポイント(PLOS 1から許可を得てカウフマン11より転載)融合後に消えますプライマリとセカンダリの口蓋との間の空間に。
Protocol
Representative Results
Discussion
この記事のプロトコルは、胎生13.5で胚から口蓋棚を解剖する方法を提供します。マウス胚から口蓋棚を、37℃で95%O 2、5%CO 2雰囲気中で無血清培地中で培養しました。成功口蓋解剖を安楽死させたマウスの胚時から培養終了までの手順の間、各段階で複数の要因に決定的に依存しています。口蓋融合に影響を与える最も重要な要因の一つは、器官培養を開始するのに要する時間です?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors do not have any acknowledgements.
Materials
| BGJb | Invitrogen | ||
| Penicillin/Streptomycin | Lonza Inc. | 17-602E | 100X |
| Petri dishes | VWR | 25384-088 | 100x15mm |
| Center-well organ culture dish | Falcon | #353037 | 60×15 mm |
| Wire triangular grid | Custom made with stainless steel wire mesh to fit the organ culture dish well. | ||
| Polycarbonate filter | GE& Water and Process Technologies | K04BP04700 | Black 0.4 micron, 47 mm |
| Stereo microscope | ZEISS Stemi SR | ||
| Culture hood | NUAIRE Laminar Flow | ||
| Microdissecting forceps | Dumont Medical | #5 | |
| Microdissecting scissors | Kent Scientific Corporation | INS14003-G | Vannas Scissors, straight, 8cm long, 0.1mm tips, 5mm blades, German made |
| Microdissecting scissors | Kent Scientific Corporation | INS500086 | Vannas Scissors, straight, 8.5cm long, 0.025mm x 0.015mm tips, 7mm blades |
| Microdissecting scissors | Kent Scientific Corporation | INS14127-G | Spring scissors curved curved, 10.5cm long, 8mm blades, German made |
| Surgical currete (spoon spatula) | Hu-friedy | CM 2/4 | |
| Protector laboratory hood | Labconco | ||
| Incubator | Thermo Scientific | Farma | |
| Series11 water Jacket | |||
| Co2 incubator | |||
| PBS | GIBCO | 10010-023 | 1X |
| Fiber optic Light source | Fiber-light Dolan-Jenner | PL-750 | |
| Embedding cassette | Statlab | EC301 | |
| Kim Wipes | VWR | 470173-504 | |
References
- Nawshad, A. Palatal seam disintegration to die or not to die that is no longer the question. Developmental dynamics an official publication of the American Association of Anatomists. 237, 2643-2656 (2008).
- Strong, E. B., Buckmiller, L. M. Management of the cleft palate. Facial plastic surgery clinics of North America. 9, 15-25 (2001).
- Witt, P. D., Marsh, J. L. Advances in assessing outcome of surgical repair of cleft lip and cleft palate. Plastic and reconstructive surgery. 100, 1907-1917 (1997).
- 4miloro, . principles of oral and maxillofafcial surgery. 209, 231-249 (1984).
- Mima, J. Regulation of the epithelial adhesion molecule CEACAM1 is important for palate formation. PloS one. 8, e61653 (2013).
- Carette, M. J., Ferguson, M. W. The fate of medial edge epithelial cells during palatal fusion in vitro an analysis by DiI labelling and confocal microscopy. Development (Cambridge, England). 114, 379-388 (1992).
- Ferguson, M. W., Honig, L. S., Slavkin, H. C. Differentiation of cultured palatal shelves from alligator chick and mouse embryos. The Anatomical record. 209, 231-249 (1984).
- San Miguel, S. Ephrin reverse signaling controls palate fusion via a PI3 kinase dependent mechanism. Developmental dynamics an official publication of the American Association of Anatomists. 240, 357-364 (2011).
- Kang, P., Svoboda, K. K. PI 3 kinase activity is required for epithelial mesenchymal transformation during palate fusion. Developmental dynamics an official publication of the American Association of Anatomists. 225, 316-322 (2002).
- RD, L. . Histopathologic Technic and Practical Histochemistry. , (1965).
- Kaufman, M. H. . The Atlas of Mouse Development. , (1992).
- Taher, L. Global gene expression analysis of murine limb development. PloS one. 6, e28358 (2011).

