고체 지질 나노 입자 (SLNs) 세포 내 타겟팅을위한 응용 프로그램
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
나노 입자 기반 전달 비히클은 특히 셀룰러 시그널링 및 유전자 발현을 변경하는기구를 제공하고, 세포 내 표적 애플리케이션을위한 큰 약속을 보여 주었다. 이들 차량은 약물, 단백질 및 세포 반응에 영향과 표적 조직에서 원하는 효과를 달성하도록 설계된 핵산으로 로딩 될 수있다. nanocarriers 여러 유형의 지질, 폴리머, 실리콘, 및 자성 물질을 포함하여 치료 및 진단을 위해 유익 탐구되어왔다. 이러한 시스템으로 인해 치료 목표 조직에서 농도 및 독성의 감소를 증가 지역화 된 약물 전달에 대한 자신의 잠재력에 매력적이다.
고형분 지질 나노 입자 (SLNs)는 최근 유망한 약물 전달 비히클로 떠오르고있다 나노 입자 전달 시스템의 잘 연구 된 예이다. SLNs 용이 바이오 센싱 (1), (2) 화장품 및 t를 포함하여 다수의 애플리케이션 용으로 제형 화 될 수있다herapeutic 배달 3-7. 효용성은 향상된 생체 적합성 결과, 재 흡수성, 독성 지질 전적으로 구성되어 있다는 사실로부터 유래한다. 합성 과정에서, 친 유성 약물함으로써 비경 구 투여 용 약물 용해도 및 적합성을 증가 SLN 차량에 통합 될 수있다. SLN 차량은 또한 그 분해 및 클리어런스를 감소 및 치료 작용을 극대화 캡슐화 치료학을 안정하는 것을 돕는다. 이러한 차량으로 인해 체온 3,4,8,9에서 안정성에 특히 긴 연기, 제어 방출 제제에 적합하다. 중요한 지질 나노 입자의 약물의 캡슐화는 약물 분자의 극한 약동학 프로파일을 변경. 이것은 좁은 치료 지수를 가진 약물의 제어 방출을 허용함으로써 잠재적 이점을 제공한다. SLN-혼입 치료제의 방출 속도는 조정 지질 분해 속도 또는 약물의 확산 속도에 기초 할 수있다지질 매트릭스.
SLNs는 종종 특정 표적 조직에 축적하도록 설계되었습니다. 예를 들어, 크기 (전형적으로는 10 nm 이상)는 종양 조직의 새는 혈관은 증착을 용이하게 순환의 유지를 증강시켜. 또한, 입자 투여 경로는 예컨대 림프절 10,11 특정 생리 학적 구조를 대상으로 잠재적으로 생체 분포를 변경하는 것으로 나타났다. 표적 조직에 침착, 적당한 세포 상호 작용을 달성하고 궁극적으로 나노 입자의 내재화에 의한 선택적으로 셀 (12)의 밖으로 이온 및 분자의 흐름을 제어하는 세포막의 능력에 도전. 세포 흡수를 용이하게하기 위해, 펩타이드, 작은 분자 및 모노클로 날 항체 (13, 14)을 포함하여 특정 리간드 nanocarriers을 수정하는 것이 가능하다. 수동 침투 및 나노 입자의 능동 수송을 모두 포함하는 여러 메커니즘세포막 이전 3,12,15을 설명 하였다. 일반적으로, 이것은 세포 – 나노 입자의 상호 작용은 이러한 세포 형태 또는 세포주기 단계 (12)와 같은 셀 – 특정 매개 변수 외에, 크기, 형상, 표면 전하 및 표면 화학을 포함하는 나노 입자의 물리 화학적 특성에 의해 영향을받는 것으로 입증되었다.
이전의 조사는 상전이 온도 (PIT)을 사용하는 방법 (17) (16) 및 국소 바이오 마커 검출 애플리케이션 1 서브 10 나노 SLNs의 합성을 증명했다. 이것은 온도가 서서히 변화시키면서 조성물은 일정하게 유지 2 부드러운 합성법이다. 가열 된 용액의 연속 교반,로는 나노 에멀젼의 RT 결과를 냉각시킨다. 보다 작은 입자 크기를 가진 1 SLNs의 합성 과정이 결과는 이전의 NaN 지질 합성을위한 다양한 방법을 이용하여보고oparticles 17 ~ 22. 얻어진 크기 규모는, 20nm 이하는, 증가 된 표면적과 상호 작용을위한 향상된 셀룰러 전위 세포 표적화 애플리케이션을위한 이점을 제공한다.
형광 염료 또는 치료를 제공하도록 설계 SLNs의 개략은,도 1에 도시된다. SLNs는 지질 내부 (예를 들면, 선형 알칸) 친 유성 화합물 (예를 들면, 염료 또는 치료제)의 결합을 허용하고, 계면 활성제의 외관의 구성 물에 둘러싸여 (예를 들어, 선형 비이 온성 계면 활성제). 본 연구에서는 SLNs는 형광 염료로드 된 입자 세포 상호 작용을 조사하기 위해 모델로 사용. 차 인간 피부 섬유 아세포 및 마우스 수지상 세포 독성 및 흡수 입자에 대하여 상호 작용을 특성화하기 위해 시간에 걸쳐 SLN 로딩 염료를 노출시켰다. 3- (4,5- 디메틸 티아 졸 -2- 일) -2,5- diphenylphenyltetrazolium 브로마이드 (MTT) 분석은 utili이었다적당한 투여 수준을 설정하기 위해 평탄화. 형광 현미경 및 유동 세포 계측법은 시험관 내에서 입자의 흡수를 검사하기 위해 사용하는 두 가지 방법이었다.
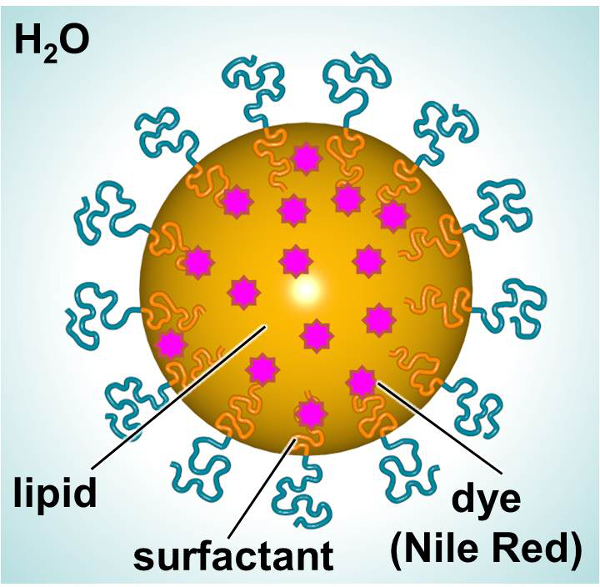
주요 성분을 표시 SLN의 그림 1. 도식. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Protocol
Representative Results
Discussion
본 연구에서는 SLNs의 합성과 세포 내 표적 응용 프로그램에 대한 적용 가능성은 탐구했다. 이러한 생체 적합성 나노 입자는 약물 전달, 유전자 침묵, 그리고 백신 기술을 25 ~ 30 등의 여러 응용 프로그램에 대한 배송 차량 등의 약속을 보여 주었다. 초소형 SLNs가 용이 한 공정으로 합성하고, 주요 피부 세포 및 주요 면역 세포와의 상호 작용을 탐색 하였다. SLNs는 모델 치료화물을 역임 형광 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

