استخدام رامزي الفحص لقياس إفراز السوائل وايون الجريان الاسعار في<em> ذبابة الفاكهة السوداء البطن</em> الأنبوب الصغير مالبيغي
Summary
يصف هذا البروتوكول استخدام فحص رامزي لقياس معدلات إفراز السوائل من معزولة مالبيغي (الكلى) الأنابيب من ذبابة الفاكهة السوداء البطن. وبالإضافة إلى ذلك، فإن استخدام أقطاب أيون محددة لقياس تركيزات الصوديوم والبوتاسيوم في السائل يفرز، مما يتيح حساب تدفق بطريق الظهارة أيون، يوصف.
Abstract
تعديل الكلوي النقل أيون الظهارية يسمح الكائنات الحية للحفاظ على التوازن الأيوني والاسموزي في مواجهة الظروف الخارجية متفاوتة. يقدم ذبابة الفاكهة السوداء البطن مالبيغي (الكلى) أنبوب صغير فرصة لا مثيل لها لدراسة الآليات الجزيئية لنقل أيون الظهارية، وذلك بسبب الوراثة قوية من هذا الحي وسهولة الحصول على الأنابيب في الكلى لدراسة فسيولوجية. هنا، نحن تصف استخدام فحص رامزي لقياس معدلات إفراز السوائل من ذبابة معزولة الأنابيب الكلوية، مع استخدام أقطاب أيون محددة لقياس تركيزات الصوديوم والبوتاسيوم في السائل المفرز. يسمح هذا الاختبار دراسة السوائل بطريق الظهارة والأيونات تدفقات ~ 20 الأنابيب في كل مرة، دون الحاجة لنقل السوائل تفرز لجهاز منفصل لقياس تركيزات أيون. وراثيا الأنابيب متميزة يمكن تحليلها لتقييم دور جينات معينة في عمليات النقل. بالإضافة إلى ذلك، بيمكن تعديل athing المالحة لدراسة آثار خصائصه الكيميائية، أو المخدرات أو الهرمونات المضافة. باختصار، هذه التقنية تسمح للالتوصيف الجزيئي من الآليات الأساسية للنقل الظهارية أيون في أنبوب صغير ذبابة الفاكهة، فضلا عن تنظيم آليات النقل هذه.
Introduction
الكلوي النقل أيون الظهارية راء iono- العضوي، التنظيم الاسموزي. يقدم ذبابة الفاكهة السوداء البطن مالبيغي (الكلى) أنبوب صغير فرصة لا مثيل لها لدراسة الآليات الجزيئية لنقل أيون الظهارية. ويرجع ذلك إلى مزيج من الوراثة قوية من ذبابة الفاكهة، وإرفاقها مع إمكانية الوصول إلى الأنابيب الكلوية لها لدراسة فسيولوجية هذا. فحص رامزي، الذي سمي على اسم المحقق الذي كان رائدا في تقنية 1، يقيس معدلات إفراز السوائل من الأنابيب مالبيغي معزولة، وتأسست في ذبابة الفاكهة في عام 1994 من قبل شركة داو وزملاؤه 2. هذا مهد الطريق لمزيد من الدراسات باستخدام ذبابة الفاكهة الأدوات الوراثية، مثل نظام GAL4-UAS 3،4، لتحديد مسارات الإشارات خلية محددة تنظم إفراز السوائل. ويشمل على سبيل المثال يشير الكالسيوم في استجابة لهرمون الببتيد 5، وغيرها الكثير 6،7.
وقد أظهرت ve_content "> مزيج من التقنيات الوراثية ودراسة فسيولوجية الكلاسيكية التي الجيل البول في حدوث الطاير من خلال إفراز البوتاسيوم كلوريد الغنية السوائل من الجزء الرئيسي من أنبوب صغير. وهذا يحدث من خلال إفراز بطريق الظهارة مواز من الكاتيونات، في المقام الأول K + ولكن أيضا نا +، من خلال الخلية الأساسية، والكلورين – إفراز من خلال الخلايا النجمية 8-12 القدرة على قياس حدة بطريق الظهارة K + والصوديوم + تدفقات يسمح توصيف أكثر تفصيلا لآليات النقل من قياس إفراز السوائل وحده. على سبيل المثال، في الأنابيب ذبابة الفاكهة unstimulated، نا + / K + إطعام الفئران المانع ابائين ليس له تأثير على إفراز السوائل 2، حتى عندما يتم تثبيط امتصاص حيز الخلايا الرئيسية التي العضوية نقل أنيون المانع توروكولات 13. ومع ذلك، لينتون و أظهر أودونيل أن ابائين depolarizesإمكانات غشاء basolateral، ويزيد نا + تدفق 9. كما هو مبين في ممثل النتائج، ونحن تكرار هذه النتائج، وأظهرت أن K + تدفق هو انخفضت بصورة متزامنة 14؛ زيادة نا + التمويه وانخفض K + تدفق لها آثار معارضة على إفراز السوائل، مما أدى إلى عدم التغير الصافي في إفراز. وبالتالي، هناك قرارين ل"مفارقة ابائين"، أي مراقبة الأولية التي ابائين له أي تأثير على إفراز السائل في أنبوب صغير ذبابة الفاكهة: أولا، في الأنابيب حفز، وتأثير ابائين على إفراز السوائل غير واضح نظرا ل امتصاص من قبل الناقل أنيون العضوية 13؛ وثانيا، في الأنابيب unstimulated، ابائين ومعارضة الآثار على بطريق الظهارة نا + K + والتمويه، مما أدى إلى عدم التغير الصافي في إفراز السائل (انظر ممثل النتائج والمرجع 9). ولذلك، فإن الدور الرئيسي للنا + / K + -ATPبورصة عمان في الأنابيب unstimulated هو خفض داخل الخلايا نا + تركيز لتوليد التدرج تركيز مواتية لنا + -coupled عمليات النقل عبر الغشاء basolateral. في الواقع، عن طريق قياس حدة نا + وK + التدفقات، أثبتنا أن الأنابيب التي تفتقر إلى cotransporter ذبابة الصوديوم والبوتاسيوم-2-كلوريد (NKCC) قد انخفضت K بطريق الظهارة + التمويه، مع عدم وجود مزيد من الانخفاض بعد ابائين بالإضافة إلى ذلك، وأي تغيير في بطريق الظهارة غ + تدفق 14. وأيدت هذه النتائج استنتاجنا أن نا + دخول الخلية من خلال NKCC يتم إعادة تدويرها من خلال نا + / K + إطعام الفئران. وفي مثال آخر، Ianowski وآخرون. لاحظ أن خفض حمام K + تركيز من 10 ملم إلى 6 ملم انخفض بطريق الظهارة K + تدفق وزيادة بطريق الظهارة نا + تدفق في الأنابيب من الرادنة prolixus، مع عدم وجود صافي التغير في إفراز السوائل <sup> 15. كما لوحظت آثار تفاضلية على نا + التمويه وK + تدفق عبر الأنابيب اليرقات في الأنابيب ذبابة الفاكهة ردا على متفاوتة حمية الملح 16 و في نوعين من أنواع البعوض ردا على تربية ملوحة 17.التحدي الأكبر في قياس تدفق بطريق الظهارة أيون في إعداد مقايسة رامزي هو تحديد تركيزات الأيونات داخل السائل المفرز. وقد اجتمع هذا التحدي مع حلول مختلفة، بما في ذلك اللهب photometery 18، واستخدام أيونات المشعة 19، والإلكترون التحقيق الطول الموجي التحليل الطيفي والتشتت 20. هذه التقنيات تتطلب نقل قطرة السائل يفرز إلى أداة لقياس تركيزات أيون. منذ حجم السوائل التي يفرزها ذبابة الفاكهة أنبوب صغير unstimulated صغيرة، وعادة ~ 0.5 NL / دقيقة، وهذا يشكل تحديا تقنيا وأيضا يقدم الخطأ إذا كان بعض من السائل يفرز هوفقدت عند نقله. في المقابل، فإن استخدام أقطاب أيون محددة يسمح بقياس نشاط أيون (من الذي يمكن حساب تركيز أيون) في الموقع. تم تعديل البروتوكول الحالي من تلك المستخدمة من قبل Maddrell والزملاء لقياس بطريق الظهارة K + تدفق عبر أنبوب صغير الرادنة باستخدام valinomycin باسم K + حامل الأيون 21، ويصف أيضا استخدام -butylcalix 4- ثالثي [4]، دآرين tetraacetic حمض رابع إيثيل نا القائم على استر + -specific القطب أيون محددة تتميز Messerli وآخرون. آل 22. كما تم استخدام أقطاب أيون محددة لقياس تركيزات الأيونات في السوائل التي يفرزها الأنابيب مالبيغي في فحص رامزي في الكبار 9،23 واليرقات 16 ذبابة الفاكهة السوداء البطن، ونيوزيلندا جبال الألب يتا (Hemideina الماوري) 24 و 17 في البعوض.
هنا، نحن تصف بالتفصيل استخدام رامزي كماأقول لقياس معدلات إفراز السوائل في الأنابيب مالبيغي من ذبابة الفاكهة، فضلا عن استخدام أقطاب أيون محددة لتحديد تركيزات K + و + نا داخل السائل المفرز وبالتالي احتساب التدفقات بطريق الظهارة أيون. وتقدم لمحة عامة عن الفحص في الشكل 1.
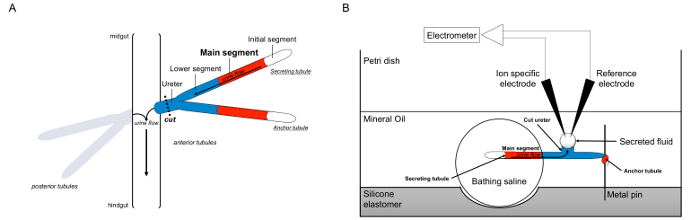
الشكل 1. تخطيطي لمالبيغي الأنابيب الصغيرة والفحص رامزي مع استخدام ايون محددة أقطاب لقياس تركيزات الأيونات. ويوضح هذا الرقم الإعداد لفحص رامزي. (A) كل ذبابة أربعة الأنابيب، وزوج من الأنابيب الأمامية وزوج من الأنابيب الخلفية، التي تطفو في تجويف البطن وتحيط بها الدملمف. في كل زوج، والأنابيب اثنين من الانضمام في الحالب، والتي ثم يفرغ البول عند تقاطع المعي المتوسط وhindguت. الأنابيب عمياء العضوية. يتم إنشاء البول عن طريق القطاع الرئيسي إفراز السائل (كما هو موضح باللون الأحمر)، ويتدفق نحو الحالب والخروج إلى الأمعاء. بعد تشريح، وفصل الزوج أنبوب صغير من الأمعاء عن طريق transecting الحالب. (B) ثم يتم نقل زوج من الأنابيب إلى قطرة من الاستحمام المالحة داخل بئر للطبق الفحص. واحدة من الأنابيب اثنين، المشار إليها هنا باسم "مرساة أنبوبية،" هو التفاف حول مسمار معدني وغير خامل. نبيب الآخر هو أنبوب صغير إفراز. يبقى الجزء الأول (الذي لا تفرز السائل) والجزء الرئيسي من أنبوب صغير إفراز داخل قطرة من الاستحمام المالحة. الأيونات وتحرك المياه المالحة من الاستحمام وداخل تجويف أنبوب صغير من الجزء الرئيسي، ومن ثم تتحرك نحو الحالب، كما يمكن أن تحدث في الجسم الحي. الجزء السفلي (الأزرق) هو خارج المالحة الاستحمام، وبالتالي خاملة. منذ يتم قطع الحالب، السائل يفرز كما يظهر قطرات من نهاية قطع من الحالب. تانه يفرز السائل قطرات يوسع على مر الزمن مع استمرار إفراز، ويتم قياس قطرها باستخدام ميكرومتر بصري. هناك طبقة من الزيت المعدني يمنع تبخر السوائل تفرز. الأقطاب محددة المرجعية وأيون قياس تركيز أيون السائل المفرز. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
استخدام فحص رامزي، جنبا إلى جنب مع أقطاب أيون محددة، يسمح للقياس معدلات إفراز السوائل وتدفقات ايون في الحشرات معزولة مالبيغي (الكلى) الأنابيب. يمكن أن يعاير عشرين أو أكثر من الأنابيب في وقت واحد، مما يتيح أعلى إنتاجية مقارنة مقايسة من فرد في المختبر microperfused الأن?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

