Die Nutzung der Ramsay Assay zu Flüssigkeitssekretion und Ionenfluss Preise in der Maßnahme<em> Drosophila melanogaster</em> Malpighischen Tubulus
Summary
Dieses Protokoll beschreibt die Verwendung des Ramsay Assay Flüssigkeitssekretion Raten von isolierten Malpighischen (Nieren) Tubuli aus Drosophila melanogaster zu messen. Darüber hinaus ist die Verwendung von ionenspezifischen Elektroden, die Natrium- und Kaliumkonzentrationen in der sekretierten Flüssigkeit zu messen, mit Berechnung der transepithelialen Ionenfluss, wird beschrieben.
Abstract
Modulation Nierenepithelzellen Ionentransport erlaubt Organismen ionische und osmotische Homöostase angesichts der unterschiedlichen äußeren Bedingungen aufrechtzuerhalten. Die Drosophila melanogaster Malpighischen (Nieren) Tubulus bietet eine einmalige Gelegenheit, um die molekularen Mechanismen der epithelialen Ionentransport zu untersuchen, aufgrund der leistungsfähigen Genetik dieses Organismus und der Zugänglichkeit ihrer Nierentubuli auf physiologische Studie. Hier beschreiben wir die Verwendung des Ramsay Assayfluid Sekretionsraten von isolierten fly Nierentubuli zu messen, mit der Verwendung von ionenspezifischen Elektroden, die Natrium- und Kaliumkonzentrationen in der sekretierten Flüssigkeit zu messen. Dieser Assay ermöglicht Studium der transepithelialen Flüssigkeit und Ionenflüsse von ~ 20 Tubuli zu einer Zeit, ohne die Notwendigkeit, das sezernierte Fluid zu einer separaten Vorrichtung zu übertragen, um die Ionenkonzentration zu messen. Genetisch unterschiedlichen Tubuli können analysiert werden, um die Rolle spezifischer Gene, die in Transportprozessen zu beurteilen. Zusätzlich wird die bathing Salzlösung kann geändert werden, um die Wirkungen der chemischen Eigenschaften oder Arzneimittel oder Hormone zugesetzt untersuchen. Zusammenfassend ermöglicht diese Technik die molekulare Charakterisierung der Grundmechanismen von epithelialen Ionentransport in Drosophila Tubulus sowie Regelung dieser Transportmechanismen.
Introduction
Nierenepithelzellen Ionentransport zugrunde organismal iono- und Osmoregulation. Die Drosophila melanogaster Malpighischen (Nieren) Tubulus bietet eine einmalige Gelegenheit, um die molekularen Mechanismen der epithelialen Ionentransport zu studieren. Dies ist aufgrund der Kombination der leistungsfähigen Genetik von Drosophila, gepaart mit der Zugänglichkeit der Nierentubuli auf physiologische Studie. Die Ramsay Assay, nach dem Forscher, der die Technik 1 Pionier benannt, misst Flüssigkeitssekretion Raten von isolierten Malpighischen, und wurde in Drosophila 1994 von Dow und Kollegen 2 etabliert. Dies ebnete den Weg für weitere Studien unter Verwendung von Drosophila genetische Werkzeuge, wie beispielsweise die GAL4-UAS-System 3,4, um zellspezifische Signalwege regulieren Flüssigkeitssekretion definieren. Ein Beispiel beinhaltet Calcium-Signal in Reaktion auf ein Peptidhormon, 5, unter vielen anderen 6,7.
ve_content "> eine Kombination von genetischen Techniken und klassischen physiologischen Studie hat gezeigt, dass Urin-Generation gezeigt, in die Fliege durch die Sekretion eines Kaliumchlorid-reiche Flüssigkeit aus dem Hauptsegment der Röhrchen erfolgt. erfolgt dies durch die parallele transepithelialen Sekretion von Kationen, in erster Linie K +, sondern auch Na +, durch die Hauptzelle und Cl -. Sekrets durch die Sternzellen 8-12 Die Fähigkeit, transepithelialen K + und Na + Flüsse getrennt zu messen ermöglicht eine genauere Charakterisierung von Transportmechanismen als die Messung Flüssigkeitssekretion allein, z. B. in unstimulierten Drosophila Tubuli, die Na + / K + -ATPase-Inhibitors Ouabain hat keine Auswirkung auf Flüssigkeitssekretion 2, auch wenn ihre Aufnahme in den Hauptzellen wird durch den organischen Anionentransporter Inhibitor Taurocholat 13 gesperrt. Jedoch Linton und O'Donnell zeigte, dass Ouabain depolarisiertder basolateralen Membranpotential und erhöht Na + Fluss 9. Wie in den Repräsentative Ergebnisse gezeigt, repliziert haben wir die Ergebnisse und zeigte, daß K + Flußmittel gleichzeitig um 14; die erhöhte Na + Fluss und verminderte K + Fluss haben entgegengesetzte Auswirkungen auf Flüssigkeitssekretion, was zu keiner Nettoänderung der Sekretion. So gibt es zwei Entschließungen zum "Ouabain Paradox", das heißt, die anfängliche Beobachtung, dass keine Auswirkung auf Flüssigkeitssekretion im Drosophila-Röhrchen Ouabain:. Zunächst in stimulierten Tubuli, ist nicht ersichtlich, die Wirkung von Ouabain auf Flüssigkeitssekretion aufgrund seine Aufnahme durch den organischen Anionentransporter 13; und zweitens, in unstimulierten Tubuli, Ouabain hat gegenläufige Effekte auf transepithelialen Na + und K + Fluss, was zu keiner Nettoänderung der Flüssigkeitssekretion (siehe Repräsentative Ergebnisse und ref. 9). Die primäre Rolle der Na + / K + -ATPase in unstimulierten Tubuli ist es, intrazellulären Na + -Konzentration zu senken, um eine günstige Konzentrationsgradienten zu erzeugen für die Na + -gekoppelten Transportprozesse in der basolateralen Membran. Tat kann durch separates Messen Na + und K + Flüsse zeigten wir, dass Tubuli fehlt die Fliege Natrium-Kalium-2-Chlorid-Cotransporter (NKCC) haben transepithelialen K + Flusses vermindert, wobei keine weitere Abnahme nach Ouabain hinaus und keine Veränderung des transepithelialen Na + Fluss 14. Diese Ergebnisse unterstützten unsere Schlussfolgerung, dass Na + in die Zelle durch die NKCC wird durch die Na + / K + -ATPase recycelt. In einem anderen Beispiel Ianowski et al. Beobachtet, dass die Senkung Bad K + -Konzentration von 10 mM bis 6 mM verringert transepithelialen K + Flußmittel und erhöht den transepithelialen Na + Flusses in Tubuli aus Rhodnius prolixus, ohne Nettoänderung in Flüssigkeitssekretion <sup> 15. Unterschiedliche Auswirkungen auf Na + und K + Flussflusses über Larven Tubuli wurden auch in Drosophila Tubuli als Reaktion auf variierende Salzdiäten 16 und in zwei Mückenarten in Reaktion auf die Aufzucht Salinität 17 beobachtet worden.Die größte Herausforderung bei der Messung des transepithelialen Ionenfluß im Ramsay Probenaufbereitung ist die Bestimmung von Ionenkonzentrationen in der sekretierten Flüssigkeit. Diese Herausforderung hat mit unterschiedlichen Lösungen, einschließlich flamm photometery 18, Verwendung von radioaktiven Ionen 19 und Elektronensonde Wellenlänge Spektroskopie 20 erfüllt sind. Diese Techniken erfordern Übertragung des sekretierten Fluidtropfen auf ein Instrument zur Messung von Ionenkonzentrationen. Da das Volumen der Flüssigkeit durch den unstimulierten Drosophila Tubulus sekretiert ist klein, typischerweise ~ 0,5 nl / min, stellt dies eine technische Herausforderung dar und führt auch Fehler, wenn einige der sekretierten Flüssigkeitverlor bei der Übertragung. Im Gegensatz dazu die Verwendung von ionenspezifischen Elektroden ermöglicht die Messung der Ionenaktivität (von dem Ionenkonzentration berechnet werden kann) in situ. Das aktuelle Protokoll wurde von dem von Maddrellschem und Kollegen zur transepithelialen K + Flusses über die Rhodnius Tubulus Messung mit Valinomycin als Ionophor K + 21 angepasst, und beschreibt auch die Verwendung eines 4-tert-Butylcalix [4] aren-tetraessigsäure Tetraethylester basierten Na + -spezifische ionenspezifischen Elektrode, gekennzeichnet durch Messerli et. al. 22. Ionenspezifischen Elektroden wurden ebenfalls verwendet, um die Ionenkonzentrationen in Flüssigkeit durch Malpighischen im Ramsay Assay bei Erwachsenen 9,23 und 16 Larven Drosophila melanogaster sezerniert zu messen, der Neuseeland-Alpine Weta (Hemideina maori) 24 und in Moskitos 17.
Hier beschreiben wir im Detail die Verwendung des so Ramsaysage Flüssigkeitssekretion Raten in Malpighischen von Drosophila melanogaster, sowie die Verwendung von ionenspezifischen Elektroden, die Konzentrationen von K + und Na + innerhalb von sekretierten Flüssigkeit zu bestimmen und somit die Berechnung der transepithelialen Ionenflüsse zu messen. Eine Übersicht des Tests ist in Figur 1 vorgesehen.
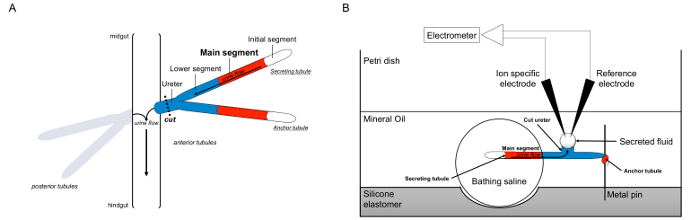
Abbildung 1. Schematische Darstellung des Vasa Malpighi und der Ramsay-Assay unter Verwendung von ionenspezifischen Elektroden, die an Ionenkonzentrationen zu messen. Diese Abbildung zeigt das Setup für die Ramsay Assay. (A) Jede Fliege hat vier Röhrchen, ein Paar von vorderen Tubuli und ein Paar von hinteren Tubuli, die schwimmen in der Bauchhöhle von Hämolymphe umgeben. In jedem Paar, verbinden die beiden Röhrchen in den Harnleiter, die dann leert den Urin an der Kreuzung des Mitteldarms und hindgut. Die Röhrchen sind blind digen. Urin wird durch die (in rot dargestellt) Flüssigkeit absondernden Hauptsegment erzeugt und strömt in Richtung des Harnleiters und hinaus in den Darm. Nach der Präparation wird die Tubuli Paar aus dem Darm durch Durchtrennung des Harnleiters dissoziiert. (B) Das Paar von Röhrchen wird dann in einen Tröpfchenbadesalzlösung innerhalb einer Vertiefung des Assays Schale überführt. Eines der beiden Röhrchen, hier als die "Anker Tubulus" ist um einen Metallstift gewickelt und ist inert. Die andere Röhrchen ist die sezernierenden Röhrchen. Das Anfangssegment (die nicht Flüssigkeit sezerniert) und Hauptsegment der sezernierenden Röhrchen bleiben innerhalb des Tröpfchens des Badens Kochsalzlösung. Ionen und Wasser Umzug von der Badekochsalzlösung und in die Tubuluslumen des Hauptsegments und dann in Richtung des Harnleiters zu bewegen, wie es in vivo auftreten. Das untere Segment (blau) ist außerhalb der Badesalzlösung und daher inert. Da der Harnleiter geschnitten wird, tritt der sekretierten Flüssigkeit als ein Tröpfchen von dem geschnittenen Ende des Ureters. Ter sezerniert Fluidtröpfchen vergrößert Laufe der Zeit als Sekret setzt, und sein Durchmesser wird unter Verwendung eines okularen Mikrometers gemessen. Eine Schicht von Mineralöl verhindert die Verdunstung des sekretierten Flüssigkeit. Die Referenz- und ionenspezifische Elektroden messen die Ionenkonzentration der Flüssigkeit ausgeschieden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Die Verwendung des Ramsay Assay zusammen mit ionenspezifischen Elektroden, ermöglicht die Messung der Fluid Sekretionsraten und Ionenströme in isolierten Insekten Malpighian (Niereninsuffizienz) Tubuli. Zwanzig oder mehr Tubuli kann zu einem Zeitpunkt untersucht werden, was einen höheren Durchsatz im Vergleich zu dem Assay in vitro einzelne microperfused Tubuli. Zusätzlich ionenspezifischen Elektroden erlauben die Bestimmung von Ionenkonzentrationen in der sekretierten Flüssigkeit in situ, die Beg…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

