で液分泌とイオンフラックス速度を測定するためのラムゼイアッセイの使用<em>キイロショウジョウバエ</em>マルピーギ管
Summary
このプロトコルは、 キイロショウジョウバエから単離しマルピーギ(腎)細管からの流体分泌速度を測定するためのラムゼイアッセイの使用を記載しています。また、イオン特異的電極の使用は、経上皮イオンフラックスの計算を可能にする、分泌液中のナトリウム及びカリウムの濃度を測定するために、記載されています。
Abstract
腎上皮イオン輸送の調節は、生物が外部条件の変化の顔にイオン性および浸透圧の恒常性を維持することができます。 キイロショウジョウバエマルピーギ(腎臓)細管が原因でこの生物の強力な遺伝学と生理学的研究への尿細管のアクセスに、上皮のイオン輸送の分子メカニズムを研究するための比類のない機会を提供しています。ここで、我々は、分泌液中のナトリウム及びカリウムの濃度を測定するために、イオン特異的電極を使用して、単離されたフライ尿細管からの流体の分泌速度を測定するためラムゼイアッセイの使用を記載しています。このアッセイは、イオン濃度を測定するための別の装置に分泌液を転送する必要なく、一度に20〜細管の上皮の流体及びイオンフラックスの研究を可能にします。遺伝的に異なる細管は、輸送プロセスにおける特定の遺伝子の役割を評価するために分析することができます。また、Bathing生理食塩水を添加し、その化学的性質、または薬物またはホルモンの影響を調べるために改変することができます。要約すると、この技術は、基本的なショウジョウバエの細管上皮イオン輸送機構、ならびにこれらの輸送メカニズムの規制の分子特徴づけを可能にします。
Introduction
腎上皮イオン輸送は、生物のiono-と浸透圧調節の下にあります。 キイロショウジョウバエマルピーギ(腎臓)細管上皮イオン輸送の分子メカニズムを研究するための比類のない機会を提供しています。これは、生理的な研究への尿細管のアクセスとペアにショウジョウバエの強力な遺伝学の組み合わせに起因するものです。技術1を開拓し 、研究者の名にちなんで名付けラムゼイアッセイは、孤立したマルピーギ細管から流体分泌速度を測定し、ダウと同僚2で 1994年にショウジョウバエに設立されました。これは、流体の分泌を調節する細胞特異的なシグナル伝達経路を定義するには、そのようなGAL4-UASシステム3,4 ショウジョウバエ遺伝的ツールを使用して、さらなる研究のために道を開きました。例は、他の多くの中で6,7-ペプチドホルモン5に対する応答におけるカルシウムシグナル伝達を含みます。
ハエは、尿細管の主なセグメントからの塩化カリウムに富む流体の分泌を介して起こるでve_content ">遺伝子技術と古典的な生理学的研究の組み合わせは、その尿の生成を示している。これは主に、陽イオンの並列経上皮分泌を介して行われKは+だけでなく、 の Na + は 、主細胞、およびClを通して– 。星細胞8-12を通じて分泌別途経上皮の K +およびNa +フラックスを測定する能力は、流体分泌の測定よりも輸送メカニズムのより詳細な特性評価を可能にします単独で、例えば、非刺激ショウジョウバエ細管ではNa + / K + -ATPアーゼ阻害剤ウアバインは、主細胞への取り込みは、有機アニオントランスポーター阻害剤タウロコール酸13によって阻害された場合でも、体液分泌2には影響を与えないが、リントンとオドネルは、ウアバインが脱分極することを示しました側底膜電位、およびNa +フラックス9を上昇させます 。代表的な結果に示すように、我々はこれらの結果をレプリケートし、K +フラックス14を同時に減少させることが示されました。増加の Na + フラックスおよび K +フラックスを減少させた分泌の正味の変化が生じ、流体分泌に対する反対の効果を持っています。 。このように、「ウアバインパラドックス」、すなわちへの2つの解像度があり、 ショウジョウバエの細管内の流体の分泌に影響を与えませんウアバイン初期観察は:まず、刺激細管に、流体分泌に対するウアバインの効果は明らかではないが原因有機アニオントランスポーター13によるその取り込み。そして第二に、非刺激細管に、ウアバインは(代表的な結果とrefを参照してください。9)液分泌の純変化なしで、その結果、上皮の Na + および K +フラックスへの影響に反対しています。 Na + / K + -ATPのため、主な役割非刺激細管にアーゼ基底膜を越えて輸送プロセスを共役型のNa +のための有利な濃度勾配を生成するために、細胞内のNa +濃度を低下させることです。確かに、別々 の Na + および K +フラックスを測定することにより、我々は、フライナトリウム-カリウム-2-塩化共輸送体(NKCC)を欠いている細管をさらにウアバイン添加後減少し、経上皮に変化がないがないと、経上皮K +フラックスが低下していることを実証しましたNa +が14フラックス 。これらの知見は、NKCCを通じてセルに入るの Na + をNa + / K + -ATPアーゼを介してリサイクルされ、私たちの結論を支持しました。別の例では、Ianowski ら 6mmの10 mMのからバスK +濃度の低下は、流体分泌の純変化なしで、経上皮K +フラックスとRhodniusのprolixusから尿細管における増加した上皮の Na + 流入を減少することが観察され<sup> 15。幼虫細管全体での Na + フラックスおよび K +フラックスの差動効果も塩分17を飼育することに応答して変動する塩食16に二蚊の種に応じて、 ショウジョウバエの細管において観察されています。ラムゼイアッセイ調製物における経上皮イオンフラックスの測定における最大の課題は、分泌された流体内のイオン濃度の決意です。この課題は、難photometery 18、放射性イオン19を使用すると、電子プローブ波長分散分光法20を含む様々なソリューションと満たされています。これらの技術は、イオン濃度を測定するための機器に分泌液滴の移動を必要とします。非刺激ショウジョウバエ細管により分泌される流体の体積が小さいため、通常は0.5〜NL /分で、これは技術的な課題を提起し、分泌された流体の一部である場合、エラーが導入され転送時に失わ。対照的に、イオン特異的電極の使用は、 その場での (イオン濃度を算出することが可能な)イオン活性の測定を可能にします。現在のプロトコルは、K +イオノフォア21としてバリノマイシン使用してRhodnius細管全体の経上皮K +フラックスを測定するためにMaddrellらによって使用されるものから適合し、また、4- ターシャの -butylcalix [4]アレーン四酢酸の使用が記載されましたテトラエチルエステル系NaがMesserli らによって特徴づけられる特異的イオン固有の電極を+。アル。22。イオン特定電極はまた、大人の9,23および幼虫16 キイロショウジョウバエでラムゼイアッセイにおいてマルピーギ細管により分泌液中のイオン濃度を測定するために使用されてきた、ニュージーランドアルパインウェタ(Hemideinaマオリ )24と蚊17インチ
ここでは、詳細にラムゼイとしての使用を記載ショウジョウバエからマルピーギ細管流体分泌速度を測定するだけでなく、分泌液、したがって、経上皮イオンフラックスの計算内の K +およびNa +の濃度を決定するために、イオン固有の電極を使用すると言います。アッセイの概要を図1に提供されます。
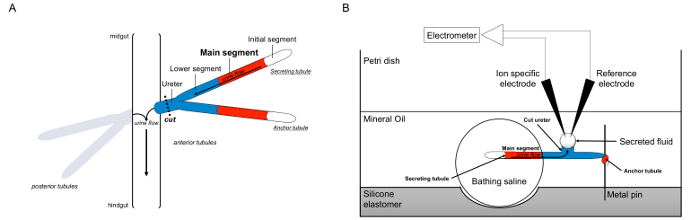
マルピーギ細管の図1の回路図とイオン濃度を測定するためのイオン特定電極の使用とラムゼイアッセイ 。この図は、ラムゼイアッセイのためのセットアップを示しています。 (A)各フライは、4つの細管、前方細管一対の後部細管のペア、血リンパに囲まれた腹腔内のそのフロートを持っています。各ペアでは、二つの細管はその後、中腸とhindguの接合部に尿を空に尿管、に参加しますトン。細管は、ブラインド・エンドです。尿は(赤で示した)は、流体分泌メインセグメントによって生成され、消化管に尿管に向かって内外に流れます。解剖後、細管のペアは、尿管を横断することにより、腸から解離します。 (B)は、尿細管のペアは、その後、アッセイ皿のウェル内入浴食塩水の液滴に移しました。 2細管の一つは、「アンカー細管は、「金属ピンの周りを包み、不活性であるとしてここでいいます。他の細管は、分泌細管です。 (液体を分泌しない)最初のセグメントと分泌細管の主なセグメントは、入浴の生理食塩水の液滴内に残ります。その後、イオンと水の移動入浴生理食塩水から、主要セグメントの尿細管内腔へ、および生体内で起こるように、尿管に向かって移動します。下部セグメント(青)が入浴生理食塩水、したがって不活性外です。尿管が切断されるので、分泌液が尿管の切断端からの液滴として現れます。 T彼は、分泌が続くように、流体液滴が時間とともに拡大し、分泌され、その直径は、接眼マイクロメータを用いて測定されます。ミネラルオイルの層は、分泌液の蒸発を防止します。リファレンスとイオン特定電極が分泌液のイオン濃度を測定する。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
一緒にイオン固有の電極を有するラムゼイアッセイの使用は、孤立した昆虫マルピーギ(腎)細管内の流体分泌速度とイオンフラックスの測定を可能にします。 20以上の細管は 、インビトロmicroperfused細管内の個々のアッセイと比較してより高いスループットを可能にする、一度にアッセイすることができます。また、イオン特異電極は、第2の装置への流体の少量の移動に導入?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

