Использование Рамсей анализе измерить жидкости секреции и поток ионов ставки в<em> Дрозофилы</em> Мальпигиев канальцев
Summary
Этот протокол описывает использование анализа Ramsay для измерения скорости жидкости секреции изолированных мальпигиев (почечная) канальцев из дрозофилы. Кроме того, использование ион-специфических электродов для измерения концентрации натрия и калия в секретируемого жидкости, что позволяет рассчитать потока ионов трансэпителиальная, описан.
Abstract
Модуляция почечной транспорта ионов эпителиальной позволяет организмы для поддержания ионной и осмотическое гомеостаз в условиях различной внешних условий. Дрозофилы мальпигиев (почечная) трубочка предлагает уникальную возможность для изучения молекулярных механизмов транспорта ионов эпителия, из-за мощных генетики этого организма и доступности ее почечных канальцах физиологического исследования. Здесь мы описываем использование анализа Ramsay для измерения скорости жидкости секреции изолированные мух почечных канальцев, с использованием ион-специфических электродов для измерения концентрации натрия и калия в секретируемого жидкости. Этот анализ позволяет изучение трансэпителиальная жидкости и ионных потоков ~ 20 трубочек в то время, без необходимости переноса секретируемый жидкости в отдельном устройстве для измерения концентрации ионов. Генетически различные трубочки могут быть проанализированы, чтобы оценить роль специфических генов в процессах переноса. Кроме того, бathing солевой могут быть изменены с целью изучения воздействия своих химических характеристик, или наркотиков или гормонов добавил. Таким образом, эта методика позволяет молекулярной характеристики основных механизмов транспорта ионов в эпителиальной канальца Drosophila, а также регулирование этих транспортных механизмов.
Introduction
Почечная транспорт эпителиальных ионов лежит в основе организменном ионосферы и осморегуляции. Дрозофилы мальпигиев (почечная) трубочка предлагает уникальную возможность для изучения молекулярных механизмов транспорта ионов эпителия. Это связано с комбинацией мощных генетики дрозофилы, в паре с доступностью его почечных канальцев к физиологическому изучению. Рамсей анализ, названный в честь исследователя, который впервые технику 1, измеряет жидкость цены секреции из изолированных мальпигиевых канальцев, и была создана в 1994 году дрозофилы в Доу и коллег 2. Это проложило путь для дальнейших исследований с использованием генетических Drosophila инструменты, такие как системы GAL4-UAS 3,4, чтобы определить соты сигнальные пути, регулирующие секрецию жидкости. Пример включает в себя сигнализацию кальция в ответ на это пептидный гормон, 5 среди многих других 6,7.
ve_content "> Сочетание генетических методов и классического физиологического исследования показали, что поколение мочи в лету происходит через секреции хлорида богатых жидкости калия из основного сегмента канальцев. Это происходит через трансэпителиального секреции параллельно катионов, прежде всего, К +, но и Na +, через основной камере, и Cl -. секреции через звездчатого клетки 8-12 Способность отдельно измерить трансэпителиальная потоков К + и Na + позволяет более подробную характеристику транспортных механизмов, чем измерение секреции жидкости в покое. Например, в нестимулированных канальцев Drosophila, Nа + / К + -АТФазы ингибитор оуабаин не имеет никакого эффекта на секрецию 2 жидкости, даже когда его поглощение в основных клетках ингибируется органический анион транспортер ингибитора таурохолата 13. Тем не менее, Линтон и О'Доннелл показал, что уабаин деполяризуетбазолатеральный мембранный потенциал, и увеличивает поток Na + 9. Как показано в представительных результатов, мы воспроизвели эти результаты и показали, что поток К + одновременно снизился 14; увеличение потока Na + и K + снизился поток имеет противоположные эффекты на секрецию жидкости, в результате чего не чистого изменения в секреции. Таким образом, есть две резолюции к "уабаина парадокса", т.е., начальное наблюдение, что уабаина не имеет никакого эффекта на секрецию жидкости в канальцах Drosophila:. Во-первых, в стимулированных канальцев, эффект уабаина на секрецию жидкости не является очевидным из-за его поглощение в органический анион транспортер 13; во-вторых, в нестимулированных канальцев, оуабаин имеет противоположные эффекты на трансэпителиальная Na + и К + потока, что приводит к отсутствию изменений в чистой секреции жидкости (см Представитель Результаты и Ref. 9). Таким образом, основная роль Na + / K + -АТФазы в стимулированных канальцев снизить концентрацию внутриклеточного Na + для создания благоприятного градиента концентрации для Na +, -coupled транспортных процессов по базолатеральной мембране. Действительно, отдельно измерения Na + и K + потоки, мы показали, что канальцы не хватает на лету натрия калия-2-хлорида котранспортера (NKCC) снизились трансэпителиальный K + поток, без дальнейшего снижения после уабаина того, и никаких изменений в трансэпителиального Na +, поток 14. Эти данные поддержал наш вывод, что Na +, введя ячейку через NKCC возвращают через Na + / K + -АТФазы. В другом примере, Ianowski и др. Наблюдали, что снижение ванны концентрации К + от 10 мм до 6 мм уменьшилось трансэпителиальный K + поток и увеличение трансэпителиальный Na +, в канальцах поток от Rhodnius prolixus, без чистого изменения в секреции жидкости <sup> 15. Дифференциальные воздействие на поток и K + Na + поток через личиночной канальцев наблюдали также в Drosophila канальцев в ответ на разной соли диеты 16 и в двух видов комаров в ответ на выращивании соленость 17.Самой большой проблемой в измерении потока ионов трансэпителиальная в подготовке Рамсей анализа является определение концентраций ионов внутри секретируется жидкости. Эта задача была выполнена с различной решений, в том числе фотометрию пламени 18, применение радиоактивных ионов 19, и волны зонда электронного дисперсионные спектроскопии 20. Эти методы требуют передачи секретируемого капли жидкости на прибор для измерения концентрации ионов. Поскольку объем жидкости, секретируемый нестимулированных Drosophila трубочку мала, обычно ~ 0,5 нл / мин, это создает техническую проблему, а также вносит ошибку, если некоторые из секретируемого жидкостипотеряли при передаче. В противоположность этому, использование ион-специфических электродов позволяет измерять активности ионов (из которой концентрация ионов может быть рассчитано) на месте. Текущий протокол был адаптирован от используемого Maddrell и коллегами для измерения трансэпителиальный K + поток через трубочку Rhodnius в использовании валиномицина как K + ионофор 21, а также описывает использование 4-трет–butylcalix [4] арена-этилендиаминтетрауксусной кислоты тетраэтилсвинец на основе сложного эфира Na + Определённые ионный конкретных электрод характеризуется Messerli др. др. 22. Ион-специфичные электроды были также использованы для измерения концентрации ионов в жидкости, выделяемой мальпигиевых канальцев в анализе Рамсей во взрослой 9,23 и личинок дрозофилы 16, Новой Зеландии Горные Weta (Hemideina маори) 24 и в 17 комаров.
Здесь мы подробно использование Рамсей какговорят, чтобы измерить жидкости цены секреции в канальцах мальпигиевых из дрозофилы, а также использование ион-специфических электродов для определения концентрации K + и Na + в секретируемого жидкости и, таким образом расчет трансэпителиальная ионных потоков. Обзор анализа обеспечивается на фиг.1.
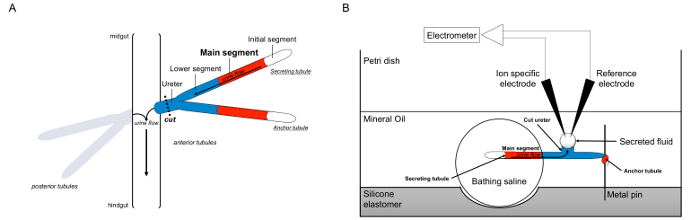
Рисунок 1. Схема мальпигиевых и Рамсей Анализ с использованием ион-специфических электродов измерить концентрации ионов. Эта цифра показывает установку для анализа Рамсей. (А) Каждый муха имеет четыре трубочки, пару передних канальцев и пару задних канальцев, которые плавают в брюшной полости, окруженной гемолимфы. В каждой паре, две трубочки соединяются в мочеточнике, который затем впадает мочи на стыке кишки и hindguт. Трубки слепы состава. Моча образуется в жидкости, секретирующие основной сегмент (показан красным), и течет к мочеточника и вышел в кишечнике. После вскрытия, пара трубочка диссоциирует из кишечника по пересекающих мочеточник. (B) пара канальцев затем переносили в капле физиологического раствора купания в лунку анализа блюдо. Один из двух трубочек, называют здесь как "якоря трубочку," обернут вокруг металлический штырь и инертен. Другой трубочка является секрецию канальцев. Начальный участок (который не секретирует жидкость) и основной сегмент, секретирующих трубочку оставаться в капле физиологического раствора купания. Ионы и вода переход от купания и солевом растворе в просвете канальцев основной сегмент, а затем перейти к мочеточника, как это происходит в естественных условиях. Нижний сегмент (синий) находится за пределами купания физиологического раствора, и поэтому инертны. Поскольку мочеточник вырезать, секретируемый жидкости возникает как капли от срез мочеточника. ТОн секретируется капель жидкости увеличивает течением времени, как секреции продолжается, и его диаметр измеряется с помощью окулярного микрометра. Слой минерального масла предотвращает испарение жидкости секретируемого. Конкретные ссылки и ионов электроды измерения концентрации ионов секретируемого жидкости. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
Применение анализа Ramsay вместе с ион-специфических электродов, позволяет измерять жидкости ставок секреции и ионных потоков в изолированных насекомых мальпигиевых (почечных канальцев). Двадцать и более канальцы могут быть проанализированы в то время, позволяя более высокую пропускну?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors wish to thank Drs. Sung-wan An and Mike O’Donnell for practical advice on establishing this assay, Dr. Chih-Jen Cheng for helpful discussions on the use of ion-specific electrodes, and Dr. Chou-Long Huang for his mentorship and support. This work was supported by the National Institutes of Health (K08DK091316 to ARR) and the American Society of Nephrology Gottschalk Award to ARR.
Materials
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | http://www.ellsworth.com/dow-corning-sylgard-184-silicone-encapsulant-0-5kg-kit-clear/ | May be purchased from multiple distributors |
| Petri dish, polystyrene, 100 mm x 15 mm | Fisher | FB0875712 | Specific brand is not important |
| Petri dish, polystyrene, 35 mm x 10 mm | Corning Life Sciences | Fisher 08-757-100A | Specific brand is not important |
| Scalpel Handle #3 | Fine Science Tools | 10003-12 | Specific brand is not important |
| Scalpel Blades #1 | Fine Science Tools | 10011-00 | Specific brand is not important; use appropriate sharps precautions |
| Needle, 30G x 1/2 | Becton Dickinson | 305106 | Use appropriate sharps precautions |
| Minutien pins, black anodized, 0.15 mm | Fine Science Tools | 26002-15 | |
| Stereomicroscope with ocular micrometer | Nikon | SMZ800 | Specific brand is not important; this is given as an example |
| Sheet of black stained glass, 3 mm (1/8 inch) thick | Hobby shop | Example includes Spectrum Black Opal by Spectrum Glass (http://www.delphiglass.com/spectrum-glass/opalescent/spectrum-black-opal) | |
| Glass cutting tools (glass cutter, glass cutting pliers) | Hobby shop | Examples include the Studio Pro Lightweight Running Pliers by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/pliers-nippers/studio-pro-lightweight-running-pliers) and the Studio Pro Brass Glass Cutter by Diamond Tech (http://www.delphiglass.com/glass-cutters-tools/glass-cutters/studio-pro-brass-glass-cutter). Use appropriate safety precautions when cutting glass | |
| Borosilicate glass capillary tube, unfilamented, GC120-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0042 | |
| Borosilicate glass capillary tube, filamented, GC120F-10, OD 1.2 mm, ID 0.69 mm, length 10 cm | Warner Instruments | 30-0044 | |
| Nitric acid, 70% | Sigma | 438073 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines. Specific brand is not important |
| Cimarec 7 in x 7 in hotplate | Fisher | 11675911Q | Specific brand is not important; caution when heated |
| Selectophore dichlorodimethylsilane | Sigma | 40136-1ML | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Two-step vertical pipet puller | Narishige | PC-10 | Other pipet pullers can be used; this is given as an example |
| Glass petri dish, 150 mm diameter x 15 mm height | Fisher | 08-748E | Specific brand is not important; only one dish needed |
| World Precision Instruments E210 1 mm micropipette storage jar | Fisher | 50-821-852 | May be available from other distributors. Useful to have two jars. Note that although this jar is specified for 1 mm pipets, and the pipets used here are 1.2 mm, in our experience the 1 mm jar works best for the 1.2 mm pipets. |
| Silica Gel, Tel-Tale Desiccant, indicating, 10-18 mesh | Fisher | S161-500 | Indicating silica useful for determining whether silica gel retains desiccating ability |
| World Precision Instruments MicroFil, 34G | Fisher | 50-821-914 | May be available from other distributors. |
| 1 ml syringe with luer lock | Becton Dickinson | 309659 | May be available from other distributors. |
| 3 ml syringe with luer lock | Becton Dickinson | 309657 | May be available from other distributors. |
| D300 3-way stopcock with female luer lock inlet port, male luer outlet port with rotating collar and guard | Cole-Parmer | UX-30600-02 | Specific brand is not important |
| Female Luer Locking Connector | 4 Medical Solutions | ADC 9873-10 | Specific brand is not important; barbed end is ~4 mm at narrowest point and ~7 mm at widest point. |
| Silicone Tubing I.D. x O.D. x Wall: 1/16 x 1/8 x 1/32 in. (1.59 x 3.18 x 0.79 mm) | Fisher | 14-179-110 | Specific brand is not important |
| E-3603 tubing, I.D. x O.D.: 1/32 x 3/32 in | Fisher | 14171208 | Specific brand is not important |
| Modeling clay | Specific brand is not important | ||
| Selectophore potassium ionophore I, cocktail B | Sigma | 99373 | CAUTION: see Material Data Safety Sheet for appropriate storage and handling guidelines |
| Selectophore sodium ionophore X | Sigma | 71747 | Sodium ionphore X = 4-tert-butylcalix[4]arene-tetraacetic acid tetraethylester |
| Selectophore 2-nitrophenyl octyl ether | Sigma | 73732 | |
| Selectophore sodium tetraphenylborate | Sigma | 72018 | |
| Schneider's Drosophila medium | Life Technologies | 21720024 | |
| High impedance electrometer | World Precision Instruments | FD223a | |
| Microelectrode holder 1 mm with 45° body, vented, with handle | Warner Instruments | 64-1051 | |
| Microelectrode holder 1 mm with straight body, vented | Warner Instruments | 64-1007 | |
| Silver wire | Warner Instruments | 64-1318 | |
| Micromanipulators, pair | Leitz | Various brands/models will work; this is an example | |
| Faraday cage | Technical Manufacturing Corporation | 81-334-03 | This is an example; any Faraday cage will work |
| Single gooseneck fiberoptic light | Nikon | Specific brand is not important | |
| mineral oil | Fisher | BP-2629 | Specific brand is not important |
| forceps, Dumont #5 with Biologie tip | Fine Science Tool | 11295-10 | May be available from other distributors. |
References
- Ramsay, J. A. Active Transport of Water by the Malpighian Tubules of the Stick Insect, Dixippus-Morosus (Orthoptera, Phasmidae). J Exp Biol. 31, 104-113 (1954).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. Proc Natl Acad Sci U S A. 94, 5207-5212 (1997).
- Rosay, P., et al. Cell-type specific calcium signalling in a Drosophila epithelium. J Cell Sci. 110 (15), 1683-1692 (1997).
- Dow, J. T., Davies, S. A. Integrative physiology and functional genomics of epithelial function in a genetic model organism. Physiol Rev. 83, 687-729 (2003).
- Beyenbach, K. W., Skaer, H., Dow, J. A. The developmental, molecular, and transport biology of Malpighian tubules. Annu Rev Entomol. 55, 351-374 (2010).
- Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274, 1039-1049 (1998).
- Linton, S. M., O’Donnell, M. J. Contributions of K+:Cl- cotransport and Na+/K+-ATPase to basolateral ion transport in malpighian tubules of Drosophila melanogaster. J Exp Biol. 202, 1561-1570 (1999).
- Rheault, M. R., O’Donnell, M. J. Analysis of epithelial K(+) transport in Malpighian tubules of Drosophila melanogaster: evidence for spatial and temporal heterogeneity. J Exp Biol. 204, 2289-2299 (2001).
- Donnell, M. J., Dow, J. A., Huesmann, G. R., Tublitz, N. J., Maddrell, S. H. Separate control of anion and cation transport in malpighian tubules of Drosophila Melanogaster. J Exp Biol. 199, 1163-1175 (1996).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. Proc Natl Acad Sci U S A. 111, 14301-14306 (2014).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. Proc Natl Acad Sci U S A. 101, 13689-13693 (2004).
- Rodan, A. R., Baum, M., Huang, C. L. The Drosophila NKCC Ncc69 is required for normal renal tubule function. Am J Physiol Cell Physiol. 303, 883-894 (2012).
- Ianowski, J. P., Christensen, R. J., O’Donnell, M. J. Na+ competes with K+ in bumetanide-sensitive transport by Malpighian tubules of Rhodnius prolixus. J Exp Biol. 207, 3707-3716 (2004).
- Naikkhwah, W., O’Donnell, M. J. Salt stress alters fluid and ion transport by Malpighian tubules of Drosophila melanogaster: evidence for phenotypic plasticity. J Exp Biol. 214, 3443-3454 (2011).
- Donini, A., et al. Secretion of water and ions by malpighian tubules of larval mosquitoes: effects of diuretic factors, second messengers, and salinity. Physiol Biochem Zool. 79, 645-655 (2006).
- Maddrell, S. H. Secretion by Malpighian Tubules of Rhodnius movements of Ions and Water. J Exp Biol. 51, 71-97 (1969).
- Maddrell, S. H., Overton, J. A. Stimulation of sodium transport and fluid secretion by ouabain in an insect malpighian tubule. J Exp Biol. 137, 265-276 (1988).
- Williams, J. C., Beyenbach, K. W. Differential effects of secretagogues on Na and K secretion in the Malpighian tubules of Aedes Aegypti (L). J Comp Physiol. 149, 511-517 (1983).
- Maddrell, S. H., O’Donnell, M. J., Caffrey, R. The regulation of haemolymph potassium activity during initiation and maintenance of diuresis in fed Rhodnius prolixus. J Exp Biol. 177, 273-285 (1993).
- Messerli, M. A., Kurtz, I., Smith, P. J. Characterization of optimized Na+ and Cl- liquid membranes for use with extracellular, self-referencing microelectrodes. Anal Bioanal Chem. 390, 1355-1359 (2008).
- Ianowski, J. P., O’Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207, 2599-2609 (2004).
- Neufeld, D. S., Leader, J. P. Electrochemical characteristics of ion secretion in malpighian tubules of the New Zealand alpine weta (Hemideina maori). J Insect Physiol. 44, 39-48 (1997).
- Greenspan, R. J. . Fly Pushing: The Theory and Practice of Drosophila Genetics. , (1997).
- Jayakannan, M., Babourina, O., Rengel, Z. Improved measurements of Na+ fluxes in plants using calixarene-based microelectrodes. J Plant Physiol. 168, 1045-1051 (2011).
- Wu, Y., Schellinger, J. N., Huang, C. L., Rodan, A. R. Hypotonicity Stimulates Potassium Flux through the WNK-SPAK/OSR1 Kinase Cascade and the Ncc69 Sodium-Potassium-2-Chloride Cotransporter in the Drosophila Renal Tubule. J Biol Chem. 289, 26131-26142 (2014).
- Blumenthal, E. M. Modulation of tyramine signaling by osmolality in an insect secretory epithelium. Am J Physiol Cell Physiol. 289, 1261-1267 (2005).
- Dow, J. A., Maddrell, S. H., Davies, S. A., Skaer, N. J., Kaiser, K. A novel role for the nitric oxide-cGMP signaling pathway: the control of epithelial function in Drosophila. Am J Physiol. 266, 1716-1719 (1994).
- Dube, K., McDonald, D. G., O’Donnell, M. J. Calcium transport by isolated anterior and posterior Malpighian tubules of Drosophila melanogaster: roles of sequestration and secretion. J Insect Physiol. 46, 1449-1460 (2000).
- Efetova, M., et al. Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo. J Cell Sci. 126, 778-788 (2013).
- Rheault, M. R., O’Donnell, M. J. Organic cation transport by Malpighian tubules of Drosophila melanogaster: application of two novel electrophysiological methods. J Exp Biol. 207, 2173-2184 (2004).
- Donnell, M. J. Too much of a good thing: how insects cope with excess ions or toxins in the diet. J Exp Biol. 212, 363-372 (2009).
- Cheng, C. J., Truong, T., Baum, M., Huang, C. L. Kidney-specific WNK1 inhibits sodium reabsorption in the cortical thick ascending limb. Am J Physiol Renal Physiol. 303, 667-673 (2012).
- Cheng, C. J., Yoon, J., Baum, M., Huang, C. L. STE20/SPS1-related Proline/alanine-rich Kinase (SPAK) is Critical for Sodium Reabsorption in Isolated Perfused Thick Ascending Limb. Am J Physiol Renal Physiol. , (2014).

