מצרפי גירוי מוחי חשמל לא פולשני אפנון של תפקוד האדם מוטורי
Summary
לא פולשני גירוי המוח חשמלי יכול לווסת פונקציה והתנהגות קליפת מוח, היא למטרות מחקר קליניות. פרוטוקול זה מתאר גישות גירוי שונים במוח אפנון של מערכת התנועה האנושית.
Abstract
לא פולשני גירוי מוחי חשמל (NEBS) משמש כדי לווסת את תפקוד המוח וההתנהגות, הן למטרות מחקר קליני. בפרט, NEBS ניתן ליישם transcranially כמו גם גירוי זרם ישר (tDCS) או גירוי זרם חשמלי משתנה (TACs). סוגי גירוי אלו להפעיל הזמן-, dose- ובמקרה של תופעות קוטביות ספציפית tDCS על תפקוד מוטורי ומיומנות למידה בנבדקים בריאים. בזמן אחרון, tDCS נעשה שימוש כדי להגביר את הטיפול של מוגבלות מוטוריות בחולים עם הפרעות שבץ או תנועה. מאמר זה מספק צעד אחר צעד פרוטוקול למיקוד הקורטקס המוטורי הראשוני עם tDCS וגירוי רעש אקראי transcranial (tRNS), צורה מסוימת של TACs באמצעות זרם חשמלי יחיל באופן אקראי בתוך טווח תדרים מוגדר מראש. ההתקנה של שני מצרפי גירוי שונים מוסברת. בשני מצרפי האלקטרודה הפולטת (האנודה עבור tDCS) מושמת על הקורטקס המוטורי הראשוני של עניין. בשביל שגירוי חד-צדדית הקורטקס המוטורי האלקטרודה קבלת מושם על המצח הנגדי תוך לגירוי הקורטקס המוטורי בין שתי המדינות האלקטרודה קבלת מושם על הקורטקס המוטורי הראשוני ההפוך. היתרונות והחסרונות של כל מונטאז עבור אפנון של רגישות קליפת המוח והתפקוד המוטורי כולל למידה נדונים, וכן הבטיחות, הסבילות והיבטים מסנוור.
Introduction
לא פולשני גירוי מוחי חשמל (NEBS), הממשל של זרמים חשמליים למוח דרך הגולגולת ללא פגע, יכול לשנות את תפקוד המוח וההתנהגות 1 – 3. כדי לייעל את הפוטנציאל הטיפולי של אסטרטגיות NEBS הבנת המנגנונים המובילים להשפעות הנוירופיזיולוגיים והתנהגותיים עדיין יש צורך. תקינה של יישום על פני מעבדות שונות ושקיפות מלאה של נהלי גירוי מספקת את בסיס השוואה של נתונים התומך פרשנות אמינה של תוצאות והערכת המנגנונים המוצעים פעולה. גירוי זרם ישר Transcranial (tDCS) או transcranial לסירוגין גירוי הנוכחית (TACs) שינוי על פי פרמטרים של זרם חשמלי מוחל: tDCS מורכב הזרם חד כיווני מתמיד בין שתי אלקטרודות (האנודה ואת הקתודה) 2 – 6 בעוד TACs משתמש זרם חשמלי משתנה מיושם בכלתדירות 7 ספציפית. גירוי רעש Transcranial אקראית (tRNS) הוא צורה מיוחדת של TACs המשתמשת זרם חשמלי משתנה להחיל בתדרים אקראי (למשל., 100-640 הרץ) וכתוצאה מכך עוצמות גירוי משתנים במהירות הסרת 4,6,7 תופעות הקשורות קוטביות. קוטביות היא רק של הרלוונטיות אם הגדרת הגירוי כולל גירוי אופסט, למשל, ספקטרום רעש אקראי שינוי סביב עוצמת בסיס +1 mA (בדרך כלל לא בשימוש). לצורך המאמר זה, נתמקד עבודה באמצעות tDCS ואפקטי tRNS על המערכת המוטורית, מקרוב כהמשך לפרסום אחרון מהמעבדה שלנו 6.
המנגנונים שבבסיס פעולה של tRNS הם אפילו פחות מובנים יותר של tDCS אבל כנראה שונה מן אחרון. באופן תיאורטי, במסגרת המושגית של תהודת סטוכסטיים tRNS מכניסה רעש מושרה-גירוי למערכת עצבית אשר עשוי לספק תועלת עיבוד אותות על ידי שינוי האות לרעש דואר יחס 4,8,9. TRNS עשוי בעיקר להגביר אותות חלשים ובכך יכול לייעל את פעילות מוח ספציפי משימה (רעש אנדוגני 9). Anodal tDCS מגדילה רגישה קליפת מוח שמציין שינוי של קצב הירי העצבי הספונטני 10 או מנוע מוגבר עורר פוטנציאל (MEP) אמפליטודות 2 עם האפקטים להאריך ימי משך הגירוי עבור כמה דקות לכמה שעות. עליות ארוכות טווח יעילות הסינפטית המכונית הגברה לטווח ארוכה הם חשבו לתרום למידה וזיכרון. ואכן, anodal tDCS משפר יעילות הסינפטית של סינפסות התנועה בקליפת המוח מופעל שוב ושוב על ידי קלט סינפטי חלש 11. בהתאם, תפקוד מוטורי שיפור / רכישת מיומנות לעתים קרובות מתגלה רק אם גירוי הוא שיתוף מיושם עם אימון מנוע 11 – 13, גם דבר המצביע על שיתוף הפעלה הסינפטי כתנאי מוקדם של תהליך הפעילות תלויה זה. אף על פי כן, סיבתיות בין עליות גרגישות ortical (עלייה בקצב ירי או משרעת MEP) מחד והיעילות הסינפטי משופרת (LTP או פונקציה התנהגותיות כמו למידה מוטורית) ומצד שני לא הודגמה.
NEBS מוחל על הקורטקס המוטורי הראשוני (M1) משכה התעניינות גוברת כמו שיטה יעילה ובטוחה לווסת פונקציה 1 המנוע האנושי. תופעות נוירופיזיולוגיים תוצאת התנהגות יכולות להיות תלויות אסטרטגית הגירוי (למשל, קוטביות tDCS או tRNS), גודל האלקטרודה מונטאז 4 – 6,14,15. מלבד גורמים אנטומיים ופיסיולוגיים נושא-טמון מונטאז האלקטרודה משפיע משמעותי הפצת שדה חשמלית עלול לגרום דפוסים שונים של זרם מתפשטים בתוך הקליפה 16 – 18. בנוסף לעוצמת להחיל הנוכחי בגודל של אלקטרודות קובע את צפיפות זרם נמסר 3. מצרפי אלקטרודה נפוצהמחקרי מערכת המנוע אנושי כוללים (איור 1): 1) anodal tDCS כמו גירוי חד-צדדי M1 עם האנודה ממוקם על M1 ריבית לבין הקתודה ממוקמת על המצח הנגדי; הרעיון הבסיסי של גישה זו היא גברת ביטוי של הרגישות של M1 של עניין 6,13,19 – 22; 2) anodal tDCS כמו גירוי דו צדדי M1 (המכונה גם "bihemispheric" או "כפולה" גירוי) עם האנודה ממוקם על M1 ריבית לבין הקתודה ממוקם על M1 הנגדי 5,6,14,23,24; הרעיון הבסיסי של גישה זו הוא למקסם הטבות גירוי על ידי גברת ביטוי של הרגישות של M1 של עניין תוך downregulating רגיש ב M1 ההפוך (כלומר, אפנון של עיכוב המיספרי בין השניים M1s); 3) עבור tRNS, רק מונטאז גירוי M1 חד-צדדית הנ"ל כבר investigated 4,6; עם רגישות מונטאז זה שיפור ההשפעות של tRNS נמצאו עבור ספקטרום התדרים של 100-640 הרץ 4. הבחירה של אסטרטגית גירוי המוח מונטאז אלקטרודה מייצגת שלב קריטי עבור שימוש יעיל והאמין של NEBS במסגרות קליני או מחקר. הנה שלושה הליכי NEBS מתוארים בפירוט כפי שמוצג במחקרי מערכת מנוע אנושי והיבטי מתודולוגיים מושגית נדונים. חומרים עבור tDCS חד-צדדית או דו-צדדיות tRNS חד-צדדית זהים (איור 2).
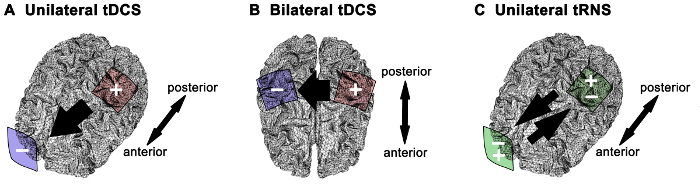
איור 1. מצרפי אלקטרודה והכיוון הנוכחי לאסטרטגיות NEBS ברורים. (א) גירוי זרם ישר transcranial חד-צדדית anodal (tDCS), האנודה מתמקדת מעל הקורטקס המוטורי הראשוני של ריבית הקתודה ממוקם מעל tהוא נגדי באזור העל-מסלולית. (ב) גירוי דו צדדי הקורטקס המוטורי, האנודה ואת הקתודה ממוקמים בכל רחבי הקורטקס המוטורי אחד. עמדת האנודה קובע את הקורטקס המוטורי של ריבית עבור tDCS anodal. (ג) גירוי רעש אקראי חד-צדדי transcranial (tRNS), אלקטרודה אחד ממוקם מעל הקורטקס המוטורי ואת האלקטרודה האחר על פני שטח על-מסלולית הנגדי. תזרים הזרם בין האלקטרודות הוא מצוין על ידי חץ השחור. האנודה (+, אדום), קטודה (-, כחול), זרם חילופין (+/-, ירוק). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
Representative Results
Discussion
פרוטוקול זה מתאר חומרים טיפוסיים צעדים פרוצדורליים עבור אפנון של תפקוד מוטורי יד ומיומנות למידה באמצעות NEBS, גירוי חד-צדדי ודו-צדדי M1 במיוחד עבור anodal tDCS, ו tRNS חד-צדדי. לפני בחירת פרוטוקול NEBS מסוים למחקר מערכת מנוע אנושי, למשל., בהקשר של למידה מוטורית, היבטים מתודול?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
MC ו- JR נתמכים על ידי קרן המחקר הגרמנית (DFG RE 2740 / 3-1).
Materials
| NEBS device (DC Stimulator plus) | Neuroconn | ||
| Electrode cables | Neuroconn | ||
| Conductive-rubber electrodes | Neuroconn | 5×5 cm | |
| Perforated sponge bags | Neuroconn | 5×5 cm | |
| Non-conductive rubber sponge cover | Amrex-Zetron | FG-02-A103 | Rubber pad 3"*3" |
| NaCl isotonic solution | B. Braun Melsungen AG | A1151 | Ecoflac, 0,9% |
| Cotton crepe bandage | Paul Hartmann AG | 931004 | 8x5m, textile elasticity |
| Adhesive tape (Leukofix) | BSN medical | 02122-00 | 2,5cm*5m |
| Skin preparation paste | Weaver | 10-30 | |
| Magnetic stimulator | Magstim | 3010-00 | Magstim 200 |
| EMG conductive paste | GE Medical Systems | 217083 | |
| EMG bipolar electrodes | e.g., Natus Medical Inc. Viking 4 | ||
| EMG amplifier | e.g., Natus Medical Inc. Viking 4 | ||
| Cable for EMG signal transmission | e.g., Natus Medical Inc. Viking 4 | ||
| Data acquisition unit | Cambridge Electronic Design (CED) | MK1401-3 | AD converter |
| Computer for signal recording and offline analysis | |||
| Signal 4.0.9 | Cambridge Electronic Design (CED) | Software | |
| non-permanent skin marker | Edding | 8020 | 1 mm, blue |
References
- Reis, J., Fritsch, B. Modulation of motor performance and motor learning by transcranial direct current stimulation. Curr Opin Neurol. 24 (6), 590-596 (2011).
- Nitsche, M., Paulus, W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol. 527 (3), 633-639 (2000).
- Nitsche, M. A., Cohen, L. G., et al. Transcranial direct current stimulation: State of the art. Brain Stimul. 1 (3), 206-223 (2008).
- Terney, D., Chaieb, L., Moliadze, V., Antal, A., Paulus, W. Increasing human brain excitability by transcranial high-frequency random noise stimulation. J Neurosci. 28 (52), 14147-14155 (2008).
- Kidgell, D. J., Goodwill, A. M., Frazer, A. K., Daly, R. M. Induction of cortical plasticity and improved motor performance following unilateral and bilateral transcranial direct current stimulation of the primary motor cortex. BMC Neurosci. 14 (1), 64 (2013).
- Prichard, G., Weiller, C., Fritsch, B., Reis, J. Brain Stimulation Effects of Different Electrical Brain Stimulation Protocols on Subcomponents of Motor Skill Learning. Brain Stimul. 7 (4), 532-540 (2014).
- Antal, A., Paulus, W., Hunter, M. A. Transcranial alternating current stimulation ( tACS ). Front Hum Neurosci. 7, 1-4 (2013).
- Collins, J. J., Chow, C. C., Imhoff, T. T. Stochastic resonance without tuning. Nature. 376 (6537), 236-238 (1995).
- Miniussi, C., Harris, J. A., Ruzzoli, M. Modelling non-invasive brain stimulation in cognitive neuroscience. Neurosci Biobehav Rev. 37 (8), 1702-1712 (2013).
- Bindman, L. J., Lippold, O. C., Redfearn, J. W. the Action of Brief Polarizing Currents on the Cerebral Cortex of the Rat (1) During Current Flow and (2) in the Production of Long-Lasting After-Effects. J Physiol. 172, 369-382 (1964).
- Fritsch, B., Reis, J., et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: Potential implications for motor learning. Neuron. 66 (2), 198-204 (2010).
- Galea, J. M., Celnik, P. Brain polarization enhances the formation and retention of motor memories. J Neurophysiol. 102 (1), 294-301 (2009).
- Reis, J., Fischer, J. T., Prichard, G., Weiller, C., Cohen, L. G., Fritsch, B. Time- but Not Sleep-Dependent Consolidation of tDCS-Enhanced Visuomotor Skills. Cereb Cortex. (1), 1-9 (2013).
- Saiote, C., Turi, Z., Paulus, W., Antal, A. Combining functional magnetic resonance imaging with transcranial electrical stimulation. Front Hum Neurosci. 7 (8), 435 (2013).
- Sehm, B., Kipping, J., Schäfer, A., Villringer, A., Ragert, P. A Comparison between Uni- and Bilateral tDCS Effects on Functional Connectivity of the Human Motor Cortex. Front Hum Neurosci Neurosci. 7 (4), 183 (2013).
- Moliadze, V., Antal, A., Paulus, W. Electrode-distance dependent after-effects of transcranial direct and random noise stimulation with extracephalic reference electrodes. Clin Neurophysiol. 121 (12), 2165-2171 (2010).
- Bikson, M., Rahman, a., Datta, a. Computational Models of Transcranial Direct Current Stimulation. Clin EEG Neurosci. 43 (3), 176-183 (2012).
- Opitz, A., Paulus, W., Will, A., Thielscher, A. Determinants of the electric field during transcranial direct current stimulation. Neuroimage. 109, 140-150 (2015).
- Nitsche, M., Paulus, W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans. Neurology. 57 (10), 1899-1901 (2001).
- Reis, J., Schambra, H. M., et al. Noninvasive cortical stimulation enhances motor skill acquisition over multiple days through an effect on consolidation. Proc Natl Acad Sci U S A. 106 (5), 1590-1595 (2009).
- Batsikadze, G., Moliadze, V., Paulus, W., Kuo, M. -. F., Nitsche, M. a Partially non-linear stimulation intensity-dependent effects of direct current stimulation on motor cortex excitability in humans. J Physiol. 591 (7), 1987-2000 (2013).
- Wiethoff, S., Hamada, M., Rothwell, J. C. Variability in response to transcranial direct current stimulation of the motor cortex. Brain Stimul. 7 (3), 468-475 (2014).
- Mordillo-Mateos, L., Turpin-Fenoll, L., et al. Effects of simultaneous bilateral tDCS of the human motor cortex. Brain Stimul. 5 (3), 214-222 (2012).
- Tazoe, T., Endoh, T., Kitamura, T., Ogata, T. Polarity Specific Effects of Transcranial Direct Current Stimulation on Interhemispheric Inhibition. PLoS One. 9 (12), e114244 (2014).
- Keel, J. C., Smith, M. J., Wassermann, E. M. A safety screening questionnaire for transcranial magnetic stimulation. Clin Neurophysiol. 112, 720 (2000).
- Villamar, M. F., Volz, M. S., Bikson, M., Datta, A., Dasilva, A. F., Fregni, F. Technique and considerations in the use of 4×1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309 (2013).
- Brasil-Neto, J. P., Cohen, L. G., Panizza, M., Nilsson, J., Roth, B. J., Hallett, M. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J Clin Neurophysiol. 9 (1), 132-136 (1992).
- Mills, K., Boniface, S., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalogr Clin Neurophysiol. 85 (1), 17-21 (1992).
- Rothwell, J., Hallett, M., Berardelli, A., Eisen, A., Rossini, P., Paulus, W. Magnetic stimulation motor evoked potentials. Electroencephalogr Clin Neurophysiol Suppl. 52, 97-103 (1999).
- Ueno, S., Tashiro, T., Harada, K. Localized stimulation of neural tissues in the brain by means of a paired configuration of time-varying magnetic fields. J Appl Phys. 64 (10), 5862-5864 (1988).
- Fleming, M. K., Sorinola, I. O., Newham, D. J., Roberts-Lewis, S. F., Bergmann, J. H. M. The effect of coil type and navigation on the reliability of transcranial magnetic stimulation. IEEE Trans Neural Syst Rehabil Eng. 20 (5), 617-625 (2012).
- Brunoni, A. R., Amadera, J., Berbel, B., Volz, M. S., Rizzerio, B. G., Fregni, F. A systematic review on reporting and assessment of adverse effects associated with transcranial direct current stimulation. Int J Neuropsychopharmacol. 14 (8), 1133-1145 (2011).
- Palm, U., Reisinger, E., et al. Brain Stimulation Evaluation of Sham Transcranial Direct Current Stimulation for Randomized, Placebo-Controlled Clinical Trials. Brain Stimul. 6 (4), 690-695 (2013).
- Sehm, B., Schäfer, A., et al. Dynamic modulation of intrinsic functional connectivity by transcranial direct current stimulation. J Neurophysiol. 108 (12), 3253-3263 (2012).
- Nitsche, M. A., Schauenburg, A., et al. Facilitation of implicit motor learning by weak transcranial direct current stimulation of the primary motor cortex in the human. J Cogn Neurosci. 15 (4), 619-626 (2003).
- Antal, A., Begemeier, S., Nitsche, M. A., Paulus, W. Prior state of cortical activity influences subsequent practicing of a visuomotor coordination task. Neuropsychologia. 46 (13), 3157-3161 (2008).
- Kang, E. K., Paik, N. J. Effect of a tDCS electrode montage on implicit motor sequence learning in healthy subjects. Exp Transl Stroke Med. 3 (1), 4 (2011).
- Kantak, S. S., Mummidisetty, C. K., Stinear, J. W. Primary motor and premotor cortex in implicit sequence learning – Evidence for competition between implicit and explicit human motor memory systems. Eur J Neurosci. 36 (5), 2710-2715 (2012).
- Nissen, M. J., Bullemer, P. Attentional requirements of learning: Evidence from performance measures. Cogn Psychol. 19 (1), 1-32 (1987).
- Stagg, C. J., Jayaram, G., Pastor, D., Kincses, Z. T., Matthews, P. M., Johansen-berg, H. Polarity and timing-dependent effects of transcranial direct current stimulation in explicit motor learning. Neuropsychologia. 49 (5), 800-804 (2011).
- Poreisz, C., Boros, K., Antal, A., Paulus, W. Safety aspects of transcranial direct current stimulation concerning healthy subjects and patients. Brain Res Bull. 72 (4-6), 208-214 (2007).
- Gandiga, P. C., Hummel, F. C., Cohen, L. G. Transcranial DC stimulation (tDCS): a tool for double-blind sham-controlled clinical studies in brain stimulation. Clin Neurophysiol. 117 (4), 845-850 (2006).
- Baudewig, J., Nitsche, M. A., Paulus, W., Frahm, J. Regional modulation of BOLD MRI responses to human sensorimotor activation by transcranial direct current stimulation. Magn Reson Med. 45 (2), 196-201 (2001).
- Venkatakrishnan, A., Sandrini, M. Combining transcranial direct current stimulation and neuroimaging: novel insights in understanding neuroplasticity. J Neurophysiol. 107 (1), 1-4 (2012).
- Neuling, T., Wagner, S., Wolters, C. H., Zaehle, T., Herrmann, C. S. Finite-element model predicts current density distribution for clinical applications of tDCS and tACS. Frontiers in Psychiatry. 3, 1-10 (2012).
- Bikson, M., Rahman, A. Origins of specificity during tDCS anatomical, activity-selective, and input-bias mechanisms. Front Hum Neurosci. 7, 1-5 (2013).
- Truong, D. Q., Hüber, M., et al. Brain Stimulation Clinician Accessible Tools for GUI Computational Models of Transcranial Electrical Stimulation BONSAI and SPHERES. Brain Stimul. 7 (4), 521-524 (2014).
- Caparelli-Daquer, E. M., Zimmermann, T. J., et al. A Pilot Study on Effects of 4×1 High-Definition tDCS on Motor Cortex Excitability. Proc Annu Int Conf IEEE Eng Med Biol Soc EMBS. , 735-738 (2012).
- Kuo, H. I., Bikson, M., et al. Comparing cortical plasticity induced by conventional and high-definition 4 x 1 ring tDCS: A neurophysiological study. Brain Stimul. 6 (4), 644-648 (2013).

