人間の運動機能の調節のための非侵襲的電気脳刺激モンタージュ
Summary
非侵襲的電気脳刺激は、両方の研究および臨床目的のために、皮質機能と動作を調節することができます。このプロトコルは、人間の運動系の調節のための異なる脳刺激的なアプローチについて説明します。
Abstract
非侵襲性の電気脳刺激(NEBS)は、両方の研究及び臨床目的のために、脳の機能と動作を調節するために使用されます。具体的には、NEBSは経頭蓋どちら直流刺激(TDCの)または交流電流刺激(TACS)として適用することができます。これらの刺激の種類は、タイムを発揮する用量と運動機能と健常者における学習スキルにTDCの極性特異的効果の場合インチ最近、TDCのストロークまたは運動障害を有する患者における運動障害の治療を増強するために使用されています。この記事では、TDCのと経頭蓋ランダムノイズ刺激(TRNS)で一次運動野を標的化するためのステップバイステップのプロトコル、事前定義された周波数範囲内でランダムに印加された電流を使用してTACSの具体的な形態を提供します。二つの異なる刺激モンタージュのセットアップについて説明します。両方のモンタージュで放出電極(TDCのためのアノード)は、目的の一次運動野に配置されています。ために片側運動皮質刺激両側性運動皮質の刺激のための受信電極が反対一次運動皮質上に配置されている間、受信電極対額上に配置されます。利点と皮質興奮性や学習などの運動機能を調節するための各モンタージュの欠点は、同様に安全性、忍容性および盲目の側面として、議論されています。
Introduction
3 -非侵襲的な電気脳刺激(NEBS)、無傷の頭蓋骨を通して脳への電気電流の投与は、脳機能と動作1を変更することができます 。神経生理学的および行動効果につながる基礎となるメカニズムを理解NEBS戦略の治療可能性を最適化するにはまだ必要とされています。異なる研究所間でのアプリケーションと刺激手順の完全な透明性の標準化は、アクションの提案メカニズムの結果、評価の信頼性の高い解釈をサポートするデータの比較のための基礎を提供します。経頭蓋直流電流刺激(TDCは)または経頭蓋電流刺激を交互に(TACS)印加された電流のパラメータによって異なりますTDCのは、2つの電極(アノードとカソード)2との間に一方向の定電流の流れで構成されています- TACSは交流電流の印加を使用しながら6に特定の周波数7。経頭蓋ランダムノイズ刺激(TRNS)ランダム周波数( 例えば 、100から640 Hz)で迅速に変化する刺激強度をもたらし、極性による影響4,6,7の除去に印加される交流電流を使用TACSの特殊な形式です。刺激の設定は、 例えば 、ランダムに1ミリアンペアのベースライン強度(通常は使用しません)の周りに変化するノイズスペクトルをオフセット刺激が含まれている場合極性は関連性があります。この記事の目的のために、我々は密接に私たちの研究室6からの最近の発表後、モータシステム上のTDCとTRNSエフェクトを使って作業に焦点を当てます。
TRNSの行動の根底にあるメカニズムは、それ以下のTDCのより理解が、後者の可能性が異なるされています。理論的には、確率共鳴TRNSの概念的枠組みに番目を変更することによって、信号処理の利点を提供することができる神経系への刺激によって誘導されるノイズを導入電子信号対雑音比4,8,9。 TRNSは主に弱い信号を増幅することができるので、タスク固有の脳活動(内因性のノイズ9)を最適化することができます。陽極TDCのは、数分から数時間のための刺激の持続時間をoutlasting効果と皮質の興奮性(MEP)自発的なニューロンの発火率10の変化によって示されるまたは増加モータが誘発電位振幅2を増加させます 。長期増強として知られているシナプスの有効性の長期的な増加は、学習と記憶に貢献すると考えられています。確かに、陽極TDCの繰り返し弱いシナプス入力11によって活性化され、モータ皮質のシナプスのシナプス伝達効率を向上させます。また、この活動依存プロセスの前提条件として、シナプスの同時活性化を示唆し、13 –よれば、改善された運動機能/スキルの獲得は、多くの場合、刺激が運動トレーニング11と同時適用の場合にのみ明らかにされています。それにもかかわらず、Cの増加との間に因果関係ortical興奮一方で(発火率またはMEP振幅の増加)と改善されたシナプス効力一方(LTPまたはそのような運動学習としての行動機能)が実証されていません。
NEBSは人間の運動機能1を調節するために安全かつ効果的な方法として関心が高まっを集めている一次運動野(M1)に適用されます。 6,14,15 –神経生理学的効果と行動の結果は、刺激戦略( 例えば 、TDCの極性またはTRNS)、電極の大きさとモンタージュ4に依存してもよいです。別に被験者固有の解剖学的および生理的要因から電極モンタージュを大幅電界分布に影響を及ぼし、皮質16内の電流拡散の異なるパターンをもたらすことができる– 18。電極の印加電流の大きさの強さに加えて3供給される電流密度を決定します。共通電極モンタージュ人間のモータでは、システムの研究は、( 図1)を含む :1)陽極TDCの関心のM1と反対側の額に位置するカソード上に位置するアノードとの一方的なM1刺激として;このアプローチの基本的な考え方は、関心6,13,19のM1における興奮性のアップレギュレーションである– 22; 2)陽極TDCの二国間のM1刺激 (また、目的のM1および対M1 5,6,14,23,24に位置するカソード上に位置するアノードとの)「bihemispheric」または「デュアル」刺激と呼ばれます。このアプローチの基本的な考え方は、反対M1に興奮をダウンレギュレートしながら、興味のあるM1に興奮のアップレギュレーションによる刺激のメリットを最大化である( すなわち 、2 M1S間の半球間抑制の変調)。 3)TRNSについては、唯一の上記の一方的なM1刺激モンタージュはinvestigされましたated 4,6;このモンタージュの興奮とTRNSの強化効果は100から640ヘルツ4の周波数スペクトルのために発見されています。脳刺激戦略と電極モンタージュの選択は、臨床や研究の設定でNEBSの効率的かつ信頼性のある使用のための重要なステップを表します。ヒト運動系の研究で使用され、方法論及び概念的態様が説明されているように、ここでこれら三つのNEBS手順が詳細に記載されています。片側性または両側のTDCと一方的TRNSのための材料は、( 図2)と同じです。
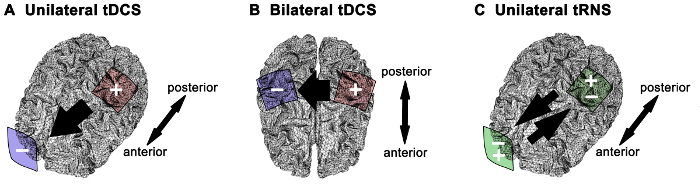
明確なNEBS戦略の図1.電極モンタージュと電流方向。(A)一方的な陽極経頭蓋直流電流刺激(TDCは)のためには、アノードは、興味のある一次運動野とトンの上に位置するカソードの上に中心があります彼は超軌道面積を反対側。両側性運動皮質刺激のための(B)は 、陽極と陰極は、1つの運動皮質の上にそれぞれ配置されています。陽極の位置は、陽極TDCのための目的の運動野を決定します。一方的な経頭蓋ランダムノイズ刺激(TRNS)について(C)は 、一方の電極が運動野と反対側の上記軌道領域の上に他の電極上に配置されています。電極間の電流の流れを黒矢印で示されています。陽極(+、赤)、カソード-交互(青)、(+/-、緑)現在。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
このプロトコルは、手の運動機能やスキルNEBS、陽極TDCは、と一方的TRNSに特に一方的及び二国間のM1刺激を用いた学習の調節のための典型的な材料や処理手順を説明します。人間の運動系の研究のために特定のNEBSプロトコルを選択する前に、 例えば 、運動学習、方法論的な側面(安全性、忍容性、盲検化)だけでなく、概念的態様(特に脳領域上のモンタージュや現在のタイプ特…
Disclosures
The authors have nothing to disclose.
Acknowledgements
MCとJRは、ドイツ研究協会(DFG RE 2740 / 3-1)でサポートされています。
Materials
| NEBS device (DC Stimulator plus) | Neuroconn | ||
| Electrode cables | Neuroconn | ||
| Conductive-rubber electrodes | Neuroconn | 5×5 cm | |
| Perforated sponge bags | Neuroconn | 5×5 cm | |
| Non-conductive rubber sponge cover | Amrex-Zetron | FG-02-A103 | Rubber pad 3"*3" |
| NaCl isotonic solution | B. Braun Melsungen AG | A1151 | Ecoflac, 0,9% |
| Cotton crepe bandage | Paul Hartmann AG | 931004 | 8x5m, textile elasticity |
| Adhesive tape (Leukofix) | BSN medical | 02122-00 | 2,5cm*5m |
| Skin preparation paste | Weaver | 10-30 | |
| Magnetic stimulator | Magstim | 3010-00 | Magstim 200 |
| EMG conductive paste | GE Medical Systems | 217083 | |
| EMG bipolar electrodes | e.g., Natus Medical Inc. Viking 4 | ||
| EMG amplifier | e.g., Natus Medical Inc. Viking 4 | ||
| Cable for EMG signal transmission | e.g., Natus Medical Inc. Viking 4 | ||
| Data acquisition unit | Cambridge Electronic Design (CED) | MK1401-3 | AD converter |
| Computer for signal recording and offline analysis | |||
| Signal 4.0.9 | Cambridge Electronic Design (CED) | Software | |
| non-permanent skin marker | Edding | 8020 | 1 mm, blue |
References
- Reis, J., Fritsch, B. Modulation of motor performance and motor learning by transcranial direct current stimulation. Curr Opin Neurol. 24 (6), 590-596 (2011).
- Nitsche, M., Paulus, W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol. 527 (3), 633-639 (2000).
- Nitsche, M. A., Cohen, L. G., et al. Transcranial direct current stimulation: State of the art. Brain Stimul. 1 (3), 206-223 (2008).
- Terney, D., Chaieb, L., Moliadze, V., Antal, A., Paulus, W. Increasing human brain excitability by transcranial high-frequency random noise stimulation. J Neurosci. 28 (52), 14147-14155 (2008).
- Kidgell, D. J., Goodwill, A. M., Frazer, A. K., Daly, R. M. Induction of cortical plasticity and improved motor performance following unilateral and bilateral transcranial direct current stimulation of the primary motor cortex. BMC Neurosci. 14 (1), 64 (2013).
- Prichard, G., Weiller, C., Fritsch, B., Reis, J. Brain Stimulation Effects of Different Electrical Brain Stimulation Protocols on Subcomponents of Motor Skill Learning. Brain Stimul. 7 (4), 532-540 (2014).
- Antal, A., Paulus, W., Hunter, M. A. Transcranial alternating current stimulation ( tACS ). Front Hum Neurosci. 7, 1-4 (2013).
- Collins, J. J., Chow, C. C., Imhoff, T. T. Stochastic resonance without tuning. Nature. 376 (6537), 236-238 (1995).
- Miniussi, C., Harris, J. A., Ruzzoli, M. Modelling non-invasive brain stimulation in cognitive neuroscience. Neurosci Biobehav Rev. 37 (8), 1702-1712 (2013).
- Bindman, L. J., Lippold, O. C., Redfearn, J. W. the Action of Brief Polarizing Currents on the Cerebral Cortex of the Rat (1) During Current Flow and (2) in the Production of Long-Lasting After-Effects. J Physiol. 172, 369-382 (1964).
- Fritsch, B., Reis, J., et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: Potential implications for motor learning. Neuron. 66 (2), 198-204 (2010).
- Galea, J. M., Celnik, P. Brain polarization enhances the formation and retention of motor memories. J Neurophysiol. 102 (1), 294-301 (2009).
- Reis, J., Fischer, J. T., Prichard, G., Weiller, C., Cohen, L. G., Fritsch, B. Time- but Not Sleep-Dependent Consolidation of tDCS-Enhanced Visuomotor Skills. Cereb Cortex. (1), 1-9 (2013).
- Saiote, C., Turi, Z., Paulus, W., Antal, A. Combining functional magnetic resonance imaging with transcranial electrical stimulation. Front Hum Neurosci. 7 (8), 435 (2013).
- Sehm, B., Kipping, J., Schäfer, A., Villringer, A., Ragert, P. A Comparison between Uni- and Bilateral tDCS Effects on Functional Connectivity of the Human Motor Cortex. Front Hum Neurosci Neurosci. 7 (4), 183 (2013).
- Moliadze, V., Antal, A., Paulus, W. Electrode-distance dependent after-effects of transcranial direct and random noise stimulation with extracephalic reference electrodes. Clin Neurophysiol. 121 (12), 2165-2171 (2010).
- Bikson, M., Rahman, a., Datta, a. Computational Models of Transcranial Direct Current Stimulation. Clin EEG Neurosci. 43 (3), 176-183 (2012).
- Opitz, A., Paulus, W., Will, A., Thielscher, A. Determinants of the electric field during transcranial direct current stimulation. Neuroimage. 109, 140-150 (2015).
- Nitsche, M., Paulus, W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans. Neurology. 57 (10), 1899-1901 (2001).
- Reis, J., Schambra, H. M., et al. Noninvasive cortical stimulation enhances motor skill acquisition over multiple days through an effect on consolidation. Proc Natl Acad Sci U S A. 106 (5), 1590-1595 (2009).
- Batsikadze, G., Moliadze, V., Paulus, W., Kuo, M. -. F., Nitsche, M. a Partially non-linear stimulation intensity-dependent effects of direct current stimulation on motor cortex excitability in humans. J Physiol. 591 (7), 1987-2000 (2013).
- Wiethoff, S., Hamada, M., Rothwell, J. C. Variability in response to transcranial direct current stimulation of the motor cortex. Brain Stimul. 7 (3), 468-475 (2014).
- Mordillo-Mateos, L., Turpin-Fenoll, L., et al. Effects of simultaneous bilateral tDCS of the human motor cortex. Brain Stimul. 5 (3), 214-222 (2012).
- Tazoe, T., Endoh, T., Kitamura, T., Ogata, T. Polarity Specific Effects of Transcranial Direct Current Stimulation on Interhemispheric Inhibition. PLoS One. 9 (12), e114244 (2014).
- Keel, J. C., Smith, M. J., Wassermann, E. M. A safety screening questionnaire for transcranial magnetic stimulation. Clin Neurophysiol. 112, 720 (2000).
- Villamar, M. F., Volz, M. S., Bikson, M., Datta, A., Dasilva, A. F., Fregni, F. Technique and considerations in the use of 4×1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309 (2013).
- Brasil-Neto, J. P., Cohen, L. G., Panizza, M., Nilsson, J., Roth, B. J., Hallett, M. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J Clin Neurophysiol. 9 (1), 132-136 (1992).
- Mills, K., Boniface, S., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalogr Clin Neurophysiol. 85 (1), 17-21 (1992).
- Rothwell, J., Hallett, M., Berardelli, A., Eisen, A., Rossini, P., Paulus, W. Magnetic stimulation motor evoked potentials. Electroencephalogr Clin Neurophysiol Suppl. 52, 97-103 (1999).
- Ueno, S., Tashiro, T., Harada, K. Localized stimulation of neural tissues in the brain by means of a paired configuration of time-varying magnetic fields. J Appl Phys. 64 (10), 5862-5864 (1988).
- Fleming, M. K., Sorinola, I. O., Newham, D. J., Roberts-Lewis, S. F., Bergmann, J. H. M. The effect of coil type and navigation on the reliability of transcranial magnetic stimulation. IEEE Trans Neural Syst Rehabil Eng. 20 (5), 617-625 (2012).
- Brunoni, A. R., Amadera, J., Berbel, B., Volz, M. S., Rizzerio, B. G., Fregni, F. A systematic review on reporting and assessment of adverse effects associated with transcranial direct current stimulation. Int J Neuropsychopharmacol. 14 (8), 1133-1145 (2011).
- Palm, U., Reisinger, E., et al. Brain Stimulation Evaluation of Sham Transcranial Direct Current Stimulation for Randomized, Placebo-Controlled Clinical Trials. Brain Stimul. 6 (4), 690-695 (2013).
- Sehm, B., Schäfer, A., et al. Dynamic modulation of intrinsic functional connectivity by transcranial direct current stimulation. J Neurophysiol. 108 (12), 3253-3263 (2012).
- Nitsche, M. A., Schauenburg, A., et al. Facilitation of implicit motor learning by weak transcranial direct current stimulation of the primary motor cortex in the human. J Cogn Neurosci. 15 (4), 619-626 (2003).
- Antal, A., Begemeier, S., Nitsche, M. A., Paulus, W. Prior state of cortical activity influences subsequent practicing of a visuomotor coordination task. Neuropsychologia. 46 (13), 3157-3161 (2008).
- Kang, E. K., Paik, N. J. Effect of a tDCS electrode montage on implicit motor sequence learning in healthy subjects. Exp Transl Stroke Med. 3 (1), 4 (2011).
- Kantak, S. S., Mummidisetty, C. K., Stinear, J. W. Primary motor and premotor cortex in implicit sequence learning – Evidence for competition between implicit and explicit human motor memory systems. Eur J Neurosci. 36 (5), 2710-2715 (2012).
- Nissen, M. J., Bullemer, P. Attentional requirements of learning: Evidence from performance measures. Cogn Psychol. 19 (1), 1-32 (1987).
- Stagg, C. J., Jayaram, G., Pastor, D., Kincses, Z. T., Matthews, P. M., Johansen-berg, H. Polarity and timing-dependent effects of transcranial direct current stimulation in explicit motor learning. Neuropsychologia. 49 (5), 800-804 (2011).
- Poreisz, C., Boros, K., Antal, A., Paulus, W. Safety aspects of transcranial direct current stimulation concerning healthy subjects and patients. Brain Res Bull. 72 (4-6), 208-214 (2007).
- Gandiga, P. C., Hummel, F. C., Cohen, L. G. Transcranial DC stimulation (tDCS): a tool for double-blind sham-controlled clinical studies in brain stimulation. Clin Neurophysiol. 117 (4), 845-850 (2006).
- Baudewig, J., Nitsche, M. A., Paulus, W., Frahm, J. Regional modulation of BOLD MRI responses to human sensorimotor activation by transcranial direct current stimulation. Magn Reson Med. 45 (2), 196-201 (2001).
- Venkatakrishnan, A., Sandrini, M. Combining transcranial direct current stimulation and neuroimaging: novel insights in understanding neuroplasticity. J Neurophysiol. 107 (1), 1-4 (2012).
- Neuling, T., Wagner, S., Wolters, C. H., Zaehle, T., Herrmann, C. S. Finite-element model predicts current density distribution for clinical applications of tDCS and tACS. Frontiers in Psychiatry. 3, 1-10 (2012).
- Bikson, M., Rahman, A. Origins of specificity during tDCS anatomical, activity-selective, and input-bias mechanisms. Front Hum Neurosci. 7, 1-5 (2013).
- Truong, D. Q., Hüber, M., et al. Brain Stimulation Clinician Accessible Tools for GUI Computational Models of Transcranial Electrical Stimulation BONSAI and SPHERES. Brain Stimul. 7 (4), 521-524 (2014).
- Caparelli-Daquer, E. M., Zimmermann, T. J., et al. A Pilot Study on Effects of 4×1 High-Definition tDCS on Motor Cortex Excitability. Proc Annu Int Conf IEEE Eng Med Biol Soc EMBS. , 735-738 (2012).
- Kuo, H. I., Bikson, M., et al. Comparing cortical plasticity induced by conventional and high-definition 4 x 1 ring tDCS: A neurophysiological study. Brain Stimul. 6 (4), 644-648 (2013).

