Fastsettelse av Zeta Potensielle via nanopartikkel trans Hastigheter gjennom en fleksibel membran nanopore: Ved hjelp av DNA-modifisert Partikler som et eksempel
Summary
Her benyttes en polyuretan avstembar nanopore integrert i en resistiv pulsføle teknikk for å karakterisere nanopartikler overflatekjemi via måling av partikkeltrans hastigheter, som kan brukes for å bestemme zeta-potensialet av individuelle nanopartikler.
Abstract
Nanopore teknologi, kjent under samle Resistive pulssensor (RPS), blir brukt til å påvise, kvantifisere og karakterisere proteiner, molekyler og nanopartikler. Fleksibel resistive puls sensing (trps) er en relativt ny tilpasning til RPS som inkorporerer en fleksibel pore som kan endres i sanntid. Her bruker vi trps å overvåke trans tider av DNA-modifiserte nanopartikler som de krysser den avstembare pore membranen som en funksjon av DNA-konsentrasjon og struktur (dvs. enkelt-trådet til dobbeltkjedet DNA).
Trps er basert på to Ag / AgCl-elektroder, atskilt av et elastomert pore membran som etablerer en stabil ionisk strøm på et påtrykt elektrisk felt. I motsetning til forskjellige optiske basert partikkel karakterisering teknologier kan trps karakterisere individuelle partikler blant et utvalg populasjon, slik at for multimodale prøver som skal analyseres med letthet. Her viser vi zeta potensialet målingervia partikkeltrans hastigheter på kjente standarder og bruke disse til å prøve analysetrans ganger, noe som resulterer i å måle zeta potensialet av disse analyttene.
I tillegg til å anskaffe gjennomsnitts Zeta potensielle verdier, er prøvene tatt målt ved hjelp av en partikkel-by-partikkelen perspektiv som viser mer informasjon om en gitt prøve gjennom prøvepopulasjonsfordelinger, for eksempel. Av slikt, demonstrerer denne metoden potensial innenfor sensing programmer for både medisinsk og miljømessige felt.
Introduction
Funksjonnanopartikler blir stadig mer populært som biosensorer i både medisinske og miljømessige felt. Muligheten til å forandre en nanopartikkel er overflatekjemi, med DNA, for eksempel, har vist seg nyttige for målrettet medikamentleveringssystemer 1 og overvåknings DNA-protein interaksjoner 2-4. En stadig vanligere nanopartikkel eiendommen blir brukt ved biologiske og i levering av legemiddel er superparamagnetisme 5. Superparamagnetiske partikler (SPPS) er ekstremt anvendbare for identifisering og fjerning av spesifikke analytter fra komplekse blandinger, og kan gjøre dette med enkle bruk av en enkelt magnet. Når den er fjernet, analytten bundne partikler kan karakteriseres og analyseres passer til formålet.
Tidligere metoder for påvisning og karakterisering av nanopartikler inkluderer optiske teknikker som dynamisk lysspredning (DLS), ellers kjent som fotonkorrelasjonsspektroskopi. Selv om en high gjennomstrømning teknikk blir DLS begrenset til å være en gjennomsnittsbasert teknikk, og ved analyse av multimodale prøver uten tilsetning av spesialprogramvare, vil de større partikler gir et mye mer dominant signal, slik at noen av de mindre partiklene helt ubemerket 6,7. Partikkel-for-partikkel-karakteriseringsteknikker er derfor mye mer fordelaktig å analysere nanopartikler og nanopartikkel funksjonaliserte systemer.
RPS baserte teknologier er basert rundt påføre et elektrisk felt til en prøve, og overvåkning av transportmekanismen av partiklene gjennom en syntetisk eller biologisk nanopore. En forholdsvis ny nanopartikkel påvisning og karakterisering teknikk basert på RPS er fleksibel resistive puls sensing (trps) 8-16. Trps er et to-elektrodesystem adskilt av en elastomer, fleksibel membran pore. En avstembar pore fremgangsmåte gjør det mulig for analytter av et utvalg av form 17 og størrelse som skal måles, via deres transportmekanismer gjennom pore. Avstembare porene har tidligere vært anvendt for påvisning av små partikler (70-95 nm diameter) fremstilling av sammenlignbare resultater til andre teknikker som for eksempel transmisjons-elektronspektroskopi (TEM) 10. Når et elektrisk felt påtrykkes, er en ionisk strøm observert og som partikler / molekyler passere gjennom porene, de midlertidig å blokkere pore, forårsaker en reduksjon av strømmen som kan defineres som en "blokade hendelse". Hver blokade arrangement er representativ for en enkelt partikkel, slik at hver partikkel i en prøve kan karakteriseres individuelt basert på blokaden størrelse, Δ 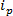 Og full bredde halvt maksimum, FWHM, så vel som andre egenskaper blokade. Analysere individuelle partiklene når de passerer gjennom en nanopore er fordelaktig for multimodale prøver som trps kan vellykket og effektivt skille mellom en rekke partikkelstørrelser AmonGST en enkelt prøve. Fleksibel resistive puls sensing fullstørrelse 10, Zeta potensielle 12,18 og konsentrasjon 15 målinger samtidig i ett enkelt løp, og kan derfor fortsatt skille prøver av lik, om ikke den samme størrelsen av deres overflateladning 19; en fordel over alternative dimensjonering teknikker.
Og full bredde halvt maksimum, FWHM, så vel som andre egenskaper blokade. Analysere individuelle partiklene når de passerer gjennom en nanopore er fordelaktig for multimodale prøver som trps kan vellykket og effektivt skille mellom en rekke partikkelstørrelser AmonGST en enkelt prøve. Fleksibel resistive puls sensing fullstørrelse 10, Zeta potensielle 12,18 og konsentrasjon 15 målinger samtidig i ett enkelt løp, og kan derfor fortsatt skille prøver av lik, om ikke den samme størrelsen av deres overflateladning 19; en fordel over alternative dimensjonering teknikker.
Zeta potensial er definert som det elektrostatiske potensial på planet av skjær 20, og beregnes ut fra partikkelhastigheter som de krysser en pore 19. Zeta potensial målinger av individuelle partikler gir dermed innsikt i trans mekanismer og oppførselen til nanopartikkel-systemer i løsningen, verdifull informasjon for fremtiden til nanopartikkel analyse design for en rekke bruksområder. Particle-by-partikkel analyse av en slik art gjør det også mulig for spredning og distribusjon av Zeta potensielle verdier blant et utvalg befolkningen til å bli utforsket, noe som åpner for mer informasjon on reaksjonskinetikk (enkelt-trådet til dobbeltkjedet DNA, for eksempel) og partikkel-stabiliteter i oppløsning som skal oppnås.
Her beskriver vi en teknikk som oppdager og karakteriserer både umodifiserte og DNA-modifisert SPP overflater. Protokollen er beskrevet heri kan anvendes på en rekke uorganiske og biologiske nanopartikler, men vi demonstrere fremgangsmåten ved bruk av DNA-modifiserte overflater på grunn av deres brede spekter av applikasjoner. Teknikken gjør det mulig for brukeren å skille mellom enkelt-trådede og dobbelt-trådede DNA mål på en nanopartikkel overflate, basert på partikkeltranshastigheter gjennom et poresystemet og dermed deres zeta-potensialer.
Protocol
Representative Results
Discussion
Beregningen for zeta potensialet brukt en kalibreringsbasert metode relatert til arbeid med Arjmandi et al. 21. Varigheten av translokasjon av partikler som de krysser et nanopore måles som en funksjon av påtrykt spenning, ved hjelp av en gjennomsnittlig elektriske felt og partikkelhastigheter over helheten av en vanlig konisk pore. Den elektroforetiske mobilitet er den deriverte av 1 / T (hvor T er varigheten blokaden) med hensyn til spenning, multiplisert med kvadratet av avfølingssonen le…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker Izon Science Ltd for deres støtte. Arbeidet ble støttet av EU-kommisjonen for forskning (PCIG11-GA-2012-321836 Nano4Bio).
Materials
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 mL deionised water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1E12 particles/mL, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2E19 C/nm^2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1E11 particles/mL. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCAC TACGCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences of DNA targets: Fully complementary – 5'GCCACGCGTAGTGAGGTTTAACCAT3', Middle binding – 5'GTAGTGAGGT3', End binding – 5'GTTTAACCAT3', Partially complementary overhanging – 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa, | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 1000 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).

