Определение дзета-потенциала через наночастицу транслокации через скоростей перестраиваемого нанопор: Использование ДНК-модифицированных частиц, как в примере
Summary
Здесь мы используем полиуретановые перестраиваемого нанопор интегрированный в резистивном метод импульсного зондирования для характеристики наночастиц химию поверхности с помощью измерения скоростей транслокации частиц, которые могут быть использованы для определения дзета-потенциала отдельных наночастиц.
Abstract
Нанопор технологии, известные под общим названием резистивные датчики импульсов (RPS), используются для обнаружения, количественного определения и характеристики белков, молекул и наночастиц. Настраиваемый резистивный импульса зондирования (TRPS) является относительно недавним адаптации к ПСТ, который включает в себя перестраиваемый поры, который может быть изменен в режиме реального времени. Здесь мы используем TRPS для контроля времени транслокации наночастиц ДНК-модифицированного , как они проходят перестраиваемый пор мембраны в зависимости от концентрации и структуры ДНК (то есть, одноцепочечную к двухцепочечной ДНК).
TRPS основана на двух электродов Ag / AgCl, разделенных эластомерного порами мембраны, устанавливающей стабильный ионный ток при приложенного электрического поля. В отличие от различных оптических технологий на основе определения свойств частиц, TRPS могут характеризовать отдельные частицы среди выборочной совокупности, что позволяет мультимодальные образцы для анализа с легкостью. Здесь мы покажем, дзета-потенциал измеренияс помощью транслокации частиц скоростей известных стандартов и применить их к образцу аналитов раз транслокация, таким образом, в результате чего измерения дзета-потенциала этих аналитов.
А также приобретение средних значений дзета-потенциал, образцы все измеряют с помощью частиц по-частицы перспективу, проявляющего больше информации о данном образце посредством распределения выборки населения, например. Из таких, этот метод демонстрирует потенциал внутри приложений зондирования для медицинских и экологических областях.
Introduction
Функционализированные наночастицы становятся все более популярными в качестве биосенсоров в медицинских и экологических областях. Способность изменять химию поверхности наночастицу, в ДНК, например, оказывается полезным для целевых систем доставки лекарственных средств 1 и мониторинга ДНК-белковых взаимодействий 2-4. Все более и более общее свойство наночастиц быть использованы в биопроб и в доставке терапевтических средств является Суперпарамагнетизм 5. Суперпарамагнитных частиц (SppS) являются чрезвычайно полезными для выявления и устранения конкретных аналитов из сложных смесей и может сделать это с помощью простого использования одного магнита. После удаления, анализируемые переплете частицы могут быть охарактеризованы и проанализированы соответствует своему назначению.
Предыдущие методы, используемые для обнаружения и определения характеристик наночастиц включают в себя оптические методы, такие как динамического рассеяния света (DLS), иначе известный как фотонной корреляционной спектроскопии. Несмотря на то, приветГ.Х. техника пропускная способность , СДО ограничивается будучи метод на основе усреднения и при анализе мультимодальные образцов без добавления специализированного программного обеспечения, более крупные частицы будут производить гораздо более доминирующего сигнала, в результате чего некоторые из более мелких частиц , совершенно незаметно 6,7. Частица за частицей методы определения характеристик, следовательно, гораздо более благоприятными для анализа наночастиц и функционализованных систем наночастиц.
технологии, основанные RPS основаны вокруг приложения электрического поля к образцу и мониторинга транспортного механизма частиц через синтетического или биологического нанопоры. Относительно недавно обнаружения наночастиц и характеристика методика , основанная на RPS перестраивалось резистивный импульса зондирования (TRPS) 8-16. TRPS представляет собой систему из двух электродов, разделенных эластомерного перестраиваемые пор мембраны. Метод перестраиваемый пор позволяет аналитов диапазона формы 17 и размера , чтобы измерить с помощью их трансмеханизмы портов через поры. Перестраиваемые поры использовались ранее для выявления мелких частиц (70-95 нм в диаметре) , производящее сопоставимые результаты с другими методами , например, трансмиссионной электронной спектроскопии (ПЭМ) 10. При приложении электрического поля, наблюдается ионный ток и, как частицы / молекулы проходят через поры, они временно блокировать поры, что вызывает уменьшение тока, который может быть определен как '' блокада события ». Каждое событие блокада является представителем одной частицы таким образом , что каждая частица в образце можно охарактеризовать по отдельности на основании величины блокаде, А 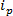 , А полная ширина полувысоте, FWHM, а также другие свойства блокады. Анализируя отдельные частицы, поскольку они проходят через нанопоры выгодно для мультимодальных образцов, как TRPS может успешно и эффективно различать диапазон частиц размером АмонGST одного образца. Настраиваемый чувствительный резистивный импульс завершается размер 10, дзета – потенциал 12,18 и концентрации 15 измерений одновременно в один проход , и поэтому все еще может дифференцировать образцы аналогичных, если не тот же размер , их поверхностным зарядом 19; преимущество по сравнению с альтернативными методами проклейки.
, А полная ширина полувысоте, FWHM, а также другие свойства блокады. Анализируя отдельные частицы, поскольку они проходят через нанопоры выгодно для мультимодальных образцов, как TRPS может успешно и эффективно различать диапазон частиц размером АмонGST одного образца. Настраиваемый чувствительный резистивный импульс завершается размер 10, дзета – потенциал 12,18 и концентрации 15 измерений одновременно в один проход , и поэтому все еще может дифференцировать образцы аналогичных, если не тот же размер , их поверхностным зарядом 19; преимущество по сравнению с альтернативными методами проклейки.
Дзета – потенциал определяется как электростатический потенциал в плоскости сдвига 20, и вычисляется из скоростей частиц , когда они проходят поры 19. Дзета-потенциал измерения отдельных частиц, таким образом, дает понимание механизмов транслокации и поведения систем наночастиц в растворе, ценную информацию для будущего анализа наночастиц конструкций для целого ряда применений. Частица за частицей анализ такой природы позволяет также распространение и распределение дзета-потенциала ценностей среди населения выборки, чтобы изучить, что позволяет получить дополнительную информацию OКинетика реакции N (Однонитевый с двухцепочечной ДНК, например) и стабиль- частиц в растворе, который необходимо достичь.
Здесь мы описываем технику, которая обнаруживает и характеризует как немодифицированные и ДНК-модифицированных поверхностей SPP. Протокол, описанный в настоящем документе, относится к ряду неорганических и биологических наночастиц, но мы продемонстрировать процедуру с использованием ДНК-модифицированных поверхностей из-за их широкого круга применений. Методика позволяет пользователю различать мишени одноцепочечных и двухцепочечной ДНК на поверхности наночастиц, основанный на скорости транслокации частицы через систему пор и таким образом их дзета-потенциалы.
Protocol
Representative Results
Discussion
Расчет для дзета – потенциал был использован метод , основанный калибровки связано с работой по Arjmandi и др. 21. Продолжительность транслокацию частиц при их прохода по нанопор измеряется в зависимости от приложенного напряжения, используя среднее электрическое поле и части…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы благодарят Izon Science Ltd за их поддержку. Работа выполнена при финансовой поддержке Европейской комиссии по научным исследованиям (PCIG11-GA-2012-321836 Nano4Bio).
Materials
| Phosphate buffered Saline (PBS) | Sigma Aldrich, UK | P4417 | 1 tablet dissolved in 200 mL deionised water to make buffer solution. |
| Tween-20 | Sigma Aldrich, UK | P1379 | 0.05% (v/v) in PBS buffer as a surfactant |
| Carboxyl polystyrene nanoparticles | Bangs Laboratories, US | CPC200 | Nominal diamter of 220 nm, raw concentration of 1E12 particles/mL, specific surface charge of 86 µeq/g (equivalent to a surface charge density of 3.2E19 C/nm^2. |
| Streptavidin coated nanoparticles | Ademtech, France | 3121 | Batch had binding capacity of 4352 pmol/mg (188 nM theoretical DNA binding capacity) at a raw concentration of 1.1E11 particles/mL. |
| Biotinylated oligonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Biotin modification at 3' end; Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences: CP 5'ATGGTTAAACCTCAC TACGCGTGGC[Btn]3' |
| Standard olignonucleotides | Sigma Aldrich, UK | VC00001 | Supplier spec: Reverse Phase 1 purification (0.05 Scale); Lyophilised powders reconstituted to 100 µM using deionised water, and diluted as required. Sequences of DNA targets: Fully complementary – 5'GCCACGCGTAGTGAGGTTTAACCAT3', Middle binding – 5'GTAGTGAGGT3', End binding – 5'GTTTAACCAT3', Partially complementary overhanging – 5'GTGAGGTTTAACCAT TTTTTTTTTTTTTTT3'. |
| Izon qNano | Izon Science, NZ | Inherent pressure on system of 47 Pa, | |
| Izon Variable Pressure Module (VPM) | Izon Science, NZ | Each 'cm' of pressure is equivalent to approximately 1000 Pa. | |
| Polyurethane nanopore membranes | Izon Science, NZ | NP150 | Analyte size range 60-480 nm, pore diameter of calculated to be 799 nm at a 45 mm stretch. |
| Magrack 6 | GE Healthcare, UK | 28-9489-64 | |
| Sonic Bath | Fisher Scientific, UK | 10692353 | 80 Watts |
| Vortexer | IKA, Germany | 0003365000 | |
| Rotary Wheel | Labnet International, US | H5500-230 V |
References
- Alexander, C. M., Maye, M. M., Dabrowiak, J. C. DNA-capped nanoparticles designed for doxorubicin drug delivery. Chem Commun. 47 (12), 3418-3420 (2011).
- Billinge, E. R., Platt, M. Aptamer based dispersion assay using tunable resistive pulse sensing (TRPS). Anal Methods. 7 (20), 8534-8538 (2015).
- Bulyk, M. L. Protein Binding Microarrays for the Characterization of Protein-DNA Interactions. Adv Biochem Eng Biotechnol. 104, 65-85 (2007).
- Platt, M., Rowe, W., Knowles, J., Day, P. J., Kell, D. B. Analysis of aptamer sequence activity relationships. Integr Biol. 1 (1), 116-122 (2009).
- Ruiz-Hernández, E., Baeza, A., Vallet-Regí, M. Smart Drug Delivery through DNA/Magnetic Nanoparticle Gates. ACS Nano. 5 (2), 1259-1266 (2011).
- Murdock, R. C., Braydich-stolle, L., Schrand, A. M., Schlager, J. J., Hussain, S. M. Characterization of Nanomaterial Dispersion in Solution Prior to In Vitro Exposure Using Dynamic Light Scattering Technique. Toxicol Sci. 101 (2), 239-253 (2008).
- Hupfield, S., Holsaeter, A. M., Skar, M., Frantzen, C. B., Brandl, M. Liposome size analysis by dynamic/static light scattering upon size exclusion-/field flow fractionation. J Nanosci Nanotechnol. 6 (7), 3025-3031 (2006).
- Roberts, G. S., et al. Tunable pores for measuring concentrations of synthetic and biological nanoparticle dispersions. Biosens Bioelectron. 31 (1), 17-25 (2012).
- Roberts, G. S., Kozak, D., Anderson, W., Broom, M. F., Vogel, R., Trau, M. Tunable nano/micropores for particle detection and discrimination: scanning ion occlusion spectroscopy. Small. 6 (23), 2653-2658 (2010).
- Vogel, R., et al. Quantitative sizing of nano/microparticles with a tunable elastomeric pore sensor. Anal Chem. 83 (9), 3499-3506 (2011).
- Booth, M. A., Vogel, R., Curran, J. M., Harbison, S., Travas-Sejdic, J. Detection of target-probe oligonucleotide hybridization using synthetic nanopore resistive pulse sensing. Biosens Bioelectron. 45, 136-140 (2013).
- Kozak, D., Anderson, W., Vogel, R., Chen, S. Simultaneous size and ζ-potential measurements of individual nanoparticles in dispersion using size-tunable pore sensors. ACS Nano. 6 (8), 6990-6997 (2012).
- Kozak, D., Anderson, W., Vogel, R., Trau, M. Advances in Resistive Pulse Sensors: Devices bridging the void between molecular and microscopic detection. Nano Today. 6 (5), 531-545 (2011).
- Weatherall, E., Willmott, G. R. Applications of tunable resistive pulse sensing. Analyst. 140, 3318-3334 (2015).
- Willmott, G. R., et al. Use of tunable nanopore blockade rates to investigate colloidal dispersions. J Phys Condens Matter. 22 (45), 454116 (2010).
- Blundell, E. L. C. J., Mayne, L. J., Billinge, E. R., Platt, M. Emergence of tunable resistive pulse sensing as a biosensor. Anal Methods. 7, 7055-7066 (2015).
- Platt, M., Willmott, G. R., Lee, G. U. Resistive Pulse Sensing of Analyte-Induced Multicomponent Rod Aggregation Using Tunable Pores. Small. 8 (15), 2436-2444 (2012).
- Vogel, R., Anderson, W., Eldridge, J., Glossop, B., Willmott, G. A variable pressure method for characterizing nanoparticle surface charge using pore sensors. Anal Chem. 84 (7), 3125-3131 (2012).
- Blundell, E. L. C. J., Vogel, R., Platt, M. Particle-by-Particle Charge Analysis of DNA-Modified Nanoparticles Using Tunable Resistive Pulse Sensing. Langmuir. 32 (4), (2016).
- Hunter, R. J. . Zeta Potential in Colloid Science: Principles and Applications. , (1981).
- Arjmandi, N., Van Roy, W., Lagae, L., Borghs, G. Measuring the electric charge and zeta potential of nanometer-sized objects using pyramidal-shaped nanopores. Anal Chem. 84 (20), 8490-8496 (2012).
- Bacri, L., et al. Dynamics of colloids in single solid-state nanopores. J Phys Chem B. 115 (12), 2890-2898 (2011).
- Cabello-Aguilar, S., et al. Dynamics of polymer nanoparticles through a single artificial nanopore with a high-aspect-ratio. Soft Matter. 10 (42), 8413-8419 (2014).
- Billinge, E. R., Muzard, J., Platt, M. Tunable resistive pulse sensing as a tool to monitor analyte induced particle aggregation. Nanomater Nanosci. 1 (1), 11 (2013).
- Li, J., Fan, C., Pei, H., Shi, J., Huang, Q. Smart Drug Delivery Nanocarriers with Self-Assembled DNA Nanostructures. Adv Mater. 25 (32), 4386-4396 (2013).
- Billinge, E. R., Broom, M., Platt, M. Monitoring aptamer-protein interactions using tunable resistive pulse sensing. Anal Chem. 86 (2), 1030-1037 (2014).
- Gold, L., et al. Aptamer-Based Multiplexed Proteomic Technology for Biomarker Discovery. PLoS One. 5 (12), e15004 (2010).
- Park, S. -. J., Taton, T. A., Mirkin, C. A. Array-Based Electrical Detection of DNA with Nanoparticle Probes. Science. 295 (5559), 1503-1506 (2002).

