Fluorescentie anisotropie als een instrument om eiwit-eiwit interacties te bestuderen
Summary
Eiwit interacties vormen de kern van de functie van een cel. Calorimetrische en spectroscopische technieken worden gewoonlijk gebruikt om ze te karakteriseren. Hier beschrijven we fluorescentie anisotropie als middel om de interactie tussen het eiwit gemuteerd in de Shwachman-Diamond Syndroom (SBDS) en elongatiefactor-1 achtige GTPase (EFL1) te bestuderen.
Abstract
Eiwit-eiwit interacties spelen een essentiële rol in de functie van een levend organisme. Zodra een interactie geïdentificeerd en gevalideerd moet worden karakteriseren de structurele en mechanistische niveau. Verschillende biochemische en biofysische methoden bestaan voor een dergelijk doel. Onder hen, fluorescentie anisotropie is een krachtige techniek bijzonder gebruikt wanneer de fluorescentie-intensiteit van een fluorofoor gemerkt eiwit constant op eiwit-eiwit interactie blijft. In deze techniek, een fluorofoor-gemerkte eiwit wordt geëxciteerd met verticaal gepolariseerde licht van een geschikte golflengte die selectief exciteert een deel van de fluoroforen volgens hun relatieve oriëntatie van de inkomende straal. De resulterende emissie heeft ook een richtingsgevoeligheid wiens relatie in de verticale en horizontale vlakken definieert anisotropie (r) als volgt: r = (I -I VV VH) / (I + 2I VV VH), waarin I en I VV <sub> VH de fluorescentie-intensiteiten van de verticale en horizontale componenten resp. Fluorescentie anisotropie is gevoelig voor de rotatiediffusie van een fluorofoor, namelijk de schijnbare molecuulgrootte van een fluorofoor gekoppeld aan een eiwit, die wordt veranderd van eiwit-eiwit interactie. In de onderhavige tekst wordt het gebruik van fluorescentie anisotropie als een instrument om eiwit-eiwitinteracties werd geïllustreerd met de binding tussen het eiwit gemuteerd in de Shwachman-Diamond Syndroom (SBDS) en elongatiefactor like-1 GTPase (EFL1) adres. Conventioneel, labeling van een eiwit met een fluorofoor op de thiolgroepen (cysteine) of de aminogroepen (de N-eindstandige amine of lysine) van het eiwit uitgevoerd. Echter, SBDS bezit meerdere cysteïnes en lysinen die niet gerichte etikettering ervan toestond. Als een alternatieve techniek, de kleurstof 4, werd 5'-bis (1,3,2 dithioarsolan-2-yl) fluoresceïne gebruikt om specifiek label een tetracysteine motief, Cys-Cys-Pro-Gly-Cys-Cys, genetisch gemanipuleerde in de C-terminus van het recombinante eiwit SBDS. Montage van de experimentele gegevens kwantitatieve en mechanistische informatie over de binding mode tussen deze eiwitten.
Introduction
Cellen een veelheid van biomacromoleculen die voortdurend met elkaar. Deze associatie ontstaat complexen die deelnemen aan de cellulaire routes die verantwoordelijk zijn voor hun functioneren in signaaltransductie, regulatie van genexpressie en celmigratie onder andere. Alle proteïne-proteïne interacties die optreden in een cel omvatten een netwerk, bekend als interactoom. In Saccharomyces cerevisiae is aangetoond dat meer dan 70% van de eiwitten interagerende partners 1 hebben. Inzicht in de interactoom van een cel en hun functies relevante informatie over de complexiteit en diversiteit van levende organismen. Verschillende methoden zijn beschreven geïdentificeerd en gekarakteriseerd eiwit-eiwit interacties. Verschillende hoog door te zetten methoden zoals gist two-hybrid 2, eiwit-fragment complementatie assays 3, affiniteitszuivering 4 gekoppeld aan massaspectrometrie en eiwitten microarrays worden gebruikt om een interactie 5,6 identificeren. Eenmaal geïdentificeerd, is het nodig om het te bevestigen en kan variëren van geval tot geval. Kenmerkend voor deze experimenten omvatten het verstoren van de interactie zelf op het niveau van de individuele leden van de interactie paar, bijvoorbeeld door gen deletie of overexpressie van één van de eiwitten, en vervolgens naar veranderingen in de eigenschappen of functie van het andere lid van het cellulair niveau. Vervolgens biofysische technieken 7 worden gebruikt om de eiwit-eiwit interactie te karakteriseren op moleculair niveau. Daartoe is de structuur van eiwitcomplexen worden bepaald door röntgenkristallografie, kernspinresonantie en cryo-elektronenmicroscopie terwijl calorimetrie en fluorescentie spectroscopie worden gebruikt om ze kwantitatief en mechanistisch beschrijven.
In dit werk werd fluorescentie anisotropie gebruikt als een techniek om de wisselwerking karakteriseren tussen de GTPase EFL1 en SBDS-eiwit. Deze eiwitten deel aan de synthese van ribosomen door het bevorderen van de afgifte van eukaryote initiatie factor 6 van het oppervlak van de 60S ribosomale subeenheid 8. De SBDS eiwit is gemuteerd in een ziekte bekend als de Shwachman-Diamond Syndroom 9 en fungeert als een guanine nucleotide exchange factor voor EFL1 verlagen van de affiniteit voor guanosinedifosfaat 10,11. Disease mutaties in SBDS afschaffing van de interactie met EFL1 en daarmee te voorkomen dat de activering.
Fluorescentie anisotropie wordt algemeen gebruikt in biologische toepassingen eiwit-peptide of eiwit-nucleïnezuur interacties te bestuderen. Het is gebaseerd op het principe dat een fluorofoor geëxciteerd met gepolariseerd licht resulteert in een gedeeltelijk gepolariseerde emissie. Fluorescentie anisotropie wordt gedefinieerd door Vergelijking 1:
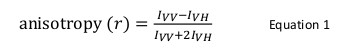
waar ik vv en ik VH zijn defluorescentie-intensiteiten van de verticaal (VV) en horizontaal (VH) gepolariseerde emissie wanneer het monster is enthousiast met verticaal licht 12 gepolariseerd. Fluorescentie anisotropie is gevoelig voor factoren die de snelheid van de rotatiediffusie van de fluorofoor beïnvloeden en derhalve afhankelijk van de temperatuur, de viscositeit van de oplossing en de schijnbare molecuulgrootte van de fluorofoor. De schijnbare grootte van een eiwit dat een fluorofoor toeneemt bij interactie met een ander eiwit en dergelijke veranderingen kunnen vervolgens worden beoordeeld als een verandering van anisotropie. Meer specifiek zal een fluorofoor die langzaam roteert in oplossing ten opzichte van de fluorescentie levensduur grote I VV waarde en kleine ik VH waarde en dus een relatief grote anisotropie vertonen. Voor fluoroforen die snel in verhouding tot hun fluorescerende leven tuimelen, ik vv en ik VH zal vergelijkbaar zijn en hun anisotropie waarde klein zijn 12 </sup> (Figuur 1). Bovendien, voor een goede anisotropie signaal geluidsmeting, is het noodzakelijk om een fluorofoor een fluorescentie levensduur vergelijkbaar met de rotatiecorrelatietijd van het molecuul van belang hebben. Anders is het niet mogelijk om het verschil in anisotropie tussen vrij proteïne en dat in het complex een accurate. Bijvoorbeeld, de anisotropie van een fluorescerende probe met een levensduur bijna 4 nsec zoals fluoresceïne of rhodamine bevestigd aan een laag gewicht verbinding met 100 Da molecuulgewicht is 0,05. Binding aan een molecuul van 160 kDa zal de anisotropie waarde te verhogen tot 0,29; een verschil dat nauwkeurig kan worden gemeten. Daarentegen zullen dezelfde fluorescerende probe betrokken in een bindingsreactie waarvan de toename van moleculaire grootte varieert van 65 tot 1000 kDa alleen tot een verandering anisotropie van 0,28 tot 0,3, die te klein nauwkeurig te meten. In dit scenario zou een sonde met een levensduur van 400 nanoseconden meer geschikt 12 zijn.
<pclass = "jove_content">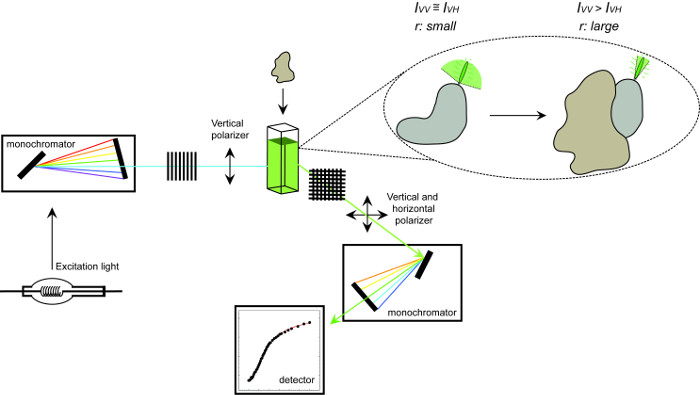
Figuur 1. Schematische weergave van de gebruikte fluorescentie anisotropie en de procedure meetapparatuur. Schematische weergave van de gebruikte om een eiwit-eiwit interactie experiment meten van fluorescentie anisotropie te voeren apparatuur. Fluoroforen dat snelle weergave kleine anisotropie die toeneemt bij binding aan een interactie partner tuimelen. Klik hier om een grotere versie van deze figuur te bekijken.
Fluorescentietoepassingen vereisen de aanwezigheid van een fluorofoor in elk van de moleculen bestudeerd. Bestuderen eiwit-eiwit interacties zijn er drie type fluoroforen: 1) het tryptofaan residuen in de eiwitten, 2) chemisch gebonden fluoroforen en 3) fluorescerende fusiepartners zoals groen fluorescent eiwit (GFP) en derivatieven. De meeste eiwitten hebben tryptofaan residuen van de structuur, waardoor de gemakkelijkste manier om een interactie te meten is door het bewaken van de veranderingen in de overeenkomstige fluorescentie spectra of door het bewaken veranderingen in de fluorescentie-intensiteit van het tryptofaan residuen. Evenwel tryptofaan residuen in beide eiwitten compliceert de analyse. Anderzijds, een fluorofoor de fluorescerende eigenschappen veranderen als gevolg van een interactie moet worden op of vlakbij de bindingsplaats en het kan interfereren met de interactie zelf. Dit heeft speciale aandacht nodig bij het gebruik van omvangrijke fluoroforen zoals GFP. Als geen van deze fluoroforen kunnen worden gebruikt voor bindingsstudies moet dan extrinsieke fluoroforen voeren aan die van de betrokken eiwitten. Vele chemisch gesynthetiseerde fluoroforen aanwezig en kunnen covalent worden gehecht aan proteïnen via hun reactieve groepen zoals aminogroepen (zijketen van lysines of N-terminus) en de thiolgroepen in cysteine. Fluorophore derivaten met isothiocyanaat en succinimidyl esters reageren met amidegroepen terwijl joodacetamide en maleimide zijn thiol-reactieve groepen 13. De meest voorkomende kleurstoffen in fluorescentietoepassingen zijn derivaten van de fluoresceïne en de rhodamine groene kleurstoffen, coumarines, BODIPY fluoroforen en Alexa Fluor kleurstoffen. Een gedetailleerde lijst van in de handel verkrijgbare fluoroforen en het gebruik ervan kan worden gevonden in de referenties 14,15. Voor succesvolle labeling, moet de reactieve groep wordt blootgesteld aan het oppervlak van het proteïne, maar door het grote aantal reactieve functionele groepen typisch in polypeptiden is het erg moeilijk om plaatsspecifieke modificatie krijgen. Het eiwit van belang in dit onderzoek SBDS bevat 5 cysteïnes vrij en 33 lysines die kunnen leiden tot multisite labeling. Niet-uniforme etikettering kan de binding beïnvloeden en zal data-analyse compliceren als verschillende fluorofoor moleculen verschillende fluorescentie-intensiteit signalen bij binding kan uitlokken. om overcome dit probleem, gebruikten we de flitser fluorofoor, 4 ', 5'-bis (1,3,2 dithioarsolan-2-vl) fluoresceïne aan de site-directe label de SBDS eiwit. Dit is een arseenoxide kleurstof met een hoge affiniteit voor vier cysteïnen gescheiden in een motief bekend als flash-tag bestaat uit de sequentie CCXXCC waarbij X elk aminozuur behalve cysteïne 16,17. Dit tetracysteine motief wordt toegevoegd aan de N- of C-terminus van het eiwit door genetische manipulatie met een geschikte linker aan de verstoring van de algehele vouw van het eiwit te voorkomen. Het paar bestaande uit Flash kleurstof en flash-tag werd oorspronkelijk ontworpen om plaatsspecifieke label eiwitten in levende cellen 17 maar het kan ook worden gebruikt om gezuiverde eiwitten in vitro labelen zoals hier toegelicht. Daarnaast zijn ook enzymatische strategieën ontwikkeld om plaatsspecifieke functionalisering van eiwitten 18 mogelijk.
In dit manuscript beschrijven we de bruikbaarheid van een fluorescentie anisotropiesa instrument om eiwit-eiwitinteracties. Binding kan worden beoordeeld door een eenvoudige inspectie van de binding curve vorm, terwijl kwantitatieve informatie kan worden verkregen bij de pasvorm van de experimentele gegevens.
Protocol
Representative Results
Discussion
De meeste biochemische experimenten eiwitten vereisen niet alleen zuivere eiwit, maar ook grote hoeveelheden daarvan, ongeacht de gebruikte techniek. Daarom worden de voor dit type experimenten eiwitten verkregen door heterologe expressie, zoals het geval was gepresenteerd. Fluorescentie spectroscopie vereist de aanwezigheid van een fluorofoor in het onderzochte molecuul. Aromatische resten vormen de intrinsieke fluoroforen van een eiwit, maar met behulp van hun signaal eiwit-eiwitinteracties compliceert de analyse omda…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Authors acknowledge the financial support from CONACyT project numbers 167359 and 177138, and from DGAPA-UNAM project number IN201615.
Materials
| 0.5 mm Glass beads | Biospec Products | 11079105 | |
| Tris Base | Formedium | TRIS01 | Ultra pure |
| Glycerol | Sigma-Aldrich | G5516 | |
| dye 4’, 5’-bis(1,3,2 dithioarsolan-2-yl) fluorescein | ThermoFischer Scientific | LC6090 | This kit contains the dye to label a FlAsH tag |
| Ampiciline | IBI Shelton Scientific, Inc | IB02040 | |
| D(+)-Glucose Anhydrous | Formedium | GLU03 | |
| D(+)-Galactose | Formedium | GAL03 | |
| L-Leucine | Formedium | DOC0157 | |
| L-Tryptofan | Formedium | DOC0189 | |
| Bezamidine hydrochloride | Sigma-Aldrich | B6506-5G | |
| PMSF | Gold Biotechnology, Inc | P-470-25 | Phenylmethylsulfonyl fluoride |
| NaCl | Formedium | NAC02 | Sodium Chloride |
| Glycerol | Tecsiquim, S.A. de C.V. | GT1980-6 | |
| MgCl2 | Merck Millipore Corporation | 1725711000 | Magnesium Chloride |
| Imidazole | Sigma-Aldrich | I2399-500G | |
| 2-Mercaptoethanol | Sigma-Aldrich | M6250-100ML | |
| K2HPO4 | Sigma-Aldrich | P3786-500G | Potassium phosphate dibasic |
| NaH2PO4 | Sigma-Aldrich | S3139-500G | Sodium phosphate monobasic |
| Yeast nitrogen base without amino acids | Formedium | CYN0410 | |
| Yeast extract | Formedium | YEM03 | Micro Granulated |
| L-Tyroisne | Formedium | DOC0193 | |
| Adenine sulphate | Formedium | DOC0230 | |
| Casamino acids | Formedium | CAS03 | |
| Tryptone | IBI Shelton Scientific, Inc | IB49182 | |
| IPTG | Formedium | IPTG025 | |
| Name of Material | Company | Catalog Number | Comments/Description |
| Filtration units | Merck Millipore Corporation | UFC901096 | Amicon Ultra-15, membrana PLGC Ultracel-PL, 10 kDa |
| Membrane Filter | Merck Millipore Corporation | GSWP04700 | Membrane Filter, mixed cellulose esters, Hydrophilic, 0.22 µm, 47 mm, white, plain |
| Ni2+ affinity column | QIAGEN | 30760 | Cartridge pre-filled with 5 ml Ni-NTA Superflow |
| Strong Sulfopropyl cation exchanger column | GE Healthcare Life Science | 17-5157-01 | HiTrap SP Sepharose FF 5 ml |
| Size Exclusion column | GE Healthcare Life Science | 28989335 | HiLoad 16/600 Superdex 200 PG |
| Fluorescence cell | Hellma Analytics | 111-057-40 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Spectrophotometer | Agilent Technologies | G6860AA | Cary 60 UV-Vis |
| Shaker | ThermoFischer Scientific | SHKA4000-7 | MaxQ 4000 Benchtop temperature range Ambient-15° to 60°C |
| Centrifuge | ThermoFischer Scientific | 75004271 | Heraeus Megafuge 16R |
| FPLC | Pharmacia Biotech | Discontinued | FPLC system conductivity UV-MM II monitor P500 pump fraction |
| Spectrofluorometer | Olis | No applicable | Olis DM 45 with Polarization Toolbox |
References
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440 (7084), 637-643 (2006).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Michnick, S. W., Hien Ear, P., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods in Enzymology. 470, 336-366 (2010).
- Puig, O., et al. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Dwane, S., Kiely, P. A. Tools used to study how protein complexes are assembled in signaling cascades. Bioeng Bugs. 2 (5), 247-259 (2011).
- Snider, J., et al. Fundamentals of protein interaction network mapping. Mol Syst Biol. 11 (12), 848 (2015).
- Fersht, A., Baldwin, R. L. . Structure and mechanism in protein science: a guide to enzyme catalysis and protein folding. , 191-214 (2002).
- Menne, T. F., et al. The Shwachman-Bodian-Diamond syndrome protein mediates translational activation of ribosomes in yeast. Nat Genet. 39 (4), 486-495 (2007).
- Boocock, G. R., et al. Mutations in SBDS are associated with Shwachman-Diamond syndrome. Nat Genet. 33 (1), 97-101 (2003).
- Garcia-Marquez, A., Gijsbers, A., de la Mora, E., Sanchez-Puig, N. Defective Guanine Nucleotide Exchange in the Elongation Factor-like 1 (EFL1) GTPase by Mutations in the Shwachman-Diamond Syndrome Protein. J Biol Chem. 290 (29), 17669-17678 (2015).
- Gijsbers, A., Garcia-Marquez, A., Luviano, A., Sanchez-Puig, N. Guanine nucleotide exchange in the ribosomal GTPase EFL1 is modulated by the protein mutated in the Shwachman-Diamond syndrome. Biochem Biophys Res Commun. 437 (3), 349-354 (2013).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2010).
- Nishigaki, T., Treviño, C. L., Gòmez, I. . Tools to understand protein-protein interactions. 37, 1-14 (2012).
- Johnson, I. . The Molecular Probes Handbook: A Guide to Fluorescent Probes and Labeling Technologies. , (2010).
- Sabnis, R. W. . Handbook of Fluorescent Dyes and Probes. , (2015).
- Adams, S. R., et al. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: synthesis and biological applications. J Am Chem Soc. 124 (21), 6063-6076 (2002).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281 (5374), 269-272 (1998).
- Rashidian, M., Dozier, J. K., Distefano, M. D. Enzymatic labeling of proteins: techniques and approaches. Bioconjug Chem. 24 (8), 1277-1294 (2013).
- Maniatis, T., Fritsch, E. F., Sambrook, J. . Molecular cloning: A laboratory manual. , (2001).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9 (6), 255-262 (1988).
- West, R. W., Chen, S. M., Putz, H., Butler, G., Banerjee, M. GAL1-GAL10 divergent promoter region of Saccharomyces cerevisiae contains negative control elements in addition to functionally separate and possibly overlapping upstream activating sequences. Genes Dev. 1 (10), 1118-1131 (1987).
- Ito, H., Fukuda, Y., Murata, K., Kimura, A. Transformation of intact yeast cells treated with alkali cations. J Bacteriol. 153 (1), 163-168 (1983).
- Eftink, M. R. Fluorescence methods for studying equilibrium macromolecule-ligand interactions. Methods Enzymol. 278, 221-257 (1997).
- Han, H., et al. Binding of Substrates to the Central Pore of the Vps4 ATPase Is Autoinhibited by the Microtubule Interacting and Trafficking (MIT) Domain and Activated by MIT Interacting Motifs (MIMs). J Biol Chem. 290 (21), 13490-13499 (2015).
- Sanchez-Puig, N., Veprintsev, D. B., Fersht, A. R. Binding of natively unfolded HIF-1alpha ODD domain to p53. Mol Cell. 17 (1), 11-21 (2005).
- Trusch, F., et al. The N-terminal Region of the Ubiquitin Regulatory X (UBX) Domain-containing Protein 1 (UBXD1) Modulates Interdomain Communication within the Valosin-containing Protein p97. J Biol Chem. 290 (49), 29414-29427 (2015).
- Kamp, F., Beyer, K. Binding of alpha-synuclein affects the lipid packing in bilayers of small vesicles. The Journal of Biological Chemsitry. 281, 9251-9259 (2006).
- Bujalowski, W. M., Jezewska, M. J. Fluorescence Intensity, Anisotropy, and Transient Dynamic Quenching Stopped-Flow Kinetics. Spectroscopic Methods of Analysis. 875, 105-133 (2012).
- Asano, N., et al. Direct interaction between EFL1 and SBDS is mediated by an intrinsically disordered insertion domain. Biochem Biophys Res Commun. 443 (4), 1251-1256 (2014).

