過分極<sup> 13</sup> C代謝磁気共鳴分光法とイメージング
Summary
Dynamic nuclear polarization with subsequent sample dissolution has enabled real-time studies of metabolism in biological systems. Hyperpolarized [1-13C]pyruvate was used to study lactate dehydrogenase activity in a prostate carcinoma cell line in vitro.
Abstract
過去数十年間では、腫瘍の病期分類、再病期決定、治療応答のモニタリング、および種々の癌の再発を検出するための新しい方法は、18 F-フルオロ([18 Fと最先端の陽電子放射断層撮影法に関連して出現しています] -FDG PET)。 13 C核磁気共鳴分光イメージング(13 CMRSI)は、 インビボ及びリアルタイムでの代謝のモニタリングを可能にする低侵襲イメージング法です。 13 C核磁気共鳴(NMR)に基づく他の方法と同様に、それが原因13 C及び低天然存在度の比較的低い磁気回転比で低熱分極とそれに続く低い信号対雑音比の挑戦に直面しています生物学的サンプル。これらの制限を克服することにより、後続のサンプルの溶解との動的核分極(DNP)は、最近、一般に有効測定するNMR及び磁気共鳴イメージング(MRI)システムを使用してい様々な生物学的システムでは、研究、および画像鍵代謝経路。過去10年間に、広く細胞のエネルギー代謝を調査するために、インビトロ 、前臨床に使用される、および、より最近では、臨床試験されている、13 CMRSIある[1- 13 C]ピルビンで使用特に興味深く有望な分子癌および他の疾患インチこの記事では、我々は3.35 T前臨床DNPの超偏極を用いて、溶解DNPの技術の概要を説明し、in vitro試験におけるその使用法を示します。過分極のための同様のプロトコルは、同様のインビボ研究においてほとんどの部分に適用することができます。そうするために、我々は、乳酸脱水素酵素(LDH)を使用し、13 CMRSIを使用して、in vitroでの前立腺癌細胞株、PC3、中[1- 13 C]乳酸に[1- 13 C]ピルビン酸の代謝反応を触媒しました。
Introduction
現在、癌の広範囲の腫瘍病期分類、再病期決定、治療応答のモニタリング、及び再発の検出のために最も広く使用されている臨床的方法は、[18 F] -FDG PETです。 1しかし、最近、いくつかの新規および代替的なアプローチが出現しています。これらの方法の一つは、13 CMRSIです。この技術は、リアルタイムで、インビトロまたはインビボでの代謝を評価するために、低侵襲MRI続いて生物学的サンプル中に13 C-分子の導入を含みます。それにもかかわらず、そのような[18 F] -FDG PET又はコンピュータ断層撮影のような他の方法と比較して13 CMRSIの最大の課題は、低い信号対雑音比です。
NMR信号は、分極レベル、総人口の2つのエネルギー状態のスピン半核集団差の比( 図1A)に正比例します。偏光は目の製品です。電子原子核の磁気回転比(γ)と温度に対する印加磁界の強さ。 1 H核の典型的な分極は、比較的低い信号対雑音比を与える3 Tに0.005%、0.001%程度です。今日の最先端のMRIのみによる生体試料中の1 Hの高い豊かさと1 H(γの1H = 42.576 MHzで/ T)の高い磁気回転比に成功したイメージング方法でした。しかし、炭素などの他の核を、観察、より厳しいあります。唯一の安定した、磁気的に活性な炭素同位体、13 Cは、すべての炭素原子のわずか1.1%を占めます。また、13 C(γ13C = 10.705 MHzで/ T)の磁気回転比は低い検出効率につながる、1 Hのそれよりも4倍低いです。要約すると、低い13 Cの存在量および低いγ13Cは熱13 C測定値が1の感度の0.0176%に達成させin vivoでの H-NMR測定。
動的核分極
13 C測定の比較的低い感度を克服するための方法は、DNPです。もともとはアルバートW.オーバーハウザーによって1953年に金属について説明しました。彼の記事では、彼は述べた: "伝導電子の電子スピン共鳴が飽和している場合、核はその磁気回転比は、電子スピンのことであった場合、彼らは次のようになり、同じ程度に偏光されることが示されている。「2その後その年、カーバーとスリクターは、実験的にオーバーハウザーの仮説3を確認しました 。 1958年、Abragamとプロクターは、液体中の電子のためにこの効果を説明し、それを名前の「固体効果。」 4 K以下の温度で、電子スピン分極は、ほぼ100%に達し、核スピン分極( 図1B)4以下の大きさより3桁高いです。 T電子の磁気回転比(γE = 28024.944 MHzの/ T)は、核磁気回転比よりも三桁であるため、彼が発生します。電子は、対応する電子に近い周波数でマイクロ波照射を使用して、核スピンへスピンから、このようなオーバーハウザー効果、固体効果、クロス効果、及び熱混合効果として電子と原子核との間の弱い相互作用は、偏光の転送を可能にします常磁性共鳴(EPR)周波数5,6。 DNPの理論は、さらにより多くの電子および熱混合が関与するために開発されました。それにもかかわらず、現在までに、DNPの統一定量的な理論的な説明は7,8を公開されていません。
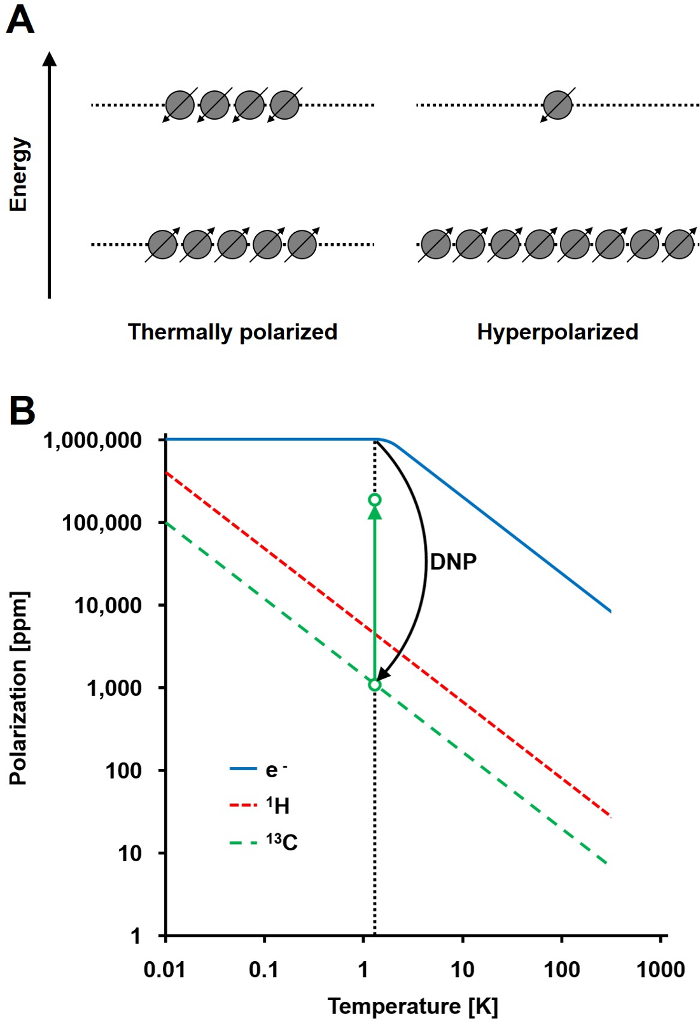
図1:動的核分極および過分極を理解します。スピン人口のA)は概略比較熱平衡偏光状態と過分極状態インチB)偏光は、温度に依存しています。電子(E – )の偏光は100%1.4 KでDNPの下に到達した電子から10 5倍までの彼らの偏光を増加させる13 C核に分極の転送を可能にします。 この図の拡大版をご覧になるにはこちらをクリックしてください。
13 C NMRを用いて、生物学的システムの研究にDNPを導入するために、その後の迅速なサンプルの溶解を開発する必要がありました。オーバーハウザーの仮説、月H. Ardenkjaer-ラーセンら後の50年。最小限の過分極損失6で液体状態に過分極凍結サンプルをもたらす技術的に困難な問題を解決しました。解散DNPは13 CMRSと呼ばれる新しい研究分野を開きました私は、種々の疾患状態9,10を調査し、特徴づけるための新しい方法を提供します。不対電子のように安定したキャリア、トリチルラジカルトリス(8-カルボキシ-2,2,6,6-テトラ(ヒドロキシエチル)-benzo- [1,2-4,5]ビス – (1,3) -dithiole -4-イル)メチルナトリウム塩(OX063)または(2,2,6,6-テトラメチルピペリジン-1-イル)オキシル(TEMPO)は、通常使用されます。これらは、所望の13 C標識された分子と混合し、対応するEPR周波数に近い周波数でマイクロ波照射に曝露されます。この技術を用いて、13 C核の分極を37〜11%まで増加させることができます。これは、熱平衡偏光11,12に比べて10 5倍の偏光強化につながります。しかし、マイクロ波照射が停止され、及び/又は13 C-分子は液体状態に転送されるとすぐように、偏光を偏光された13 C核の縦緩和時間(T 1)で減衰します。このように、迅速な溶解技術の発明または実験測定までの時間を短縮し、後続の技術( すなわち、注射)は、生物学的なアプリケーション13のために重要です。
候補分子が成功した13 CMRSIの研究のために満たすために必要な三つの主要な要件があります。まず、目的の13 C核が十分に長いT 1(> 10秒)を有していなければなりません。 13 C-標識の選択は非常に重要です。最良の候補核が結合を介して 1 H-核と直接接触を持つ炭素です。元の物質と有意に異なる化学シフト下流代謝産物を生じ、3 T 1回-それはまた、急速に2内に代謝される必要があります。空間分布は、トランスを可能にする電子と13 Cとの間の距離を減少するように試料混合物は、固体状態で場合非晶質ガラスを形成しなければなりません偏光のFER。候補分子は、自然に非晶質ガラスを形成しない場合、それは、例えばグリセロールまたはジメチルスルホキシド14として、ガラス化剤中に高度に可溶性である必要があります。これらの要件は、候補分子が比較的少数で生じます。しかし、適切な分子の発見に成功した後、過分極のための作業プロトコルを開発することが9,14,15技術的に挑戦することができます。
36、[2- 13 C]ピルビン酸37、[1- 13 C]ピルビン酸エチル38、[1- 13 C –近年では、いくつかの基板には、[1- 13 C]ピルビン酸12,16として、正常に偏しています]乳酸39、[1- 13 C]フマル酸40から43、13 C-重炭酸塩36,44,45、[1- 13 C]酢酸ナトリウム43,46 – 49、13 C-尿素6,36,50,51 、[5- 13 C] glutamineの15,52,53、[1- 13 C]グルタミン酸53,54、[1- 13 C] 2-オキソグルタル酸55、[1- 13 C]アラニン、およびその他14,56。過分極に特に興味深く、一般的に使用される基板は、[1- 13 C]ピルビン酸塩です。広く種々の疾患14,17,22における細胞のエネルギー代謝を調査するために前臨床試験で使用されています。 [1- 13 C]ピルビン酸は続いて代謝される前に、細胞膜を横切る比較的長いT 1および迅速な輸送を含む成功した超偏極のためのすべての要件を満たしています。 [1- 13 C]ピルビン酸と前臨床研究は、現在、診療所57に翻訳されています。
ピルビン酸の代謝
よく、癌細胞のDNAおよびそれらの代謝経路の変化の突然変異との間に直接的なリンクがあることが知られています。すでに1920年代、オットーウォーバーグdiscov60 –健康な組織58に比べて、腫瘍中の乳酸のグルコース生産の増加代謝があることをered。続いて、このようなペントース – リン酸経路、トリカルボン酸回路、酸化的リン酸化、ならびにヌクレオチドおよび脂質の合成のような他の代謝経路における種々の交替は、記載されています。
ピルビン酸は、解糖の最終産物です。腫瘍では、LDH 61によって触媒嫌気的解糖を受け、補酵素ニコチンアミドアデニンジヌクレオチドの還元形態と反応し (NADH)、乳酸塩および補酵素(NAD +)の酸化型になります。あるいは、ピルビン酸は、アラニントランスアミナーゼ(ALT)によって触媒されるアラニンを形成するグルタミン酸転移反応を受けます。両方の反応は容易に可逆的です。ピルビン酸は、また、二酸化炭素およびアセチルCoA、rにピルビン酸デヒドロゲナーゼ(PDH)により触媒される脱炭酸を受けこの段階で不可逆的な反応をepresenting。これらの反応速度での交代は、腫瘍代謝17,21,22,25,62にリンクすることができます。代謝経路を図2にまとめます。

図2:ピルビン酸の主要代謝反応のダイアグラム。ピルビン酸/乳酸変換はLDHにより触媒される、ピルビン酸/アラニンの変換はALTによって触媒されます。ピルビン酸は、不可逆的にPDHによって、およびCO 2 -アセチルCoAに変換され、CO 2は重炭酸塩80とのpH依存性平衡状態にあります。 この図の拡大版をご覧になるにはこちらをクリックしてください。
過分極[1- 13 C]ピルビン酸塩及びその代謝産物の検出は、以前にラットにおいて実証されている彼芸術37,63 – 65、肝臓66、筋肉、および腎臓62,67。ある研究では、正常と絶食ラットの肝臓66との間に乳酸からアラニンへの比率に有意差を示し、肝癌68,69に非常に上昇し、過分極[1- 13 C]乳酸レベルを示しました。腫瘍の悪性度を切除した腫瘍の組織学的悪性度と高い相関を示す過分極乳酸レベルで、過分極[1- 13 C]ピルビン酸22を用いて、マウス前立腺(TRAMP)のトランスジェニック腺癌において同定することができるという証拠があります。 ALTによってピルビン酸から触媒アラニンはまた、ラットの肝細胞癌23に有用なマーカーとして提案されています。
ピルビン酸、乳酸の代謝フラックスを測定するモニタリング虚血63,65,70のための細胞傷害性化学療法17,40、標的薬による治療への応答として使用されてきました<SUP> 24,25,41、または動物モデルでの放射線治療26。また、神経膠芽腫および乳癌のマウスモデル25におけるホスファチジルイノシトール3-キナーゼ(PI3K)阻害剤LY294002応答の検出のために使用されてきました。脳腫瘍26および前立腺癌24,71におけるピルビン酸代謝の変化はまた、治療後に観察されています。
前立腺癌
前立腺癌は、世界中の72人の男性に死刑に関連する高齢男性と第二の主要癌における主要な癌です。現在まで、信頼性の高い、非侵襲的な方法は、患者の厳格な検出およびステージングを有効にするための新規な代謝イメージング技術のための緊急の必要性を強調し、前立腺癌73,74の早期診断および特徴付けのために用意されていません。前立腺癌は、患者における13 CMRSIと組み合わせた溶解DNPの可能性を実証するためのモデルとして使用されました57です。この作業は、[1- 13 C]ピルビン酸および前立腺癌のイメージングのための13 CMRSIを採用した最初の臨床試験で継続し、それは最近(NCT01229618)を完了したしました。
この作品の背後にある動機は、細胞を用いた前臨床設定で13 CMRSI法の適用をより詳細に、より広い聴衆のために説明することでした。 PC3前立腺癌細胞株のin vitroでの [1- 13 C]乳酸に[1- 13 C]ピルビン酸のLDH触媒による代謝を測定し、我々は、in vitro試験で溶解DNPの適用可能性を実証し、重要なステップに対応し、実験中の課題。
Protocol
Representative Results
Discussion
過分極プローブと13 CMRSIは、in vitroおよびin vivoでリアルタイムでの代謝をモニターするための有望な方法です。 1つの非常に重要な側面は、この実験的なプロセスを採用した場合は、特にインビトロ実験にについて、適切な標準化です。まず、試料の調製は、各実験において、超偏極物質の同じ濃度を達成するように適切にかつ一貫して行われる必要?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
E.K. gratefully acknowledges the support of the Graduate School of Bioengineering (GSB) at Technische Universität München. This work was supported by the German Research Foundation (DFG) within the SFB Collaborative Research Center 824, “Imaging for Selection, Monitoring, and Individualization of Cancer Therapies.”
Materials
| HyperSense DNP Polariser | Oxford Instruments | 3.35 T preclinical DNP hyperpolarizer | |
| GE/Agilent MR901 | GE Healthcare/Agilent Technologies | 7 T preclinical MRI scanner, with small bore designed for experiments onrodent | |
| Spinsolve Carbon | Magritek | 1 T NMR spectrometer with permanent magnet | |
| Deuterium Oxide | Sigma Aldrich | 7789-20-0 | |
| Sodium phosphate dibasic | Sigma Aldrich | 7558-79-4 | |
| Sodium phosphate monbasic | Sigma Aldrich | 7558-80-7 | |
| Sodium hydroxide | Sigma Aldrich | 1310-73-2 | |
| Disodium edetate | Sigma Aldrich | 6381-92-6 | |
| Pyruvic acid – 13C1 | Cambridge Isotopes Laboratories | CLM-8077-1 | |
| Dotarem (0.5 mmol/L) | Guerbet | gadoterate meglumine | |
| tris (8-carboxy-2,2,6,6-tetra-(hydroxyethyl)-benzo-[1,2–4,5]-bis-(1,3)-dithiole-4-yl)-methyl sodium salt (OX063) | GE Healthcare | trityl radical used as a sourse of free electron | |
| PC3 cell line | ATCC | CRL1435 | |
| F-12K medium | ATCC | 30-2004 | |
| Fetal Bovine Serum | ATCC | SCRR-30-2020 | |
| Trypsine-EDTA Solution, 1X | ATCC | 30-2101 | |
| Sample plastic cup | Oxford Instruments | ||
| Trypan blue | Bio-Rad | 145-0013-MSDS |
References
- Rohren, E. M., Turkington, T. G., Coleman, R. E. Clinical applications of PET in oncology. Radiology. 231 (2), 305-332 (2004).
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Carver, T. R., Slichter, C. P. Polarization of Nuclear Spins in Metals. Phys. Rev. 92 (1), 212-213 (1953).
- Abragam, A., Proctor, W. G. Spin Temperature. Phys. Rev. 109 (5), 1441-1458 (1958).
- Abragam, a., Goldman, M. Principles of dynamic nuclear polarisation. Reports Prog. Phys. 41 (3), 395-467 (2001).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Shimon, D., Hovav, Y., Feintuch, A., Goldfarb, D., Vega, S. Dynamic nuclear polarization in the solid state: a transition between the cross effect and the solid effect. Phys. Chem. Chem. Phys. 14 (16), 5729-5743 (2012).
- Serra, S. C., Rosso, A., Tedoldi, F. Electron and nuclear spin dynamics in the thermal mixing model of dynamic nuclear polarization. Phys. Chem. Chem. Phys. 14 (38), 13299-13308 (2012).
- Gallagher, F. A., Kettunen, M. I., Brindle, K. M. Biomedical applications of hyperpolarized 13C magnetic resonance imaging. Prog. Nucl. Magn. Reson. Spectrosc. 55 (4), 285-295 (2009).
- Hurd, R. E., Yen, Y. -. F., Chen, A., Ardenkjaer-Larsen, J. H. Hyperpolarized 13C metabolic imaging using dissolution dynamic nuclear polarization. J. Magn. Reson. Imaging. 36 (6), 1314-1328 (2012).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10158-10163 (2003).
- Golman, K., in’t Zandt, R., Thaning, M. Real-time metabolic imaging. Proc. Natl. Acad. Sci. 103 (30), 11270-11275 (2006).
- Comment, A., Rentsch, J., et al. Producing over 100 ml of highly concentrated hyperpolarized solution by means of dissolution DNP. J. Magn. Reson. 194 (1), 152-155 (2008).
- Brindle, K. M., Bohndiek, S. E., Gallagher, F. A., Kettunen, M. I. Tumor imaging using hyperpolarized 13C magnetic resonance spectroscopy. Magn. Reson. Med. 66 (2), 505-519 (2011).
- Gallagher, F. A., Kettunen, M. I., Day, S. E., Lerche, M., Brindle, K. M. 13C MR spectroscopy measurements of glutaminase activity in human hepatocellular carcinoma cells using hyperpolarized 13C-labeled glutamine. Magn. Reson. Med. 60 (2), 253-257 (2008).
- Chen, A. P., Albers, M. J., et al. Hyperpolarized C-13 spectroscopic imaging of the TRAMP mouse at 3T-initial experience. Magn. Reson. Med. 58 (6), 1099-1106 (2007).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Schroeder, M. A., Swietach, P., et al. Measuring intracellular pH in the heart using hyperpolarized carbon dioxide and bicarbonate: a 13C and 31P magnetic resonance spectroscopy study. Cardiovasc. Res. 86 (1), 82-91 (2010).
- Hurd, R. E., Yen, Y. -. F., Tropp, J., Pfefferbaum, A., Spielman, D. M., Mayer, D. Cerebral dynamics and metabolism of hyperpolarized [1-(13)C]pyruvate using time-resolved MR spectroscopic imaging. J. Cereb. Blood Flow Metab. 30 (13), 1734-1741 (2010).
- Golman, K., Zandt, R. I., Lerche, M., Pehrson, R., Ardenkjaer-Larsen, J. H. Metabolic imaging by hyperpolarized 13C magnetic resonance imaging for in vivo tumor diagnosis. Cancer Res. 66 (22), 10855-10860 (2006).
- Park, I., Larson, P. E. Z., et al. Hyperpolarized 13C magnetic resonance metabolic imaging: application to brain tumors. Neuro. Oncol. 12 (2), 133-144 (2010).
- Albers, M. J., Bok, R., et al. Hyperpolarized 13C lactate, pyruvate, and alanine: noninvasive biomarkers for prostate cancer detection and grading. Cancer Res. 68 (20), 8607-8615 (2008).
- Yen, Y. -. F., Le Roux, P., et al. T(2) relaxation times of (13)C metabolites in a rat hepatocellular carcinoma model measured in vivo using (13)C-MRS of hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 23 (4), 414-423 (2010).
- Dafni, H., Larson, P. E. Z., et al. Hyperpolarized 13C spectroscopic imaging informs on hypoxia-inducible factor-1 and myc activity downstream of platelet-derived growth factor receptor. Cancer Res. 70 (19), 7400-7410 (2010).
- Ward, C. S., Venkatesh, H. S., et al. Noninvasive detection of target modulation following phosphatidylinositol 3-kinase inhibition using hyperpolarized 13C magnetic resonance spectroscopy. Cancer Res. 70 (4), 1296-1305 (2010).
- Day, S. E., Kettunen, M. I., et al. Detecting response of rat C6 glioma tumors to radiotherapy using hyperpolarized [1- 13C]pyruvate and 13C magnetic resonance spectroscopic imaging. Magn. Reson. Med. 65 (2), 557-563 (2011).
- Johannesson, H., Macholl, S., Ardenkjaer-Larsen, J. H. Dynamic Nuclear Polarization of [1-13C]pyruvic acid at 4.6 tesla. J. Magn. Reson. 197 (2), 167-175 (2009).
- Durst, M., Koellisch, U., et al. Bolus tracking for improved metabolic imaging of hyperpolarised compounds. J. Magn. Reson. 243, 40-46 (2014).
- Khegai, O., Schulte, R. F., et al. Apparent rate constant mapping using hyperpolarized [1-(13)C]pyruvate. NMR Biomed. 27 (10), 1256-1265 (2014).
- Sogaard, L. V., Schilling, F., Janich, M. A., Menzel, M. I., Ardenkjaer-Larsen, J. H. In vivo measurement of apparent diffusion coefficients of hyperpolarized (1)(3)C-labeled metabolites. NMR Biomed. 27 (5), 561-569 (2014).
- Aquaro, G. D., Frijia, F., et al. 3D CMR mapping of metabolism by hyperpolarized 13C-pyruvate in ischemia-reperfusion. JACC. Cardiovasc. Imaging. 6 (6), 743-744 (2013).
- Menzel, M. I., Farrell, E. V., et al. Multimodal assessment of in vivo metabolism with hyperpolarized [1-13C]MR spectroscopy and 18F-FDG PET imaging in hepatocellular carcinoma tumor-bearing rats. J. Nucl. Med. 54 (7), 1113-1119 (2013).
- Schilling, F., Duwel, S., et al. Diffusion of hyperpolarized (13) C-metabolites in tumor cell spheroids using real-time NMR spectroscopy. NMR Biomed. 26 (5), 557-568 (2013).
- Schulte, R. F., Sperl, J. I., et al. Saturation-recovery metabolic-exchange rate imaging with hyperpolarized [1-13C] pyruvate using spectral-spatial excitation. Magn. Reson. Med. 69 (5), 1209-1216 (2013).
- Wiesinger, F., Weidl, E., et al. IDEAL spiral CSI for dynamic metabolic MR imaging of hyperpolarized [1-13C]pyruvate. Magn. Reson. Med. 68 (1), 8-16 (2012).
- Wilson, D. M., Keshari, K. R., et al. Multi-compound polarization by DNP allows simultaneous assessment of multiple enzymatic activities in vivo. J. Magn. Reson. 205 (1), 141-147 (2010).
- Schroeder, M. A., Atherton, H. J., et al. Real-time assessment of Krebs cycle metabolism using hyperpolarized 13C magnetic resonance spectroscopy. FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol. 23 (8), 2529-2538 (2009).
- Hurd, R. E., Yen, Y. -. F., et al. Metabolic imaging in the anesthetized rat brain using hyperpolarized [1-13C] pyruvate and [1-13C] ethyl pyruvate. Magn. Reson. Med. 63 (5), 1137-1143 (2010).
- Chen, A. P., Kurhanewicz, J., et al. Feasibility of using hyperpolarized [1-13C]lactate as a substrate for in vivo metabolic 13C MRSI studies. Magn. Reson. Imaging. 26 (6), 721-726 (2008).
- Witney, T. H., Kettunen, M. I., et al. Detecting treatment response in a model of human breast adenocarcinoma using hyperpolarised [1-(13)C]pyruvate and. Br. J. Cancer. 103 (9), 1400-1406 (2010).
- Bohndiek, S. E., Kettunen, M. I., et al. Detecting tumor response to a vascular disrupting agent using hyperpolarized (13)C magnetic resonance spectroscopy. Mol. Cancer Ther. 9 (12), 3278-3288 (2010).
- Gallagher, F. A., Kettunen, M. I., et al. Production of hyperpolarized [1,4-13C2]malate from [1,4-13C2]fumarate is a marker of cell necrosis and treatment response in tumors. Proc. Natl. Acad. Sci. U. S. A. 106 (47), 19801-19806 (2009).
- Jensen, P. R., Peitersen, T., et al. Tissue-specific short chain fatty acid metabolism and slow metabolic recovery after ischemia from hyperpolarized NMR in vivo. J. Biol. Chem. 284 (52), 36077-36082 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Magnetic resonance imaging of pH in vivo using hyperpolarized 13C-labelled bicarbonate. Nature. 453 (7197), 940-943 (2008).
- Scholz, D. J., Janich, M. A., et al. Quantified pH imaging with hyperpolarized 13C-bicarbonate. Magn. Reson. Med. 73 (6), 2274-2282 (2015).
- Koellisch, U., Gringeri, C. V., et al. Metabolic imaging of hyperpolarized [1-(13) C]acetate and [1-(13) C]acetylcarnitine – investigation of the influence of dobutamine induced stress. Magn. Reson. Med. 74 (4), 1011-1018 (2015).
- Koellisch, U., Laustsen, C., et al. Investigation of metabolic changes in STZ-induced diabetic rats with hyperpolarized [1-13C]acetate. Physiol. Rep. 3 (8), (2015).
- Jensen, P. R., Meier, S., Ardenkjaer-Larsen, J. H., Duus, J. O., Karlsson, M., Lerche, M. H. Detection of low-populated reaction intermediates with hyperpolarized NMR. Chem. Commun. (34), 5168-5170 (2009).
- Koelsch, B. L., Keshari, K. R., Peeters, T. H., Larson, P. E. Z., Wilson, D. M., Kurhanewicz, J. Diffusion MR of hyperpolarized 13C molecules in solution. Analyst. 138 (4), 1011-1014 (2013).
- Golman, K., Ardenkjaer-Larsen, J. H., Petersson, J. S., Mansson, S., Leunbach, I. Molecular imaging with endogenous substances. Proc. Natl. Acad. Sci. U. S. A. 100 (18), 10435-10439 (2003).
- von Morze, C., Larson, P. E. Z., et al. Imaging of Blood Flow Using Hyperpolarized [(13)C]Urea in Preclinical Cancer Models. J. Magn. Reson. Imaging. 33 (3), 692-697 (2011).
- Chiavazza, E., Kubala, E., et al. Earth’s magnetic field enabled scalar coupling relaxation of 13C nuclei bound to fast-relaxing quadrupolar 14N in amide groups. J. Magn. Reson. 227, 35-38 (2013).
- Jensen, P. R., Karlsson, M., Meier, S., Duus, J., Lerche, M. H. Hyperpolarized amino acids for in vivo assays of transaminase activity. Chem. – A Eur. J. 15 (39), 10010-10012 (2009).
- Gallagher, F. A., Kettunen, M. I., et al. Detection of tumor glutamate metabolism in vivo using 13C magnetic resonance spectroscopy and hyperpolarized [1-13C]glutamate. Magn. Reson. Med. 66 (1), 18-23 (2011).
- Chaumeil, M. M., Larson, P. E. Z., et al. Hyperpolarized [1-13C] glutamate: a metabolic imaging biomarker of IDH1 mutational status in glioma. Cancer Res. 74 (16), 4247-4257 (2014).
- Keshari, K. R., Wilson, D. M. Chemistry and biochemistry of 13C hyperpolarized magnetic resonance using dynamic nuclear polarization. Chem. Soc. Rev. 43 (5), 1627-1659 (2014).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Transl. Med. 5 (198), (2013).
- Warburg, O. On the origin of cancer cells. Science. 123 (3191), 309-314 (1956).
- Warburg, O., Wind, F., Negelein, E. {Ü}ber den Stoffwechsel von Tumoren im K{ö}rper. Klin. Wochenschr. 5 (19), 829-832 (1926).
- Barnes, A. B., De Paepe, G., et al. High-Field Dynamic Nuclear Polarization for Solid and Solution. Biological NMR. Appl. Magn. Reson. 34 (3-4), 237-263 (2008).
- Koukourakis, M. I., Giatromanolaki, A., Sivridis, E., Gatter, K. C., Harris, A. L. Pyruvate dehydrogenase and pyruvate dehydrogenase kinase expression in non small cell lung cancer and tumor-associated stroma. Neoplasia. 7 (1), 1-6 (2005).
- Golman, K., Petersson, J. S. Metabolic Imaging and Other Applications of Hyperpolarized 13C1. Acad. Radiol. 13 (8), 932-942 (2016).
- Golman, K., Petersson, J. S., et al. Cardiac metabolism measured noninvasively by hyperpolarized 13C MRI. Magn. Reson. Med. 59 (5), 1005-1013 (2008).
- Merritt, M. E., Harrison, C., Storey, C., Jeffrey, F. M., Sherry, A. D., Malloy, C. R. Hyperpolarized 13C allows a direct measure of flux through a single enzyme-catalyzed step by NMR. Proc. Natl. Acad. Sci. U. S. A. 104 (50), 19773-19777 (2007).
- Merritt, M. E., Harrison, C., Storey, C., Sherry, A. D., Malloy, C. R. Inhibition of carbohydrate oxidation during the first minute of reperfusion after brief ischemia NMR detection of hyperpolarized 13CO2 and H13CO3-. Magn. Reson. Med. 60 (5), 1029-1036 (2008).
- Hu, S., Chen, A. P., et al. In vivo carbon-13 dynamic MRS and MRSI of normal and fasted rat liver with hyperpolarized 13C-pyruvate. Mol. imaging Biol. MIB Off. Publ. Acad. Mol. Imaging. 11 (6), 399-407 (2009).
- Kohler, S. J., Yen, Y., et al. In vivo 13 carbon metabolic imaging at 3T with hyperpolarized 13C-1-pyruvate. Magn. Reson. Med. 58 (1), 65-69 (2007).
- Hu, S., Lustig, M., et al. 3D compressed sensing for highly accelerated hyperpolarized (13)C MRSI with in vivo applications to transgenic mouse models of cancer. Magn. Reson. Med. 63 (2), 312-321 (2010).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of cancer metabolism by imaging hyperpolarized nuclei: prospects for translation to clinical research. Neoplasia. 13 (2), 81-97 (2011).
- Schroeder, M. A., Cochlin, L. E., Heather, L. C., Clarke, K., Radda, G. K., Tyler, D. J. In vivo assessment of pyruvate dehydrogenase flux in the heart using hyperpolarized carbon-13 magnetic resonance. Proc. Natl. Acad. Sci. U. S. A. 105 (33), 12051-12056 (2008).
- Zierhut, M. L., Yen, Y. -. F., et al. Kinetic modeling of hyperpolarized 13C1-pyruvate metabolism in normal rats and TRAMP mice. J. Magn. Reson. 202 (1), 85-92 (2010).
- Dennis, L. K., Resnick, M. I. Analysis of recent trends in prostate cancer incidence and mortality. Prostate. 42 (4), 247-252 (2000).
- Jambor, I., Borra, R., et al. Functional imaging of localized prostate cancer aggressiveness using 11C-acetate PET/CT and 1H-MR spectroscopy. J. Nucl. Med. 51 (11), 1676-1683 (2010).
- Presti, J. C. J., Hricak, H., Narayan, P. A., Shinohara, K., White, S., Carroll, P. R. Local staging of prostatic carcinoma: comparison of transrectal sonography and endorectal MR imaging. AJR. Am. J. Roentgenol. 166 (1), 103-108 (1996).
- Schulte, R. F., Sacolick, L., et al. Transmit gain calibration for nonproton MR using the Bloch-Siegert shift. NMR Biomed. 24 (9), 1068-1072 (2011).
- Durst, M., Koellisch, U., et al. Comparison of acquisition schemes for hyperpolarised (1)(3)C imaging. NMR Biomed. 28 (6), 715-725 (2015).
- Janich, M. A., Menzel, M. I., et al. Effects of pyruvate dose on in vivo metabolism and quantification of hyperpolarized (1)(3)C spectra. NMR Biomed. 25 (1), 142-151 (2012).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13 C NMR. NMR Biomed. 25 (11), 1286-1294 (2012).
- Gómez Damián, P. A., Sperl, J. I., et al. Multisite Kinetic Modeling of (13)C Metabolic MR Using [1-(13)C]Pyruvate. Radiol. Res. Pract. 2014, (2014).
- Talbot, J. -. N., Gutman, F., et al. PET/CT in patients with hepatocellular carcinoma using [(18)F]fluorocholine: preliminary comparison with [(18)F]FDG PET/CT. Eur. J. Nucl. Med. Mol. Imaging. 33 (11), 1285-1289 (2006).
- Reeder, S. B., Pineda, A. R., et al. Iterative decomposition of water and fat with echo asymmetry and least-squares estimation (IDEAL): application with fast spin-echo imaging. Magn. Reson. Med. 54 (3), 636-644 (2005).
- Laustsen, C., Ostergaard, J. A., et al. Assessment of early diabetic renal changes with hyperpolarized [1-(13) C]pyruvate. Diabetes. Metab. Res. Rev. 29 (2), 125-129 (2013).
- Serrao, E. M., Brindle, K. M. Potential Clinical Roles for Metabolic Imaging with Hyperpolarized [1-(13)C]Pyruvate. Front. Oncol. 6, 59 (2016).

