نظام ميكروفلويديك مع الزخرفة السطحية للتحقيق فقاعة التجويف (ق) التفاعل -Cell وBioeffects الناتجة على مستوى وحيدة الخلية
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
في هذه المخطوطة، علينا أولا وصف بروتوكول تصنيع رقاقة ميكروفلويديك، مع نقاط الذهب والمناطق المغلفة فبرونيكتين على الركيزة الزجاج نفسها، التي تسيطر على وجه التحديد توليد فقاعات جنبا إلى جنب والخلايا الفردية نمط قريب مع مواقع محددة جيدا والأشكال. نحن ثم تثبت توليد فقاعات جنبا إلى جنب باستخدام اثنين من الليزر نابض إلقاء الضوء على زوج من النقاط الذهبية بزمن تأخير بضعة-ميكروثانية. نحن تصور التفاعل فقاعة فقاعة وتشكيل الطائرة من قبل التصوير فائق السرعة وتميز مجال تدفق الناتجة باستخدام السرعة بواسطة الصور الملتقطة للجسيمات (التعريف الشخصية). وأخيرا، فإننا نقدم بعض تطبيقات هذه التقنية لتحليل خلية واحدة، بما في ذلك خلايا الغشاء poration مع امتصاص جزيء، محلية تشوه غشاء يحددها النزوح من الخرز ملزم إنتغرين المرفقة، والاستجابة الكالسيوم داخل الخلايا من التصوير ratiometric. نتائجنا تظهر أن تدفق النفث السريع والاتجاه هو للمحترفينالتي تنتجها التفاعل جنبا إلى جنب فقاعة، والتي يمكن فرض إجهاد القص المترجمة للغاية على سطح خلية نمت على مقربة. وعلاوة على ذلك، bioeffects مختلفة يمكن أن يتسبب من خلال تغيير قوة تدفق النفث عن طريق ضبط المسافة المواجهة من الخلية إلى فقاعات جنبا إلى جنب.
Introduction
هناك اعتراف متزايد بأن عدم التجانس الخلوية، الناشئة عن التعبير العشوائية من الجينات والبروتينات، والأيض، يوجد ضمن مجموعة من السكان خلية كبيرة وبمثابة المبدأ الأساسي في علم الأحياء للسماح للتكيف الخلية وتطورها 1. لذلك، غالبا ما يكون غير دقيق ولا يمكن الاعتماد عليها لاستخدام القياسات معظم السكان على أساس لفهم وظيفة الخلايا الفردية وتفاعلاتها. تطوير تقنيات جديدة لتحليل خلية واحدة ولذلك من فائدة عالية في الأبحاث البيولوجية والدوائية، ويمكن استخدامها، على سبيل المثال، لفهم أفضل لمسارات الإشارات الرئيسية وعمليات بيولوجية الخلايا الجذعية وعلاج السرطان 2-4. في السنوات الأخيرة، وظهور منصات ميكروفلويديك سهلت كثيرا تحليل وحيدة الخلية، حيث أجريت لتحديد المواقع، والعلاج، ومراقبة الاستجابة من الخلايا الفردية مع استراتيجيات تحليلية جديدة 5.
يلعب التجويف دورا هاما في مجموعة متنوعة من التطبيقات الطبية الحيوية، بما في ذلك علاج السرطان من خلال كثافة عالية تركز الموجات فوق الصوتية (HIFU) 6، وتجزئة غير الغازية من حصى الكلى التي كتبها موجة صدمة تفتيت الحصوات (SWL) 7، المخدرات أو الجينات تسليم بواسطة صوتنة الخلايا 8، وتدمير ذكرت مؤخرا من الخلايا أو الأنسجة الهيدروديناميكية 9،10 فقاعة التجويف. على الرغم من هذا، والعمليات الديناميكية للفقاعة التجويف (ق) التفاعل مع الأنسجة البيولوجية والخلايا لم يتم فهمها جيدا. ويرجع ذلك إلى العشوائية في التجويف بدء وفقاعة ديناميات المنتجة بواسطة الموجات فوق الصوتية، وموجات الصدمة، والضغط الهيدروليكي المحلي هذا. علاوة على ذلك، هناك نقص تمكين التقنيات لحل استجابات معقدة بطبيعتها وسريعة من الخلايا البيولوجية، وخاصة على مستوى خلية واحدة.
وبسبب هذه التحديات، فإنه ليس من المستغرب أن دراسات قليلة جدا لها النحلذكرت ن للتحقيق في التفاعلات فقاعة خلية تحت ظروف تجريبية تسيطر عليها بشكل جيد. على سبيل المثال، غشاء poration من الخلايا الفردية محاصرين في تعليق 11 ولقد ثبت تشوه كبير من خلايا الدم الحمراء في الانسان 12 التسرع باستخدام الفقاعات واحدة ولدت ليزر في قنوات ميكروفلويديك. هذه التقنية الأخيرة، ومع ذلك، يمكن أن تنتج فقط تشوه صغير جدا في الخلايا حقيقية النواة بسبب وجود نواة 13. وعلاوة على ذلك، فإنه من الصعب رصد bioeffects المصب عند معالجة الخلايا في تعليق. في دراسات أخرى، تم الإبلاغ عن الموجات فوق الصوتية الإثارة من متجهة خلية microbubble (أو وكيل الموجات فوق الصوتية على النقيض) لإنتاج poration الغشاء و / أو ردود الكالسيوم داخل الخلايا في الخلايا الملتصقة واحدة 8. غشاء poration من الخلايا الملتصقة واحدة يمكن أيضا أن تنتج عن طريق استخدام فقاعات جنبا إلى جنب ولدت ليزر في طبقة السائل رقيقة تحتوي على امتصاص ضوء التريبان حل الأزرق 14، أوقبل فقاعة غاز تتأرجح الناتجة عن نبضات الليزر ميكروثانية اضاءة من خلال الركيزة استيعاب بصريا في microchambers 15. بالمقارنة، الركيزة استيعاب بصريا لديها ميزة على التريبان حل الزرقاء تمتص الليزر لأن هذه الأخيرة هي سامة على الخلايا. الأهم من ذلك، فقاعات ولدت ليزر هي أكثر يمكن السيطرة عليها من حيث حجم فقاعة، والمكان من فقاعات متحمس سمعيا. ومع ذلك، في كل هذه الدراسات السابقة، لم تسيطر على شكل الخلية، والتوجه، وشروط الانضمام التي قد تؤثر بشكل كبير على استجابة الخلايا وbioeffects التي تنتجها الضغوط الميكانيكية 16.
للتغلب على هذه العوائق في الدراسات السابقة، وقد وضعنا مؤخرا نظام تجريبي لتوليد فقاعة، الزخرفة الخلية، والتفاعلات فقاعة فقاعة خلايا، في الوقت الحقيقي واختبارات بيولوجية من استجابة الخلايا في شريحة ميكروفلويديك شيدت باستخدام مزيج فريد من ميتاليك التصنيع الدقيقiques. ثلاثة السمات الرئيسية التي تميز نظام تجريبي لدينا من الآخرين في هذا المجال هي: 1) الزخرفة من النقاط الذهب ميكرون الحجم على الركيزة الزجاج لتمكين امتصاص الليزر الموضعي لتوليد فقاعة 17؛ 2) الزخرفة من الجزر ميكرون الحجم من المصفوفة خارج الخلية (ECM) للالتصاق الخلية على الركيزة نفسه للسيطرة على كل من الموقع وهندسة الخلايا الفردية. و3) ضغط البعد عن مجال التفاعل فقاعة فقاعة خلية من 3D إلى الفضاء 2D شبه لتسهيل التصور في الطائرة من التفاعلات فقاعة فقاعة، النفث مجالات التدفق، تشوه الخلايا، وbioeffects، كل المأسورة في واحد تسلسل التصوير مبسط (1D الشكل).
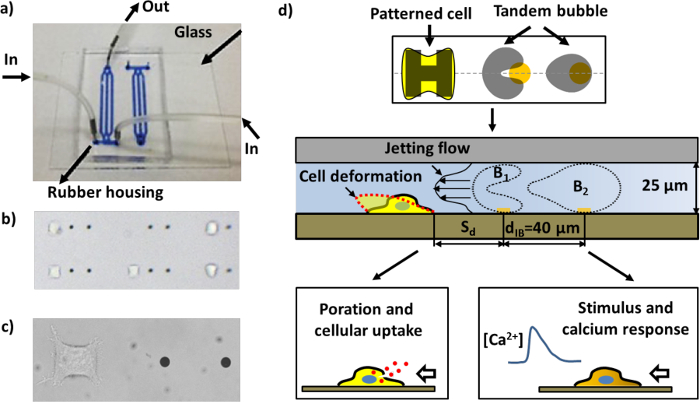
الشكل 1: رقاقة ميكروفلويديك والخطط من فحوصات مختلفة. أ) رقاقة ميكروفلويديك تجميعها مع قنوات مليئة بالحبر الأزرق التصور. ب) المنطقة داخل رقاقة ميكروفلويديك مع خلايا المزخرفة والنقاط الذهب (المسافة بين النقاط ذهبيتين في القرب هو 40 ميكرون). العديد من الأزواج من وحدات العمل يمكن ترتيبها في القناة. ج) عن قرب صورة وحدة عمل واحدة تتكون من زوج من النقاط الذهبية وخلية هيلا انضمت إلى المنطقة خلية الزخرفة. د) تخطيطي لعملية الجهاز. خلية واحدة تلتزم وينتشر على "H" جزيرة على شكل المغلفة مع فبرونيكتين. ويتم إنتاج زوج من فقاعات التجويف (جنبا إلى جنب فقاعة) مع المضادة للمرحلة التذبذب التي كتبها إلقاء الضوء على أشعة الليزر نابض على النقاط الذهب (انظر الشكل 4A)، مما يؤدي إلى توليد طائرة سريعة والمحلية تتجه نحو الخلية المستهدفة في مكان قريب. قد تكون مشوهة الخلية، porated لامتصاص الجزيئات، و / أو حفز مع استجابة الكالسيوم، تبعا للمسافة المواجهة (S د) من الخلية إلى فقاعة جنبا إلى جنب.و = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg" الهدف = "_ فارغة"> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
هذا البرنامج يمكن زيادة جنبا إلى جنب مع فحوصات مضان والخرز functionalized تعلق على سطح الخلية لbioeffects الناجم عن التجويف. على وجه الخصوص، هذه المنصة تفتح الطريق لفحوصات موثوقة وقابلة للقياس على مستوى خلية واحدة. حتى الآن، وقد استخدمنا جهاز لتحليل الناجم عن فقاعة، جنبا إلى جنب تشوه غشاء الخلية، poration الخلية وامتصاص الخلايا، والسلامة، موت الخلايا المبرمج، والاستجابة الكالسيوم داخل الخلايا. في بروتوكول التالية، ونحن وصف عملية رقاقة تلفيق وإجراءات لتحليل مختلف bioeffects المذكورة أعلاه. وعلاوة على ذلك، تم وصفها أيضا عمليات رقاقة.
Protocol
Representative Results
Discussion
تحليل وحيدة الخلية، بالاشتراك مع التصوير الخلية الحية، وتتعزز بشكل كبير من فهمنا للعمليات ديناميكية ومتغيرة في كثير من الأحيان في الخلايا الفردية، مثل تطوير النمط الظاهري والاستجابة المناعية 23. وعلى النقيض من زراعة الخلايا التقليدية في أطباق أو قوارير، تمكن …
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
References
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

