Een microfluïdische systeem met patronen aan oppervlakken voor het onderzoeken van Cavitatie Bubble (s)-cel interactie en de daaruit voortvloeiende Bioeffects bij de single-cell niveau
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
In dit manuscript beschrijven we eerst de vervaardiging protocol van een microfluïdische chip met goud dots en fibronectine gecoate gebieden op hetzelfde glassubstraat, dat het genereren van tandem bellen en individuele cellen buurt patroon met goed gedefinieerde locaties en vormen nauwkeurig regelt. Vervolgens tonen de vorming van luchtbellen tandem door twee lasers verlichten van een paar gouden stippen met enkele microseconde vertraging. We visualiseren de bubble-bubble interactie en de vorming van jet door high-speed imaging en karakteriseren van de resulterende stroom veld met behulp van particle image velocimetry (PIV). Tenslotte geven we een aantal toepassingen van deze techniek voor enkele cel analyse, inclusief celmembraan poratie met macromolecuul opname gelokaliseerde deformatie membraan bepaald door de verplaatsingen van de bijgevoegde integrine-bindende kralen en intracellulair calcium reactie van ratiometrische beeldvorming. Onze resultaten tonen aan dat een snelle en gerichte jetting stroming progeproduceerd door de tandem bubble interactie, die een sterk gelokaliseerde schuifspanning kunnen opleggen aan het oppervlak van een cel gekweekt in de nabijheid. Bovendien kunnen er verschillende bioeffects worden geïnduceerd door het veranderen van de sterkte van de stroming jetting door instelling van de afstandsmeting van de cel tandem bubbels.
Introduction
Er is een groeiend besef dat de cellulaire heterogeniteit, die voortvloeien uit de stochastische expressie van genen, eiwitten en metabolieten, bestaat binnen een grote cel populatie en dient als een fundamenteel principe in de biologie mogelijk te maken voor mobiele aanpassing en evolutie 1. Daarom is het vaak onnauwkeurig en onbetrouwbaar populatie gebaseerde bulk metingen gebruiken om de functie van individuele cellen en hun interacties te begrijpen. Ontwikkeling van nieuwe technologieën eencellige analyse is daarom van groot belang in biologisch en farmacologisch onderzoek en kan worden gebruikt, bijvoorbeeld om beter de sleutel signaalwegen en processen stamcel biologie en kankertherapie 2-4. De laatste jaren heeft de opkomst van microfluïdische platforms aanzienlijk vergemakkelijkt single-cell analyse, waarbij de positionering, behandeling en observatie van de reactie van individuele cellen uitgevoerd met nieuwe analysestrategieën 5.
Cavitatie speelt een belangrijke rol in een brede waaier van biomedische toepassingen, met inbegrip van de behandeling van kankers door high-intensity focused ultrasound (HIFU) 6, de non-invasieve versnippering van nierstenen door schokgolf lithotripsy (SWL) 7, geneesmiddel of gentherapie door sonoporatie 8, en de onlangs gerapporteerde vernietiging van cellen of weefsels door hydrodynamische cavitatie zeepbel 9,10. Desondanks hebben de dynamische processen van cavitatiebel (s) interactie met biologisch weefsel en cellen niet goed begrepen. Dit komt door de willekeur cavitatie initiatie en beldynamica door ultrageluid, schokgolven en plaatselijke hydraulische druk; bovendien is er een gebrek aan technieken waarmee de inherent complexe en snelle reacties van biologische cellen te lossen, vooral bij de enkele-celniveau.
Vanwege deze problemen, is het niet verwonderlijk dat heel weinig studies hebben been gemeld aan bubble-cel interacties onder goed gecontroleerde experimentele omstandigheden te onderzoeken. Bijvoorbeeld membraan perforeren van afzonderlijke cellen in suspensie gevangen 11 en de impulsieve grote deformatie van rode bloedcellen humane 12 aangetoond met behulp van laser opgewekte interne bellen in microkanalen. Deze laatste techniek is echter, kan slechts zeer geringe vervorming in eukaryotische cellen door de aanwezigheid van de kern 13. Bovendien is het moeilijk om downstream bioeffects controleren bij de behandeling van cellen in suspensie. In andere studies is ultrasone excitatie van een celgebonden microbelletjes (of ultrageluid contrastmiddel) voor het membraan poratie en / of intracellulair calcium reacties in één hechtende cellen gerapporteerd 8. Membraan perforeren van één hechtende cellen kunnen ook worden geproduceerd door laser gegenereerde tandem bellen in een dunne vloeistoflaag die lichtabsorberende trypan blauwe oplossing 14 ofdoor een oscillerende gasbel gegenereerd door microseconde laserpulsen bestralen door middel van een optisch absorberende substraat in 'counter 15. In vergelijking, de optisch absorberende substraat heeft een voordeel ten opzichte van de laser-absorberende trypan blauwe oplossing omdat deze is giftig voor cellen. Wat nog belangrijker is, laser-gegenereerde bubbels zijn beter controleerbaar in termen van de zeepbel van de grootte en locatie dan akoestisch opgewonden bubbels. Niettemin, in al deze eerdere studies, de cel vorm, oriëntatie en adhesie omstandigheden werden niet gecontroleerd, die in hoofdzaak de cel respons en bioeffects geproduceerd door mechanische spanningen 16 kan beïnvloeden.
Deze nadelen in eerdere studies overwinnen, hebben we onlangs ontwikkelde een experimenteel systeem voor vorming van belletjes, cel patronen, bel-bel-cel interacties en real-time bioassays van celrespons in een microfluïdische chip geconstrueerd door een unieke combinatie van microfabricage techniques. Drie belangrijke kenmerken die ons experimenteel systeem te onderscheiden van anderen in het gebied zijn: 1) de patroonvorming van microscopisch kleine gouden stippen op het glassubstraat gelokaliseerde laser absorbeert, vorming van belletjes 17 mogelijk te maken; 2) de patroonvorming van microscopisch kleine eilanden extracellulaire matrix (ECM) voor celhechting op hetzelfde substraat aan zowel de locatie en de vorm van individuele cellen te controleren; en 3) het samenpersen van de afmeting van de bel-bel-celinteractie domein van 3D naar een quasi-2D speelt in het vlak visualisatie van bubble-bubble interacties te vergemakkelijken, spuiten stroomvelden, celvervorming en bioeffects, alle meegenomen in een gestroomlijnde beeldvorming sequentie (figuur 1d).
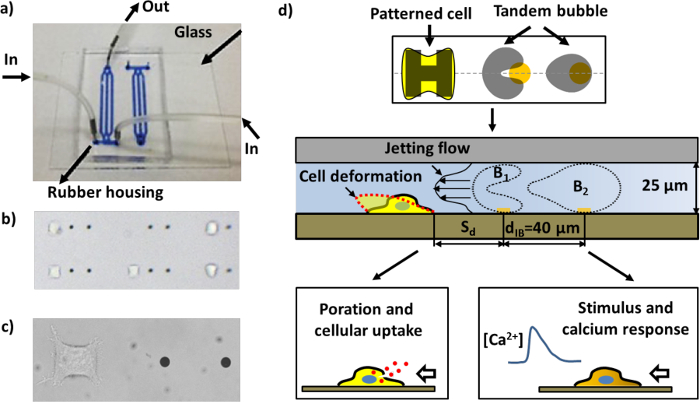
Figuur 1: De microfluïdische chip en schema's van verschillende assays. a) een samengestelde microfluïdische chip met kanalen gevuld met blauwe inkt voor visualisatie. b) Een regio binnen de microfluïdische chip met gevormde cellen en gouden stippen (de afstand tussen de twee gouden stippen in de nabijheid is 40 pm). Vele paren werkeenheden kunnen worden aangebracht in een kanaal. c) Close-up beeld van een enkele werkeenheid die bestaat uit een paar gouden stippen en een HeLa cel gehecht aan het cel-patronen regio. d) Schema van de bedieningsinrichting. Een enkele cel hecht aan en zich in het "H" -vormige eiland bedekt met fibronectine. Een paar cavitatiebubbels (tandem bubble) met tegenfase trilling worden geproduceerd door verlichten gepulste laserstralen op de gouden stippen (zie figuur 4a), wat leidt tot de vorming van een snelle en gelokaliseerde jet naar de beoogde cel buurt. De cel kan worden vervormd nomen voor macromoleculaire opname en / of gestimuleerd met calcium respons, afhankelijk van de afstandsmeting (Sd) van de cel om de tandem bubble.f = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg" target = "_ blank"> Klik hier om een grotere versie van deze figuur te bekijken.
Dit platform kan verder gecombineerd worden met fluorescentie- assays en gefunctionaliseerde kralen bevestigd aan het celoppervlak voor cavitatie geïnduceerde bioeffects. Vooral dit platform schept voor betrouwbare en kwantificeerbare assays bij de enkele-celniveau. Tot nu toe hebben we de inrichting voor de analyse van tandem bubble-geïnduceerde celmembraan vervorming cel poratie en intracellulaire opname, levensvatbaarheid, apoptose en intracellulair calcium respons. In de onderstaande voorschriften beschrijven we het proces-chips en de procedure voor het analyseren van verschillende bioeffects bovengenoemde. Bovendien worden de bewerkingen van de chip ook beschreven.
Protocol
Representative Results
Discussion
Eencellige analyse, in combinatie met live-cell imaging, is sterk verbeterd ons begrip van de dynamische en vaak variabele processen in afzonderlijke vakken, zoals fenotype ontwikkeling en immuunrespons 23. In tegenstelling tot de conventionele celkweek in schotels of flacons, microfluïdische systemen maken nauwkeurige regeling van de micro-omgeving naar de enkelvoudige-celniveau, in real time. Bijgevolg, de vooruitgang in microfluïdische technologie en technieken zijn grotendeels de doorvoer en reproduceer…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
References
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

