Sublimation af DAN Matrix til påvisning og Visualisering af Gangliosider i Rat Brain Tissue for MALDI Imaging massespektrometri
Summary
A protocol for the sublimation of DAN matrix onto rat brain tissue for the detection of gangliosides using MALDI Imaging Mass Spectrometry is presented.
Abstract
Prøve forberedelse er nøglen til optimal detektion og visualisering af analytter i Matrix-assisteret laser desorption / ionisering (MALDI) Imaging massespektrometri (IMS) eksperimenter. Fastsættelse af passende protokol til at følge hele prøven forberedelse proces kan være svært som hvert trin skal være optimeret til at opfylde de unikke kendetegn ved de analytter af interesse. Denne proces indebærer ikke kun at finde en kompatibel matrix, der kan desorbere og ionisere molekylerne af interesse effektivt, men også at vælge den rette matrix deposition teknik. For eksempel en våd matrix deposition teknik, som indebærer opløsning af en matrix i opløsningsmiddel, er overlegen til desorption af de fleste proteiner og peptider, hvorimod tørre matrix aflejringsteknikker er særligt effektive til ionisering af lipider. Sublimering er blevet rapporteret som en meget effektiv metode til tør matrix deposition til påvisning af lipider i væv ved MALDI IMS grundet homogeneity matrix krystal deposition og minimal analyt flytning sammenlignet med mange våddeposition metode 1, 2. I store træk det indebærer at placere en prøve og pulveriseret matrix i et vakuum-forseglet kammer med prøverne presset mod en kold overflade. Apparatet sænkes derefter ned i et opvarmet bad (sand eller olie), hvilket resulterer i sublimering af den pulverformige matrix på den afkølede vævsprøve overflade. Her beskriver vi en sublimering protokol ved at anvende 1,5-diaminonaphthalen (DAN) matrix til påvisning og visualisering af gangliosider i rottehjernen ved brug MALDI IMS.
Introduction
Matrix-assisteret laser desorption / ionisering (MALDI) Imaging massespektrometri (IMS) er ved at blive en meget efterspurgt teknik til visualisering af den rumlige fordeling af lipider, peptider og proteiner tværs intakte prøve overflader. MALDI IMS var tidligere kendt som analytisk teknik til præ-oprenset analytter, men i de senere år er det blevet opmærksom på mange andre discipliner grund af evnen til at kombinere nøjagtigheden af massespektrometri med høj opløsning visuelle / anatomiske referencepunkter uden brug for nogen ekstern mærkning. Da den videnskabelige pulje af forskere udnytter denne teknik fortsætter med at vokse, er der øget behov for standardiserede, let at følge protokoller til at bistå med udvikling og optimering af IMS eksperimenter. Gangliosider, en gruppe af membranlipider høj hyppighed i centralnervesystemet, er ideelle til MALDI IMS eksperimenter som deres placering, indlejret i membranen, gør visse species umuligt at opdage anvendelse af konventionel Immuno-mærkning. Derudover har vi vist, ved hjælp af MALDI IMS, at disse lipider, der fungerer som modulatorer af cellesignalering, bl.a. har unikke anatomiske fordeling mønstre i sunde gnaver hjernen, der er ændret efter hjerneskade 3, 4, 5. Gangliosider er placeret på et højere masseinterval sammenlignet med de fleste lipidarter, og er således mest egnet til MALDI billeddannelse platform.
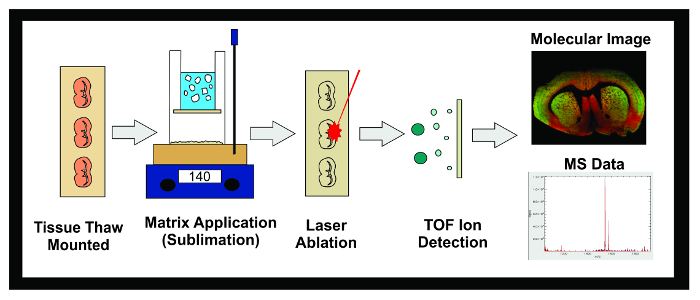
Figur 1: Workflow af MALDI IMS Experiment. Diagram af den overordnede arbejdsgang af en MALDI IMS eksperiment ved hjælp sublimering. Væv frosset ved -80 ° C er opdelt i en kryostat og 10 um sektioner er tø monteret på ledende ITO objektglas. Objektglasset anbringes derefter i et tørreapparat indtil sublimering. Slides indsættes i sublimation apparat og et jævnt lag matrix påføres vævsprøven overflade. Prøver fryses natten over i en -20 ° C fryser derefter placeret i en ekssikkator i 10 minutter. Når standarder er blevet anvendt, er prøverne indsat i MALDI instrument, hvor en laser er rettet på tværs af vævet forårsager desorberede molekyler i matrixen til at ionisere. Ionerne rejse ned en flyvning rør og separat baseret på deres masse (time-of-flight / TOF) indtil de når detektoren. Oplysningerne om den ioniske overflod af analytter inden for et forudbestemt masse-til-ladningsforhold (m / z) område vises som både en molekylær billede og massespektrum. Disse data kan anvendes til både at visualisere og kvantificere den ioniske overflod af analytten af interesse i det afbildede væv. Klik her for at se en større version af dette tal.
Prøveforberedelsefor MALDI IMS varierer meget som hvert trin i processen skal tilpasses til de analytter af interesse. Det afgørende træk ved MALDI-baserede eksperimenter er anvendelsen af en matrix coating aflejret på prøveoverfladen inden analyse. Ud over den rolle absorbere og overføre stråling energi fra laseren under ablationsprocessen matrixen tjener også til at isolere forskellige analytter fra prøven, hvilket letter analysen af forbindelser af interesse 6, 7. Ensartet anvendelse af matricen til prøven overflade er det mest afgørende skridt i prøven forberedelsesprocessen. Forkert matrixdeponering kan føre til store heterogene matrix krystal formationer og udvikling af artefakter, lav ion-signal og dårlig reproducerbarhed 7.
På grund af affiniteten af visse matricer til isolering specifikke analytter, typen af matrix er valgt til et eksperiment kanvæsentlig grad ændre udfaldet. Matricerne anvendt til billeddannelse af proteiner og peptider afviger ofte fra dem, der anvendes til billeddannelse af lipider og processen kompliceres yderligere af behovet for yderligere procedurer såsom vaske- og rehydrering trin for at kunne detektere signaler fra væv. Selvom der findes vasketrin til forbedring af lipid-signaler 8, de er ikke en forudsætning for påvisning af de fleste lipid arter. Ved valg en matrix til et lipid afbildningseksperiment, er det vigtigt at overveje polariteten af lipidet af interesse, da dette vil begrænse antallet af egnede matrixer. For eksempel, gangliosider indeholder sialinsyrerester, som giver dem en samlet negativ polaritet. Der er en række af matricer, der effektivt kan desorbere og ionisere gangliosider fra væv; dog skal tages faktorer såsom matrix-afledte toppe i spektret og stabilitet af matrixen under vakuum under overvejelse. 1,5-diaminonapthalene (DAN) matrix er tilstrækkelig stabil under instrument vakuumbetingelser for størstedelen af billedbehandlingsprogrammer og har vist en høj grad af følsomhed til lipid desorption og kan anvendes til analyse af lipider i både positive og negative ion modes 2. DAN matrix, sammenlignet med andre negative lipid affinitetsmatricer såsom dihydroxybenzoesyre (DHB), 9-aminoacridin (9-AA), og 5-chlor-2-mercaptobenzothiazol (CMBT), var i stand til mest effektivt at desorbere gangliosider fra rottehjerne væv i negativ ion-mode (manuskript under udarbejdelse).
Valg af passende metode matrix deposition er lige så vigtig for valg af matricen selv. Våde matrix deposition fremgangsmåder, hvor den faste matrix er opløst i et organisk opløsningsmiddel, og deponeret af pneumatisk eller automatiserede sprøjter eller observatører, er særligt effektive til desorption af proteiner og peptider som væsken trænger prøven for at tillade ekstraktion af forbindelser og co-krystallisering med matrixen. Selv om disse teknikker også kan anvendes til lipid applikationer, analyt delokalisering og ujævn matrix krystal formationer er almindeligt forekommende på grund af den høje forekomst og opløseligheden af lipider i opløsningsmidler, især i væv 2, 9. Fordi lipider let ioniseres fra væv, tørre matrix deposition teknikker, såsom sublimation, tilbyder en enkel, omkostningseffektivt alternativ til sprøjter mens omgå mange af ulempen ved disse teknikker. Succesen for sublimering i MALDI IMS eksperimenter tilskrives funktioner såsom mikrokrystallinsk matrix morfologi hvilket øger areal for matrix-analyt binding, øget matrix renhed og homogen matrix deposition, der fører til øget reproducerbarhed i forhold til våde matrix teknikker 1, 10.
sublimation involves opvarmning af en pulveriseret matrix under vakuum umiddelbart under en afkølet prøve overflade resulterer i fast stof til gas-faseovergangen af den pulverformige matrix efterfulgt af aflejring på vævsprøven overflade. Under sublimering, kan matrixdeponering styres ved at variere faktorer såsom tid, temperatur og tryk for at tilvejebringe stærkt reproducerbare resultater. En enkelt sublimation eksperiment kan tage alt fra 5 til 20 minutter afhængigt af typen af matrix er valgt, som kan genanvendes flere gange før bortskaffelse. Apparatet kan købes kommercielt til en brøkdel af prisen af automatiserede sprøjter og let adskilles for rengøring og vedligeholdelse. De lave omkostninger og relative enkelhed af denne matrix deposition teknik gør det ideelt for forskere begynder eller ekspanderende på lipid billedbehandlingsprogrammer i MALDI IMS. Selvom information detaljering protokoller for sublimering af væv til IMS er blevet rapporteret 11, findes w par standardiserede protokollerhich fokusere på den grundlæggende arbejdsgang involveret med udførelse af en sublimering eksperiment til afbildning høj masse lipider i negativ ion-mode, hvilket gør det vanskeligt at fastslå den teknik uden omfattende forsøg-fejl. Følgende er en forsøgsprotokol til formål at afhjælpe denne mangel for sublimering af DAN matrix på rotte hjerne sektioner for høj opløsning billeddannelse og afsløring af gangliosiderne.
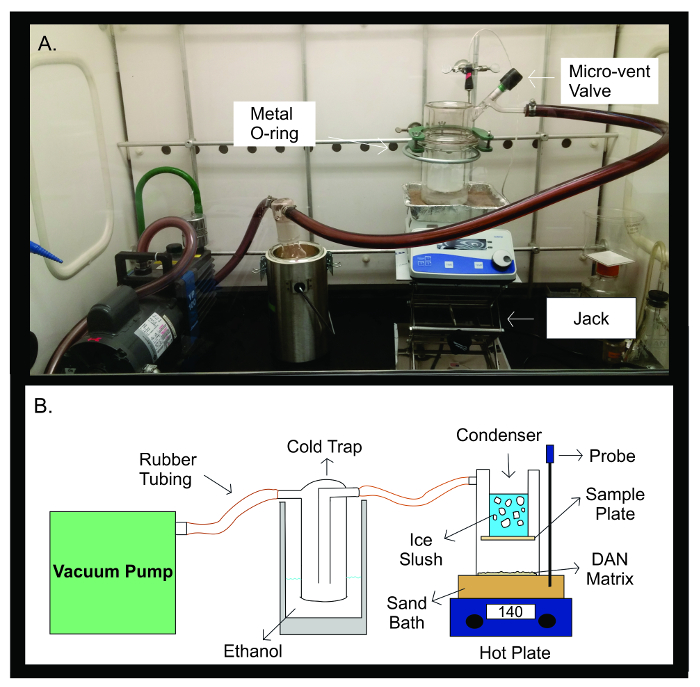
Figur 2: Sublimation Apparatur. Fotografi (A) og skematisk diagram (B) i sublimation apparatet. Vakuumpumpen er forbundet med gummirør til en kold fælde fyldt med 300 ml ethanol. Kuldefælden forbindes derefter ved gummislanger til sublimation apparat. Apparatet består af to separate stykker glasvarer, der er forseglet til hinanden med en metal U-joint. Den øverste halvdel af sublimatorindeholder kondensatoren, som er fyldt med is sjap. Prøven plade tapes på bunden af kondensatoren, inde i forseglede glas apparatet. Den nederste halvdel af sublimering apparatet indeholder DAN matrix, spredt jævnt ud overfor prøveplade. Under sublimation, er apparatet glas anbringes på et sandbad opvarmet til 140 ° C ved en varmeplade direkte under den. Temperaturføleren bidrager til at opretholde en stabil temperatur i hele sublimation eksperiment gennem tilbagemelding af sandet badtemperaturen forhold til den indstillede temperatur til eksperimentet. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Dette arbejde beskriver en standardiseret protokol af matrix sublimation på væv til påvisning af negativt ladede lipider, såsom gangliosider, i MALDI IMS eksperimenter. Prøve forberedelse til MALDI IMS er meget varierende, og skal tilpasses de unikke egenskaber af analyt. Anvendelsen af matrix på vævsprøven overflade er et afgørende aspekt af prøven fremstillingsprocessen med hensyn til kvaliteten af resultaterne i IMS. Særlig forsigtighed bør tages ved valg matricer, der sikrer, at matricen er k…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the technical assistance of Kristina Jurcic in the University of Western Ontario MALDI MS facility, as well as the National Sciences and Engineering Council (NSERC) for funding this work. The authors would also like to acknowledge the Caprioli group (Vanderbilt University, TN) and Chaurand group (Université de Montreal, QC) for their advice in optimizing the sublimation technique presented in this manuscript.
Materials
| Sublimator | Chemglass Life Sciences | CG3038-01 | |
| 1,5- Diaminonapthalene (DAN) matrix | Sigma-Aldrich | D21200 | 100 G |
| Cryostat | Thermo-Fisher Scientific | CryoStar NX50 | |
| Hot plate with temperature feedback | Thermo-Fisher Scientific | HP88857290 | Isotemp ADVD 7×7 HP 100-120v |
| Stainless Steel Jack | Thermo-Fisher Scientific | 2216479 | 10×10 |
| Cold Trap | Custom built on site | ||
| Vacuum Pump | Franklin Electric | 1102180403 | Savant VP100 Two Stage |
| Indium-tin-oxide (ITO) Slides | Hudson Surface Technology | PSI 1111000 | type II, 1.1mm/25 each |
| MALDI TOF/TOF 5800 Instrument | AB Sciex | ||
| Desiccator | Sigma-Aldrich | D2797 | tabletop desiccator |
References
- Hankin, J. A., Barkley, R. M., Murphy, R. C. Sublimation as a method of matrix application for mass spectrometric imaging. J. Am. Soc. Mass Spectrom. 18, 1646-1652 (2007).
- Thomas, A., Charbonneau, J. L., Fournaise, E., Chaurand, P. Sublimation of new matrix candidates for high spatial resolution imaging mass spectrometry of lipids: enhanced information in both positive and negative polarities after 1,5-diaminonapthalene deposition. Anal. Chem. 84, 2048-2054 (2012).
- Caughlin, S., et al. Increased Expression of Simple Ganglioside Species GM2 and GM3 Detected by MALDI Imaging Mass Spectrometry in a Combined Rat Model of Aβ Toxicity and Stroke. PLoS ONE. 10, 0130364 (2015).
- Weishaupt, N., Caughlin, S., Yeung, K., Whitehead, S. Differential Anatomical Expression of Ganglioside GM1 Species Containing d18:1 or d20:1 Sphingosine Detected by MALDI Imaging Mass Spectrometry in Mature Rat Brain. Front Neuroanatomy. 9 (155), (2015).
- Whitehead, S., et al. Imaging Mass Spectrometry Detection of Gangliosides Species in the Mouse Brain following Transient Focal Cerebral Ischemia and Long-Term Recovery. PLoS ONE. 6 (6), 20808 (2011).
- Fuchs, B., Süß, R., Schiller, J. An update of MALDI-TOF mass spectrometry in lipid research. Progress in Lipid Research. 49, 450-475 (2010).
- Barceló-Coblijn, G., Fernández, J. A. Mass spectrometry coupled to imaging techniques: the better the view the greater the challenge. Front Physiol. 6 (3), 1-5 (2015).
- Angel, P. M., Spraggins, J. M., Baldwin, H. S., Caprioli, R. Enhanced sensitivity for high spatial resolution lipid analysis by negative ion mode matrix assisted laser desorption ionization imaging mass spectrometry. Anal. Chem. 84, 1557-1564 (2012).
- Murphy, R. C., Hankin, J. A., Barkley, R. M., Zemski Berry, K. A. MALDI imaging of lipids after matrix sublimation/deposition. Biochim. Biophys. Acta. 1811, 970-975 (2011).
- Jaskolla, T. W., Karas, M., Roth, U., Steinert, K. Comparison between vacuum sublimed matrices and conventional dried droplet preparation in MALDI-TOF mass spectrometry. J. Am. Soc. Mass Spectrom. 20, 1104-1115 (2009).
- O’Rourke, M. B., Raymond, B. B., Djordjevic, S. P., Padula, M. P. A versatile cost-effective method for the analysis of fresh frozen tissue sections via matrix-assisted laser desorption/ionisation imaging mass spectrometry. Rapid Commun. Mass Spectrom. 29, 637-644 (2015).
- Patterson, N. H., Thomas, A., Chaurand, P. Monitoring time-dependent degradation of phospholipids in sectioned tissues by MALDI imaging mass spectrometry. J Mass Spectrom. 49, 622-627 (2014).
- Cheng, H., Sun, G., Yang, K., Gross, R. W., Han, X. Selective desorption/ionization of sulfatides by MALDI-MS facilitated using 9-aminoacridine as matrix. J. Lipid Res. 51, 1599-1609 (2010).
- Puolitaival, S. M., Burnum, K. E., Cornett, D. S., Caprioli, R. M. Solvent-free matrix dry-coating for MALDI imaging of phospholipids. J. Am. Soc. Mass Spectrom. 19, 882-886 (2008).
- Chaurand, P., Cornett, D., Angel, P., Caprioli, R. From Whole-body Sections Down to Cellular Level, Multiscale Imaging of Phospholipids by MALDI Mass Spectrometry. Mol Cell Proteomics. 10, (2011).
- Grove, K. J., Frappier, S. L., Caprioli, R. M. Matrix pre-coated MALDI MS targets for small molecule imaging in tissues. J. Am. Soc. Mass Spectrom. 22, 192-195 (2011).
- Yang, J., Caprioli, R. M. Matrix precoated targets for direct lipid analysis and imaging of tissue. Anal. Chem. 85, 2907-2912 (2013).
- Gemperline, E., Rawson, S., Li, L. Optimization and comparison of multiple MALDI matrix application methods for small molecule mass spectrometric imaging. Anal. Chem. 86, 10030-10035 (2014).

