Multi-stap Variabele Hoogte fotolithografie voor Valved Multilayer microfluïdische apparaten
Summary
Multilayer microfluidic devices often involve the fabrication of master molds with complex geometries for functionality. This article presents a complete protocol for multi-step photolithography with valves and variable height features tunable to any application. As a demonstration, we fabricate a microfluidic droplet generator capable of producing hydrogel beads.
Abstract
Microfluidic systems have enabled powerful new approaches to high-throughput biochemical and biological analysis. However, there remains a barrier to entry for non-specialists who would benefit greatly from the ability to develop their own microfluidic devices to address research questions. Particularly lacking has been the open dissemination of protocols related to photolithography, a key step in the development of a replica mold for the manufacture of polydimethylsiloxane (PDMS) devices. While the fabrication of single height silicon masters has been explored extensively in literature, fabrication steps for more complicated photolithography features necessary for many interesting device functionalities (such as feature rounding to make valve structures, multi-height single-mold patterning, or high aspect ratio definition) are often not explicitly outlined.
Here, we provide a complete protocol for making multilayer microfluidic devices with valves and complex multi-height geometries, tunable for any application. These fabrication procedures are presented in the context of a microfluidic hydrogel bead synthesizer and demonstrate the production of droplets containing polyethylene glycol (PEG diacrylate) and a photoinitiator that can be polymerized into solid beads. This protocol and accompanying discussion provide a foundation of design principles and fabrication methods that enables development of a wide variety of microfluidic devices. The details included here should allow non-specialists to design and fabricate novel devices, thereby bringing a host of recently developed technologies to their most exciting applications in biological laboratories.
Introduction
In de afgelopen 15 jaar heeft microfluidics als een akker snelle groei doorgemaakt, met een explosie van nieuwe technologieën die de manipulatie van vloeistoffen in de micrometer schaal 1. Microfluïde systemen zijn aantrekkelijk platforms voor natte laboratorium functionaliteit omdat de kleine hoeveelheden hebben het potentieel om hogere snelheid en gevoeligheid te realiseren terwijl tegelijkertijd de dramatische toename doorvoer en lagere kosten door gebruik schaalvoordelen 2, 3. Meerlaagse microfluïde systemen zijn bijzonder significant effect in high-throughput biochemische analyses aan zoals single cell analyse 4, 5, 6, enkel molecuul analyse (bijvoorbeeld digitale PCR 7), proteïne kristallografie 8, transcriptiefactor bindingstesten gemaaktf "> 9, 10, 11 en cellulaire screening.
Een centraal doel van microfluïdische is de ontwikkeling van "lab op een chip" inrichtingen die in staat zijn complexe vloeibare manipulaties binnen één apparaat voor biochemische analyse totaal 12 zijn. De ontwikkeling van multi-layer zachte lithografie technieken heeft geholpen realiseren van deze doelstelling doordat creatie van on-chip kleppen, mixers, en pompen voor het actief regelen van vloeistoffen in kleine volumes 13, 14, 15. Ondanks hun voordelen en toepassingen aangetoond Veel van deze microfluidic technologieën blijven grotendeels uitgespannen niet-gespecialiseerde gebruikers. Wijdverbreide toepassing is een uitdaging voor een deel te wijten aan beperkte toegang tot microfabrication faciliteiten, maar ook als gevolg van onvoldoende communicatie van fabricagetechnieken. Dit geldt vooral for multilayer microfluïdische apparaten met structuren voor afsluiters of complexe geometrieën: het gebrek aan gedetailleerde, praktische informatie over belangrijke ontwerp parameters en fabricagetechnieken schrikt vaak nieuwe onderzoekers van het aanbreken van projecten waarbij het ontwerp en de creatie van deze apparaten.
Dit artikel is bedoeld om deze kenniskloof te pakken door het presenteren van een compleet protocol voor het maken van meerlaagse microfluïdische apparaten met kleppen en variabele hoogte functies, vanaf het ontwerp parameters en bewegen door alle fabricage stappen. Door te focussen op de eerste fotolithografie stappen van de fabricatie, dit protocol vormt een aanvulling op andere microfluidics protocollen 16 die stroomafwaarts stappen van het gieten van apparaten van mallen en hardlopen specifieke experimenten te beschrijven.
Microfluïdische inrichtingen met monolithische on-chip kleppen bestaan uit twee lagen: een "flow" laag, waarbij het van belang zijnde fluïdum wordt gemanipuleerd microkanalen, en een "control" laag, waar de microkanalen met lucht of water selectief stroming in de stroom laag 14 kunnen moduleren. Deze twee lagen zijn elk vervaardigd op een afzonderlijke silicium molding meester, die vervolgens voor polydimethylsiloxaan (PDMS) replica vormen wordt gebruikt in een proces dat "zachte lithografie 17." Teneinde een meerlaagse inrichting te vormen, elk van de PDMS lagen omtrent hun respectieve vormen meesters en uitgelijnd met elkaar, waardoor een samengesteld PDMS apparaat met kanalen in elke laag gevormd. Kleppen zijn gevormd op plaatsen waar flow en besturingskanalen elkaar kruisen en zijn gescheiden door slechts een dun membraan; onder druk zetten van het besturingskanaal afbuigt dit membraan aan het stromingskanaal afsluiten en lokaal verplaatsen van de vloeistof (figuur 1).
Actief op-chip kleppen kunnen worden vervaardigd op verschillende manieren, afhankelijk van de gewenste eindtoepassing. Valveskunnen worden geconfigureerd in ofwel een "duw" of "opdrijven" geometrie, naargelang de besturingslaag boven of onder de stroom laag (figuur 1) 15. "Push up" geometrieën mogelijk lagere sluitdrukken en hogere stabiliteit toestel tegen delaminatie, terwijl "duw" geometrieën mogelijk maken de stroomkanalen in direct contact met het gebonden substraat, geven het voordeel van selectieve functionalisering en patroonvorming van het substraatoppervlak later functionaliteit 18, 19.
Kleppen kunnen ook opzettelijk lek "zeef" kleppen of volledig afsluitbaar zijn, afhankelijk van het dwarsdoorsnedeprofiel van het stromingskanaal. Zeef kleppen zijn bruikbaar voor het vangen van korrels, cellen of andere macroanalytes 1 en gefabriceerd via het gebruik van typische negatieve fotoresists (dwz SU-8-serie), die have rechthoekige profielen. Wanneer een besturingskanaal onder druk via deze klepgebieden de PDMS membraan tussen het bedieningsorgaan en stroom afbuigt laag isotroop in het kokerprofiel van de klep niet sluiten de hoeken, waardoor fluïdumstroming maar vangen macroschaal deeltjes (figuur 1). Omgekeerd worden volledig afdichtbare microfluïdische kleppen vervaardigd door op een klein stukje ronde fotoresist op afsluiterlocaties. Met deze geometrie druk zetten van het besturingskanaal buigt het membraan tegen de afgeronde stroom laag om het kanaal volledig afdichten, stoppen fluïdumstroming. Afgeronde profielen in de stroom laag worden gegenereerd via het smelten en opnieuw plaatsen van de positieve fotoresist (bijv AZ50 XT of SPR 220) na het typische fotolithografie stappen. We hebben eerder aangetoond dat post-reflow hoogten van klep regio's zijn afhankelijk van de gekozen functie afmetingen 21. Dit protocol toont de vervaardiging van Afsluiter met geometrieënin een kraal synthese apparaat.
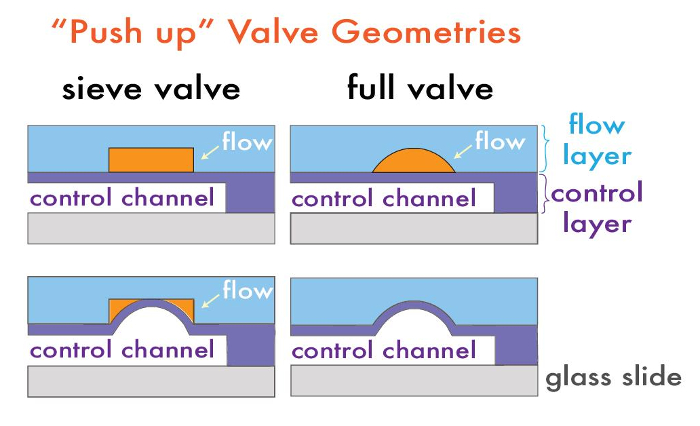
Figuur 1: Multilayer microfluïdische Valve Geometries. Typische "push up" apparaat architecturen voor zeef en volledig afsluitbare kleppen vóór (boven) en na (onder) onder druk. Klik hier om een grotere versie van deze figuur te bekijken.
Apparaten kunnen ook complexe passieve functies, zoals chaotisch mixers 13 en on-chip weerstanden 20 die kenmerken van meerdere verschillende hoogtes binnen eenzelfde stroom laag. Een variabele hoogte laag debiet te bereiken, hebben verschillende groepen vele methoden waaronder printplaat etsen 22, multilayer PDMS hulp uitlijning 23 of meerdere stappen Pp toegepasthotolithography 24. Onze groep heeft meerstaps fotolithografie gevonden uit één stuk vervaardigd meester een doeltreffende en reproduceerbare methode. Om dit te doen, is een eenvoudige fotolithografie techniek van het bouwen van dikke kanalen van negatieve fotolak (bv SU-8-serie fotoresists) in lagen zonder ontwikkeling in tussen de toepassing van elke laag gebruikt. Elke laag wordt gesponnen negatief fotoresist volgens zijn dikte middels instructies van de fabrikant 25 op de silicium meester. Kenmerken van deze hoogte worden vervolgens gevormd op de laag met een specifieke transparantiemasker (figuur 2) aangebracht op een glazen maskerplaat en afgestemd op de eerder gesponnen laag vóór blootstelling. In multi-step fotolithografie, nauwkeurige uitlijning tussen de lagen is van cruciaal belang bij het vormen van een volledige variabele hoogte stromingskanaal. Na uitlijning wordt elke laag aan een dikte afhankelijke bakken na belichting. Zonder ontwikkeling, de volgende laag is similarly patroon. Hierdoor kunnen hoge functies worden opgebouwd op een enkele stroom wafer layer-by-layer via het gebruik van meerdere maskers. Door het overslaan van ontwikkeling tussen elke stap, kunnen vorige fotoresist lagen worden gebruikt om samengestelde hoogte functies genereren 24 (dat wil zeggen, kan twee 25 urn lagen een 50 pm functie te maken). Bovendien kan kanaal vloer functies zoals chaotisch mixer visgraat groeven 13 worden gemaakt met behulp van lagen met eerder blootgesteld functies. Een laatste ontwikkelingsstap het proces is voltooid, waardoor een enkele stroom wafer met gebruik van variabele hoogte (figuur 3).
Hier wordt een volledige protocol voor meerdere stappen die fotolithografie voorbeelden nodige on-chip kleppen en stromingskanalen met verschillende hoogtes fabriceren procedures omvat voorzien. Deze fabricage protocol wordt gepresenteerd in de context van een multi-layer microfluïdische kraal synthesizer die kleppen en variab vereistle-height beschikt voor zijn functionaliteit. Dit apparaat is voorzien van T-kruisingen voor het genereren van waterdruppeltjes in een olie schede, on-chip weerstanden om debieten te moduleren door middel van het regelen van Poiseuille weerstand, een chaotische mixer voor homogeniseren druppel componenten, en beide volledig verzegelen en zeef kleppen om geautomatiseerde workflows met meerdere reagens mogelijk te maken ingangen. Gebruik meerstaps fotolithografie, worden deze functies elk gefabriceerd op een andere laag volgens hoogte of fotoresist; de volgende lagen zijn opgebouwd in dit protocol: (1) Flow Rond klep laag (55 urn, AZ50 XT) (2) Flow Low laag (55 urn, SU-8 2050) (3) Flow High laag (85 urn, SU- 8 2025, 30 urn additief hoogte), en (4) visgraat Grooves (125 urn, SU-8 2025, 40 urn additief hoogte) (figuur 3).
Hydrogel kralen kan worden gebruikt voor een verscheidenheid aan toepassingen, waaronder selectieve functionalisering oppervlak voor stroomafwaartse testen, geneesmiddelinkapseling, radiotracing en imaging assays en mobiele integratie; we voorheen een complexere uitvoering van deze apparaten spectraal gecodeerde PEG hydrogel bolletjes, bevattende lanthanide nanophosphors 20 produceren. De ontwerpen die hier besproken zijn opgenomen in de aanvullende middelen voor elk lab te gebruiken in hun onderzoeksinspanningen indien gewenst. We verwachten dat dit protocol een open bron voor specialisten en niet-specialisten zowel geïnteresseerd in het maken van multi-layer microfluïdische apparaten met kleppen of complexe geometrieën aan de toetredingsdrempel in microfluidics te verlagen en verhogen de kans op fabricage succes zal bieden.
Protocol
Representative Results
Discussion
Dit werk toont een complete multi-step fotolithografie protocol voor een meerlaagse microfluïdische apparaat met kleppen en variabele hoogte geometrie die kan worden afgesteld op elke applicatie met eenvoudige aanpassingen aan de fabricage parameters op basis van onze online tool 26 en instructies van de fabrikant 25. Dit protocol is bedoeld voor meerlaagse fotolithografie helderen voor onderzoekers willen microfluïdische inrichtingen te construeren dan eenvoudige, passi…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Scott Longwell for helpful comments and edits to the manuscript and Robert Puccinelli for device photography. The authors acknowledge generous support from a Beckman Institute Technology Development Grant. K.B. is supported by a NSF GFRP fellowship and the TLI component of the Stanford Clinical and Translational Science Award to Spectrum (NIH TL1 TR 001084); P.F. acknowledges a McCormick and Gabilan Faculty Fellowship.
Materials
| Materials | |||
| Mylar Transparency Masks, 5" | FineLine Plotting | ||
| 5" Quartz Plates | United Silica | Custom | |
| 4" Silicon Wafers, Test Grade | University Wafer | 452 | |
| SU8 2005, 2025, 2050 photoresist | Microchem | Y111045, Y111069, Y111072 | |
| Az50XT | Integrated Micromaterials | AZ50XT-Q | |
| SU8 Developer | Microchem | Y020100 | |
| AZ400K 1:3 Developer | Integrated Micromaterials | AZ400K1:3-CS | |
| Pyrex 150 mm glass dish | Sigma-Aldrich | CLS3140150-1EA | |
| Wafer Petri Dishes, 150 mm | VWR | 25384-326 | |
| Wafer Tweezers | Electron Microscopy Sciences (EMS) | 78410-2W | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane (PFOTS) | Sigma-Aldrich | 448931-10G | |
| 2" x 3" glass slides | Thomas Scientific | 6686K20 | |
| RTV 615 elastomeric base and curing agent PDMS set | Momentive | RTV615-1P | |
| Tygon Tubing, 0.02" O.D. | Fischer Scientific | 14-171-284 | |
| Capillary PEEK tubing, 510 um OD, 125 um ID | Zeus | Custom | 360 um PEEK is readily available by Idex (catalog number: 1571) |
| Cyro 4 mL tube | Greiner Bio-One | 127279 | |
| Epoxy, 30-minute | Permatex | 84107 | |
| Metal Pins, 0.025" OD, .013" ID | New England Small Tube | NE-1310-02 | |
| Poly(ethylene glycol) diacrylate, Mn 700 | Sigma-Aldrich | 455008-100ML | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate photoinitator | Tokyo Chemical Industry Co. | L0290 | We typically synthesize LAP in-house. |
| HEPES | Sigma-Aldrich | H4034-25G | |
| Light mineral oil | Sigma-Aldrich | 330779-1L | |
| Span-80 | Sigma-Aldrich | 85548 | |
| ABIL EM 90 | UPI Chem | 420095 | |
| Name | Company | Catalog Number | Comments |
| Equipment | Equivalent equiptment or homebuilt setups will work equally as well | ||
| Mask Aligner | Karl Suss | MA6 | |
| Profilometer | KLA-Tencor | Alpha-Step D500 | |
| Spin Coater | Laurell Technologies | WS-650-23 | Any spincoater can be used that accepts 100 mm wafers |
| Vacuum Dessicator, Bell-Jar Style | Bel-Art | 420100000 | |
| Oven | Cole-Palmer | WU-52120-02 | |
| UV Spot Curing System with 3 mm LLG option | Dymax | 41015 | UV LEDs, Xenon Arc Lamps, or other UV sources of the same intensity work equally as well |
| MFCS Microfluidic Fluid Control System | Fluidgent | MFCS-EZ | Syringe pumps, custom pneumatics or other control systems can also be used |
| Automated control scripting | MATLAB | ||
| Hotplate | Tory Pines Scientific | HP30 | Any hotplate with uniform heating (i.e. aluminum or ceramic plates) will suffice. |
References
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nat. Rev. Mol. Cell Bio. 16 (9), (2015).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev.Mod. Phys. 77 (3), (2005).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), (2006).
- Kalisky, T., Blainey, P., Quake, S. R. Genomic Analysis at the Single-Cell Level. Ann. Rev. of Genetics. 45 (1), (2011).
- Finkel, N. H., Lou, X., Wang, C., He, L. Peer Reviewed: Barcoding the Microworld. Anal. Chem. 76 (19), (2004).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr. Opin. in Chem. Bio. 16 (3-4), (2012).
- White, A. K., Heyries, K. A., Doolin, C., VanInsberghe, M., Hansen, C. L. High-Throughput Microfluidic Single-Cell Digital Polymerase Chain Reaction. Anal. Chem. 85 (15), (2013).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A Microfluidic Device for Kinetic Optimization of Protein Crystallization and In Situ Structure Determination. J. Am. Chem. Soc. 128 (10), (2006).
- Maerkl, S. J., Quake, S. R. A Systems Approach to Measuring the Binding Energy Landscapes of Transcription Factors. Science. 315 (5809), (2007).
- Fordyce, P. M., Gerber, D., et al. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nat. Biotech. 28 (9), (2010).
- Fan, R., et al. Integrated barcode chips for rapid, multiplexed analysis of proteins in microliter quantities of blood. Nat. Biotech. 26 (12), (2008).
- Kovarik, M. L., Gach, P. C., Ornoff, D. M., Wang, Y. Micro total analysis systems for cell biology and biochemical assays. Anal. Chem. , (2011).
- Stroock, A. D., Dertinger, S. K. W., Ajdari, A., Mezić, I., Stone, H. A., Whitesides, G. M. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Unger, M. A., Chou, H. -. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288 (5463), 113-116 (2000).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic Large-Scale Integration. Science. 298 (5593), (2002).
- Li, N., Sip, C., Folch, A. Microfluidic Chips Controlled with Elastomeric Microvalve Arrays. JoVE. (8), e296 (2007).
- Kim, P., et al. Soft lithography for microfluidics: a review. Biochip. J. 2 (1), 1-11 (2008).
- Studer, V., Hang, G., Pandolfi, A., Ortiz, M., Anderson, W. F., Quake, S. R. Scaling properties of a low-actuation pressure microfluidic valve. J. Appl. Phys. 95 (1), 393-398 (2004).
- Kartalov, E. P., Scherer, A., Quake, S. R., Taylor, C. R., Anderson, W. F. Experimentally validated quantitative linear model for the device physics of elastomeric microfluidic valves. J. Appl. Phys. 101 (6), 064505 (2007).
- Gerver, R. E., Gómez-Sjöberg, R., et al. Programmable microfluidic synthesis of spectrally encoded microspheres. Lab. Chip. 12 (22), 4716-4723 (2012).
- Fordyce, P. M., Diaz-Botia, C. A., DeRisi, J. L., Gómez-Sjöberg, R. Systematic characterization of feature dimensions and closing pressures for microfluidic valves produced via photoresist reflow. Lab. Chip. 12 (21), 4287-4295 (2012).
- Li, C. -. W., Cheung, C. N., Yang, J., Tzang, C. H., Yang, M. PDMS-based microfluidic device with multi-height structures fabricated by single-step photolithography using printed circuit board as masters. The Analyst. 128 (9), 1137-1142 (2003).
- Romanowsky, M. B., Abate, A. R., Rotem, A., Holtze, C., Weitz, D. A. High throughput production of single core double emulsions in a parallelized microfluidic device. Lab. Chip. 12 (4), 802-807 (2012).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. JMM. 16 (2), 276 (2006).
- . Rafael’s Microfluidics Site Available from: https://sites.google.com/site/rafaelsmicrofluidicspage/valve-controllers (2016)
- Wanat, S., Plass, R., Sison, E., Zhuang, H., Lu, P. -. H. Optimized Thick Film Processing for Bumping Layers. Proc. SPIE. , 1281-1288 (2003).

