क्लिनिक-आधारित बायोरेपोसिटरी की स्थापना
Summary
मोहस के माइक्रोग्राफिक सर्जरी के बाद कम्यूनिक ट्यूमर को अक्सर त्याग दिया जाता है। एक प्रोटोकॉल यहां वर्णित है जो क्लिनिकल ऑपरेशन के बिना हस्तक्षेप किए हुए डाउनस्ट्रीम प्रयोगशाला अनुप्रयोगों के लिए क्लिनिकल सपोर्ट स्टाफ को प्रभावी रूप से प्रोटेक्शन और स्टोर करने में सक्षम बनाता है ( जैसे, स्क्वैमस सेल कार्सिनोमा, बेसल सेल कार्सिनोमा, और मेलेनोमा) नमूनों।
Abstract
पिछले कई सालों से त्वचा कैंसर ( जैसे, स्क्वैमस सेल कार्सिनोमा, बेसल सेल कार्सिनोमा और मेलेनोमा) की घटनाएं बढ़ रही हैं। यह उम्मीद है कि बायोमेडिकल शोध अध्ययनों के लिए कटियन ट्यूमर के नमूनों की समानांतर मांग होगी। हालांकि, ऊतक की उपलब्धता, एक जैवपोषक की स्थापना की लागत और नैदानिक परिचालनों में हस्तक्षेप न करने वाले नैदानिक नमूनों को प्राप्त करने के लिए उपलब्ध प्रोटोकॉल की कमी के कारण सीमित है। एक प्रोटोकॉल को चाकूयुक्त ट्यूमर और जुड़े रक्त और लार के नमूने एकत्रित करने और संसाधित करने के लिए स्थापित किया गया था जो कि मोहस शल्य चिकित्सा की तिथि पर नियमित नैदानिक प्रक्रियाओं पर न्यूनतम प्रभाव पड़ता है। मोम्स हॉस्टोटेक्नोलॉजिस्ट द्वारा बायोप्सी सिद्ध साबित कटिबंधों के लिए मोहसे सर्जरी की अपनी पहली परत से गुजरने वाले रोगियों से ट्यूमर के नमूने एकत्र और संसाधित होते हैं। निकटस्थ सामान्य ऊतक शल्यचिकित्सा बंद होने के समय एकत्र किया जाता है। अतिरिक्त नमूने जो इकट्ठे किए जा सकते हैं, पूरे रक्त और बुक्कल स्वैब्स हैं। सामान्य रूप से खारिज किए गए ऊतक नमूनों का उपयोग करके, एक बायोरपोसिटरी उत्पन्न होता है जो प्रयोगशाला सेटिंग से बना क्लिनिक में आधारित होने के द्वारा कई महत्वपूर्ण लाभ प्रदान करता है। इसमें एकत्र किए गए नमूनों की एक विस्तृत श्रृंखला शामिल है; रोगविज्ञान रिपोर्टों सहित, डी-पहचान किए गए रोगी रिकॉर्ड तक पहुंच; और, ठेठ दाता के लिए, अनुवर्ती विज़िट के दौरान अतिरिक्त नमूने तक पहुंच।
Introduction
कैंसर और बायोमार्कर अनुसंधान गुणवत्ता वाले मानव ऊतक नमूनों की आपूर्ति पर निर्भर करता है, और सीमित आपूर्ति ने शोध 1 , 2 को बाधित किया है। कई त्वचा विज्ञान अध्ययन अपर्याप्त आपूर्ति, चर गुणवत्ता, और मानवीय ऊतक के उपयोग से जुड़े लागतों द्वारा सीमित हैं। एक बड़े, समर्पित बायोबैंक स्थापित करने की लागत का अनुमान लगभग 20 लाख डॉलर है, और ये लागत कई शोधकर्ताओं की पहुंच से मानव ऊतक का उपयोग करते हैं। इसके अलावा, शोध के नमूने बनाने और संग्रहीत करने की प्रक्रिया नैदानिक आपरेशनों को प्रभावित करने और मरीज की देखभाल में देरी से होने वाले जोखिम को ध्यान में रखते हुए सावधानीपूर्वक निष्पादित नहीं होती है। एक लागत प्रभावी, क्लिनिक आधारित बायोरेपोसिटरी की स्थापना की गई है जो कि त्वचा कैंसर के नमूनों पर ध्यान केंद्रित करती है, सिफारिश की सर्वोत्तम प्रक्रियाओं और नमूना सत्यापन 4 , 5 , 6 ।
<pClass = "jove_content"> यह प्रोटोकॉल एक त्वचाविज्ञान क्लिनिक में विकसित किया गया है जो स्क्वैमस सेल कार्सिनोमा (एससीसी), बेसल सेल कार्सिनोमा (बीसीसी), और मेलेनोमा त्वचा के कैंसर को हटाने के लिए मोम्स माइक्रोग्राफिक सर्जरी की एक बड़ी मात्रा का प्रदर्शन करता है। इस मरीज की आबादी से स्वयंसेवी दाताओं को भर्ती किया जा सकता है। उपचार में देरी के बिना सहमति वाले मरीजों से तेजी से ऊतक और रक्त को पकड़ने के लिए संग्रह के स्थल पर बायोरपोसिटरी स्थापित करना महत्वपूर्ण है। एक ही क्लिनिक से नमूनों को एकत्रित करना, संग्रह तकनीकों में अंतर को कम करता है और नमूनों की गुणवत्ता में अंतर को कम करता है, जो डाउनस्ट्रीम एप्लीकेशंस 7 , 8 के लिए समस्याग्रस्त हो सकता है।Mohs micrographic सर्जरी तकनीक का लक्ष्य यह सुनिश्चित करना है कि जितना संभव हो उतना स्वस्थ ऊतक को संरक्षित करते समय सभी कैंसर के ऊतकों को हटा दिया जाए। इस प्रक्रिया में ट्यूमर के ऊतकों की पतली परतों को प्रगतिशील हटाने शामिल है। प्रत्येक क्रमिक परत उसकी हैत्वचा रोग विशेषज्ञ द्वारा सभी कैंसर के ऊतकों को हटा दिया गया है या नहीं यह निर्धारित करने के लिए टॉगल की जांच के लिए (ट्यूमर के ऊतक को रोका जाने और एच एंड ई स्टेंसिंग करने के बाद) की जांच की जाती है। ऊतकों के बाद की परतों की परीक्षा और परीक्षा निष्पादित की जाती है, जबकि मरीज कार्यालय में रहता है। इस तकनीक को एससीसी 9 के लिए सबसे अच्छा इलाज विकल्प माना जाता है इस बिंदु पर, घाव बंद हो गया है और, उपचार और कॉस्मेटिक उपस्थिति में सुधार करने के लिए, आसन्न सामान्य ऊतक (एएनटी) अक्सर खुले हुए हैं इस प्रकार, एक ट्यूमर को निकालने के लिए इस शल्य प्रक्रिया को भविष्य के अध्ययनों के लिए ऊतक-दृष्टि से वर्णित ऊतक इकट्ठा करने के लिए आदर्श रूप से अनुकूल है।
सामान्य कर्मचारियों के कर्तव्यों ( चित्रा 1 ) पर न्यूनतम प्रभाव रखने के लिए ट्यूमर के ऊतक, आसन्न सामान्य ऊतक, लार और रक्त के नमूने प्राप्त करने के लिए खरीद प्रक्रिया तैयार की गई है। प्रक्रिया के लिए मरीज की तैयारी करते समय चिकित्सा सहायकों रक्त ड्रॉ करते हैं। Mohs प्रक्रिया पूरा होने के बाद, एम ओह हॉस्टोटेक्नोलॉजिस्ट नमूने के अतिरिक्त हिस्टोलॉजिकल स्लाइड्स तैयार करता है और ऊतक को बायोरपोसिटरी में स्थानांतरित करता है। बायोरेपोसिटरी की स्थापना के साथ जुड़े लागत में क्रियोपेशेशंस फ्रीजर, सामान्य नैदानिक प्रयोगशाला अंतरिक्ष की स्थापना, और इन्वेंट्री ट्रैकिंग कार्यक्रम का विकास शामिल है।
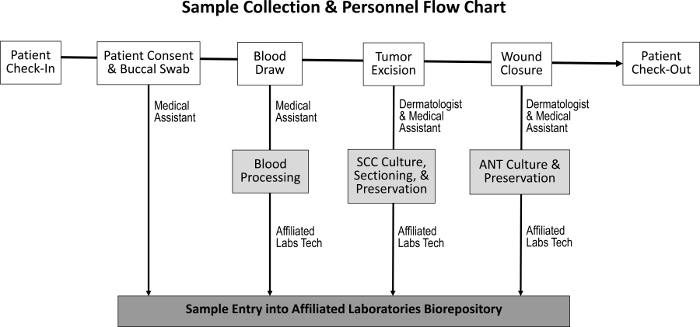
चित्रा 1: नमूना संग्रह और जिम्मेदार कर्मचारियों की अनुक्रम रोगी की जांच-पड़ताल और रोगी की सहमति की प्राप्ति पर, चिकित्सा सहायक एक बूकेदार स्वाद इकट्ठा करता है और रक्त ड्रॉ करता है। त्वचा विशेषज्ञ और चिकित्सा सहायक तब ट्यूमर को उत्पादित करते हैं और घाव को बंद करते हैं, जिसके दौरान एससीसी और एएनटी नमूनों को क्रमशः एकत्र किया जाता है। एक समर्पित प्रयोगशाला तकनीशियन, रक्तसंवर्धन और ऊतक संवर्धन, संरक्षण और बायोरेपोसिटरी में प्रवेश के लिए एससीसी और एएनटी नमूनों के खूनों और वर्गों को प्रक्रिया करता है।Ftp_upload / 55583 / 55583fig1large.jpg "target =" _ blank "> कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
एकत्र किए गए नमूने की विविधता विभिन्न प्रकार के प्रयोगात्मक दृष्टिकोण ( चित्रा 2 ) को सक्षम करती है। रोगी से एकत्र किए गए नमूने हैं बुक्कल swabs (लार भी यदि आवश्यक हो तो एकत्र किया जा सकता है), पूरे रक्त और excised tissue। जीनोटाइपिंग और ऊतक मिलान के लिए, पूरे रक्त से एक मस्तिष्क स्वाद और एक नमूना प्रोसेसिंग के बिना बचाया जाता है। पूरे रक्त को सफेद रक्त कोशिका (डब्लूबीसी) और भविष्य के विश्लेषण के लिए प्लाज्मा अंशों में विभाजित किया गया है। Mohs प्रसंस्करण के बाद, जमे हुए ट्यूमर सीधे तरल नाइट्रोजन में रखा जाता है और एक -80 डिग्री सेल्सियस फ्रीज़र को स्थानांतरित कर दिया जाता है। ताजा, व्यवहार्य ट्यूमर ऊतक और एएनटी नमूनों की पिछली तकनीक 10 , 11 के संशोधनों का उपयोग करके सुसंस्कृत किया जाता है और फिर क्रियोप्रेसेबल। संग्रह के दौरान, प्रत्येक नमूना प्रकार की संख्या दर्ज करने से पहले स्प्रैडशीट पर दर्ज की जाती है सटीक प्रसंस्करण ( तालिका 1 ) की सुविधा के लिए सूची ट्रैकिंग कार्यक्रम।
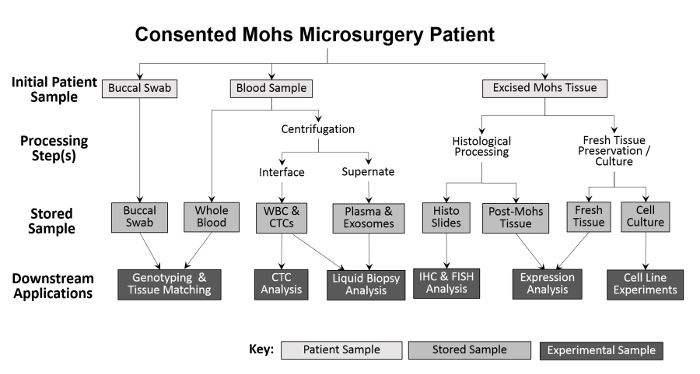
चित्रा 2: क्लिनिक-आधारित जैवपोषक नमूना संग्रह और प्रसंस्करण की रूपरेखा। मस्तिष्क से एक बूकेदार स्वाद और रक्त का नमूना एकत्र किया जाता है और डाउनस्ट्रीम जीनोटाइपिंग और ऊतक मिलान के लिए संग्रहीत किया जाता है। पूरे रक्त को आगे सफेद रक्त कोशिका (डब्ल्यूबीसी) अलगाव और सीटीसी विश्लेषण के लिए और साथ ही प्लाज्मा संग्रह और तरल बायोप्सी विश्लेषण के लिए प्रोसेस किया जाता है। Mohs प्रक्रिया के दौरान excised ऊतक निदान उद्देश्यों के लिए histologically संसाधित किया जाता है, जिसके बाद histological स्लाइड्स आगे immunohistochemical विश्लेषण के लिए प्रयोगात्मक इस्तेमाल किया जा सकता है। बशर्ते excised ऊतक का नमूना काफी बड़ा है, ताजा ऊतक का एक हिस्सा निकाल दिया जाता है और प्रोटीन और आरएनए अलगाव के लिए, और सुसंस्कृत सेल लाइनों की स्थापना के लिए विभाजित किया जाता है।55583 / 55583fig1large.jpg "target =" _ blank "> कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
| संग्रहण दिनांक: | |||||
| रोगी 1 | रोगी 2 | रोगी 3 | रोगी 4 | रोगी 5 | |
| प्रारंभिक और जन्म तिथि | |||||
| आँखों का रंग | |||||
| नमूना प्रकार | |||||
| नमूना स्थान | |||||
| लार | |||||
| डब्ल्यूछेद रक्त | |||||
| प्लाज्मा | |||||
| ट्यूमर व्यवहार्य | |||||
| ऊतक सामान्य व्यवहार्य | |||||
| ट्यूमर मोहस तरल नाइट्रोजन | |||||
| ऊतक सामान्य तरल नाइट्रोजन | |||||
| स्लाइड्स |
तालिका 1: नमूना संग्रह रिकॉर्ड करने के लिए चेकलिस्ट। एकत्र किए गए प्रत्येक नमूने के साथ ट्रैक किए गए और रिकॉर्ड किए गए डेटा में शामिल हैं रोगी आद्याक्षर, जन्म तिथि, और आंखों का रंग (त्वचा टाइपिंग के लिए), साथ ही साथ स्थानीयनमूना हटाने पर लार के नमूनों, रक्त संग्रह खंडों की संख्या और एकत्रित व्यवहार्य और संरक्षित टिशू नमूनों की संख्या को बाद में उपयोग के लिए आवंटन के संदर्भ के रूप में भी दर्ज किया गया है। कृपया इस फाइल को डाउनलोड करने के लिए यहां क्लिक करें।
नमूना संग्रह प्रक्रिया को मान्य करने के लिए, प्रत्येक नमूना प्रकार को डाउनस्ट्रीम एप्लिकेशन में परीक्षण किया गया है। पिछले तकनीकों के संशोधनों का उपयोग करना 12 , ट्यूमर और एएनटी को सफलतापूर्वक प्रोटीन और आरएनए अलगाव में इस्तेमाल किया गया है और संभवतः डीएनए अलगाव के लिए इस्तेमाल किया जा सकता है। ऊतक वर्गों से स्थापित व्यवहार्य explants माइक्रोस्कोपी द्वारा मूल्यांकन किया गया है, जबकि संग्रहीत histological स्लाइड immunohistochemistry और immunofluorescence के लिए इस्तेमाल किया गया है
यहाँ वर्णित प्रोटोकॉल का पालन करके, इस मॉडल को अन्य त्वचाविज्ञान क्लिनिकों में पेश करना संभव है, अन्य ट्यूमर प्रकार (जैसे मेलेनोमा), और अन्य सर्जिकल विशिष्टताओं और मानव कैंसर में बहुमुखी अनुसंधान के लिए मानव ऊतक के नमूने प्रदान करने के लिए प्रथाओं। इस प्रोटोकॉल के थोड़ा बदलाव अन्य प्रथाओं के लिए आवश्यक होने की संभावना है लेकिन, सिद्धांत रूप में, यह प्रोटोकॉल किसी भी सर्जिकल अभ्यास पर लागू होता है जो रोगी के उपचार के दौरान नियमित रूप से रोगी के नमूने एकत्रित किए जाते हैं।
Protocol
Representative Results
Discussion
लेखक के ज्ञान के लिए, यह प्रोटोकॉल अपनी तरह का पहला तरीका है जो एक लागत प्रभावी और तेज दृष्टिकोण दोनों में त्वचेय ऊतक नमूनों की नैदानिक खरीद पर केंद्रित है। Mohs microsurgery के दौर से गुजर मरीजों को आम तौर पर सम?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस काम को मिडवेस्टर्न यूनिवर्सिटी कॉलेज ऑफ हेल्थ साइंसेज रिसर्च फसिलिटिशन ग्रांट, ईईएच, और मिडवेस्टर्न यूनिवर्सिटी ऑफ़ रिसर्च एंड स्पॉन्सर प्रोग्राम्स इनट्रैमर ग्रांट, के जेएल से सम्मानित किया गया। सहबद्ध प्रयोगशालाओं और संबद्ध त्वचाविज्ञान द्वारा अतिरिक्त समर्थन प्रदान किया गया था। हम अपनी तकनीकी सहायता के लिए सारा पोटेकेन, जेमी बार्टो, स्टीफनी फॉक्स, कोडी जॉर्डिंग, स्टेसी शिमेक, हीथर किसेल और अली ज़ैदी को धन्यवाद देते हैं।
Materials
| BD Vacutainer Plastic Blood Collection Tubes with K3EDTA | ThermoFisher Scientific | 02-685-2B | |
| Electron Microscopy Sciences Double Edge Blades | ThermoFisher Scientific | 50-949-411 | |
| Curved Medium Point General Purpose Forceps | ThermoFisher Scientific | 16-100-110 | |
| Premium Microcentrifuge Tubes | ThermoFisher Scientific | 05-408-138 | |
| Lonza Walkersville KGM Keratinocyte Medium | ThermoFisher Scientific | NC9791321 | |
| Electron Microscopy Sciences Tissue TEK OCT Compound | ThermoFisher Scientific | 50-363-579 | |
| Leica CM1950 Cryostat | Leica Biosystems | 14047743909 | |
| Frosted Microscope Slides | ThermoFisher Scientific | 12-550-343 | |
| Shandon Rapid-Chrome H&E Frozen Section Staining Kit | ThermoFisher Scientific | 99-900-01 | |
| Nalgene Long-Term Storage Cryogenic Tubes | ThermoFisher Scientific | 03-337-7X | |
| Falcon 15 mL Conical Centrifuge Tubes | ThermoFisher Scientific | 14-959-53A | |
| Boca Scientific BuccalT-Swab | ThermoFisher Scientific | NC9679349 | |
| Cell Signaling Technology 10x RIPA Buffer | ThermoFisher Scientific | 50-195-822 | |
| Halt Protease and Phosphatase Inhibitor Cocktail | ThermoFisher Scientific | PI78443 | |
| Eppendorf 5424R Microcentrifuge | ThermoFisher Scientific | 05-401-203 | |
| Pellet Morter Cordless Homogenizer | ThermoFisher Scientific | 12-141-3 | |
| RNAse Free Pellet Pestle | ThermoFisher Scientific | 121-141-364 | |
| Forma SteriCycle CO2 Incubator | ThermoFisher Scientific | 13-998-089 | |
| HyClone Fetal Bovine Serum | ThermoFisher Scientific | SH30071.02 | |
| Gibco Advanced DMEM/F-12 | ThermoFisher Scientific | 12-634-028 | |
| Gibco Penicillin-Streptomycin | ThermoFisher Scientific | 15140148 | |
| Gibco 1M Hepes | ThermoFisher Scientific | 15-630-130 | |
| Nunc Cell Culture 35 mm with Vent | ThermoFisher Scientific | 1256591 | |
| Anti-CFH monoclonal antibody clone OX-24 | Abnova | MAB12583 | |
| Anti-p40 (p63 delta) antibody | Abnova | ABX-144A | |
| Anti MUC-1 antibody | Santa Cruz Biotech | sc-7313 | |
| Anti-Snail + Slug (phospho S246) | Abcam | Ab63568 | |
| Goat anti-rabbit IgG, Alexa Fluor 488 | Invitrogen | A-11034 | |
| Alexa Fluor 568 Phallodin | Molecular Probes | A12380 | |
| ProLong Gold Antifade Mountant with DAPI | Molecular Probes | P36941 | |
| Zeiss Axio Imager Z1 Microscope with Axiocam camera | Zeiss | 4300009901 | |
| Olympus IX51 phase contrast with DP72 camera | Olympus | IX511F3 |
References
- Baker, M. Biorepositories: Building better biobanks. Nature. 486, 141-146 (2012).
- Ambrosone, C. B., Nesline, M. K., Davis, W. Establishing a cancer center data bank and biorepository for multidisciplinary research. Cancer Epidemiol Biomarkers Prev. 15, 1575-1577 (2006).
- Baird, P. M., Gunter, E. W., Vaught, J. Building a biobank. Biopreserv Biobank. 14, 87-88 (2016).
- Caixeiro, N. J., Lai, K., Lee, C. S. Quality assessment and preservation of RNA from biobank tissue specimens: a systematic review. J Clin Pathol. 69, 260-265 (2016).
- Campbell, L. D., et al. Development of the ISBER best practices for repositories: Collection, storage, retrieval and distribution of biological materials for research. Biopreserv Biobank. 10, 232-233 (2012).
- Neumeister, V. M. Tools to assess tissue quality. Clin Biochem. 47, 280-287 (2014).
- Vaught, J., et al. An NCI perspective on creating sustainable biospecimen resources. J Natl Cancer Inst Monogr. 2011, 1-7 (2011).
- Fu, T., Aasi, S. Z., Hollmig, S. T. Management of high-risk squamous cell carcinoma of the skin. Curr Treat Options Oncol. 17, (2016).
- Rasmussen, C., Thomas-Virnig, C., Allen-Hoffmann, B. L. Classical human epidermal keratinocyte cell culture. Methods Mol Biol. 945, 161-175 (2013).
- Purdie, K. J., Pourreyron, C., South, A. P. Cancer cell culture: Methods and protocols. , 151-159 (2011).
- Berglund, S. R., Schwietert, C. W., Jones, A. A., Stern, R. L., Lehman, J., Goldberg, Z. Optimized methodology for sequential extraction of RNA and protein from small human skin biopsies. J Invest Dermatol. 127, 349-353 (2007).
- Schroeder, A., et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 1-14 (2006).
- Cooper, H. L., et al. Expression and glycosylation of MUC1 in epidermolysis bullosa-associated and sporadic cutaneous squamous cell carcinomas. Br J Dermatol. 151, 540-545 (2004).
- Riihila, P. M., et al. Complement factor H: a biomarker for progression of cutaneous squamous cell carcinoma. J Invest Dermatol. 134, 498-506 (2014).
- Ha Lan, T. T., et al. Expression of the p40 isoform of p63 has high specificity for cutaneous sarcomatoid squamous cell carcinoma. J Cutan Pathol. 41, 831-838 (2014).
- Alomari, A. K., Glusac, E. J., McNiff, J. M. p40 is a more specific marker than p63 for cutaneous poorly differentiated squamous cell carcinoma. J Cutan Pathol. 41, 839-845 (2014).
- Qiao, B., Johnson, N. W., Gao, J. Epithelial-mesenchymal transition in oral squamous cell carcinoma triggered by transforming growth factor-beta1 is Snail family-dependent and correlates with matrix metalloproteinase-2 and -9 expressions. Int J Oncol. 37, 663-668 (2010).
- Vaught, J. Developments in biospecimen research. Br Med Bull. 114, 29-38 (2015).

