Réseaux de neurones conçus par micro-tissus tridimensionnels inspirés anatomiquement pour la reconstruction, la modulation et la modélisation du système nerveux
Summary
Ce manuscrit détaille la fabrication de réseaux de neurones fabriqués par micro-tissus: des constructions tridimensionnelles de taille de micromètre composées de trajets axonaux longs alignés couvrant une ou plusieurs populations neuronales agrégées enfermées dans un hydrogel tubulaire. Ces échafaudages vivants peuvent servir de relais fonctionnels pour reconstruire ou moduler les circuits neuronaux ou comme bancs biofidéliques imitant la neuroanatomie de la matière grise et blanche.
Abstract
La récupération fonctionnelle se produit rarement après une dégénérescence due à une blessure ou à une dégénérescence induite par la maladie dans le système nerveux central (SNC) en raison de l'environnement inhibiteur et de la capacité limitée de neurogenèse. Nous développons une stratégie pour traiter simultanément la perte de voie neuronale et axonale dans le SNC endommagé. Ce manuscrit présente le protocole de fabrication pour les réseaux de neurones à micro tissage (micro-TENN), les constructions implantables constituées de neurones et de tracés axonaux alignés sur la lumière de la matrice extracellulaire (ECM) d'un cylindre d'hydrogel préformé de centaines de microns de diamètre pouvant s'étendre à des centimètres en longueur. Les agrégats neuronaux sont délimités aux extrêmes de l'encastrement tridimensionnel et sont recouverts de projections axonales. Les Micro-TENN sont uniquement conçus comme une stratégie pour la reconstruction du SNC, en imitant les aspects de la cytoarchitecture de connexion au cerveau et en fournissant potentiellement des moyens de remplacement du réseau. Le neuLes agrégats ronaux peuvent synapse avec le tissu hôte pour former de nouveaux relais fonctionnels pour restaurer et / ou moduler les circuits manquants ou endommagés. Ces constructions peuvent également constituer des «échafaudages vivants» pro-régénérables capables d'exploiter des mécanismes de développement pour la migration cellulaire et le suivi axonal, fournissant des indices synergiques structurels et solubles basés sur l'état de régénération. Les micro-TENN sont fabriqués en versant de l'hydrogel liquide dans un moule cylindrique contenant une aiguille centrée longitudinalement. Une fois que l'hydrogel a été gélifié, l'aiguille est retirée, laissant une micro-colonne creuse. Une solution ECM est ajoutée à la lumière pour fournir un environnement approprié pour l'adhérence neuronale et la croissance axonale. Les neurones dissociés sont agrégés mécaniquement pour l'ensemencement précis dans une ou les deux extrémités de la micro-colonne. Cette méthodologie produit de manière fiable des constructions miniatures autonome avec des tracés axonaux à longue projection qui peuvent récapituler les caractéristiques de la neuroanatomie du cerveau. Synaptic immLes indicateurs de calcium non colorés et codés génétiquement suggèrent que les micro-TENN possèdent une distribution synaptique étendue et une activité électrique intrinsèque. Par conséquent, les micro-TENN représentent une stratégie prometteuse pour la reconstruction neuro-chirurgicale ciblée des voies cérébrales et peuvent également être appliquées sous forme de modèles biofidéliques pour étudier les phénomènes neurobiologiques in vitro .
Introduction
Une caractéristique commune des troubles et des maladies du système nerveux central (SNC), comme une lésion cérébrale traumatique (TCE), une lésion de la moelle épinière (SCI), un accident vasculaire cérébral, une maladie d'Alzheimer et une maladie de Parkinson est la déconnexion des voies axonales et des cellules neuronales Perte 1 , 2 , 3 , 4 , 5 , 6 . Par exemple, lorsqu'un accident vasculaire ischémique n'est pas traité, on estime que les axones sont perdus à raison de 7 milles d'axones par minute 5 . Dans le cas de TBI, qui environ 1,7 million de personnes vivent chaque année aux États-Unis, la dégénérescence axonale peut continuer à se produire des années après un traumatisme, car la blessure initiale précipite un état neurodégénératif à long terme 4 . En aggravant ces effets délétères, le SNC a une capacité sévèrement limitéeVille pour la régénération 1 , 7 , 8 , 9 . Après une blessure, un environnement inhibiteur se développe qui se caractérise par un manque de guidage dirigé vers des cibles lointaines, la présence d'inhibiteurs associés à la myéline qui entravent la croissance des neurites et la formation d'une cicatrice gliale par astrocytes réactifs 8 , 10 , 11 , 12 . La cicatrice gliale sert de barrière biochimique et physique à la régénération, avec des molécules telles que les protéoglycans de sulfate de chondroïtine obstruant l'excès d'axone 8 , 11 . En outre, bien que des cellules souches neurales aient été trouvées dans le SNC adulte, la production de nouveaux neurones est limitée, car des signes constants de neurogenèse n'ont été trouvés que dans l'ampoule olfactive, l'hippocampeLa zone sous -granulaire, la zone périventriculaire et le canal central de la moelle épinière 13 , 14 . Ces obstacles empêchent la récupération fonctionnelle des neurones perdus et de l'architecture de la matière blanche suite à une blessure ou une maladie, ce qui entraîne des effets souvent changeants et prolongés de ces conditions.
Malgré le manque de capacité régénératrice dans le SNC adulte, il a été démontré que la régénération axonale est possible si des signaux environnementaux adéquats sont présentés aux neurones hôtes 15 , 16 , 17 , 18 . Les chercheurs ont essayé de fournir et de manipuler des facteurs de croissance ( p. Ex., Facteur de croissance nerveuse, facteur de croissance épidermique, facteur de croissance dépendant de la gliale et facteur neurotrophique 3) et d'autres molécules d'orientation pour stimuler la plasticité et la régénération des axones 14 , </ Sup> 18 , 19 . Bien que ces études aient confirmé que les axones adultes sont capables de répondre aux facteurs de croissance, ces stratégies sont limitées par la faible perméabilité de la barrière hémato-encéphalique et les gradients spatiaux et temporels spécifiques requis pour favoriser la régénération 14 , 18 , 19 . D'autres approches se sont appuyées sur l'hyperactivation des facteurs de transcription liés à la régénération dans les neurones du SNC. Par exemple, la surexpression du facteur de transcription Stat3 a stimulé la régénération axonale dans le nerf optique 20 . Néanmoins, la délivrance de biomolécules et la surexpression des facteurs de transcription ne remplacent pas les populations neuronales perdues. Les stratégies basées sur les cellules ont principalement porté sur la transplantation de cellules souches neurales (NSC) dans le SNC, en profitant de leur capacité à remplacer les neurones du SNC, à libérer des facteurs trophiques,Et appuient les tentatives de neurogenèse qui surviennent après une blessure 17 . Malgré cela, il existe encore des défis pressants qui empêchent cette approche, y compris la capacité entravée des cellules névralgiques transplantées à survivre, à s'intégrer à l'hôte et à rester spatialement limité à la zone blessée 6 , 14 , 17 , 21 . En outre, la distribution cellulaire seule est incapable de rétablir la cytoarchitecture des voies axonales endommagées ou perdues. Une autre approche qui traite des problèmes auxquels sont confrontées les stratégies de distribution des cellules et des médicaments / produits chimiques combine ces approches avec l'utilisation des biomatériaux 14 , 22 , 23 . Les biomatériaux tels que les hydrogels sont capables d'émuler les propriétés biochimiques et physiques de la matrice extracellulaire (ECM), en facilitant la délivrance cellulaire etD rétention dans la zone lésée et délivrant des facteurs de croissance et d'autres molécules bioactives avec libération contrôlée 22 . Les caractéristiques attrayantes de ces stratégies basées sur le biomatériau ont donné lieu à des signes de régénération axonale in vivo après la transplantation d'échafaudages dans les zones lésées 24 , 25 , 26 , 27 , 28 , 29 , 30 . Cependant, les stratégies biomatériaux acellulaires ne remplacent pas les populations neuronales perdues; Lorsqu'ils sont utilisés comme véhicules de délivrance pour les cellules précurseurs neuronales, gliaires ou neuronales, les biomatériaux sont incapables de reconstituer les réseaux axonaux à longue distance. Le défi de développer une approche qui aborde à la fois la dégénérescence de la voie axonale et la perte neuronale associée à une lésion et une maladie du SNC reste encore <Sup class = "xref"> 31.
Notre groupe de recherche a précédemment rapporté le développement de réseaux de neurones implantables micro-tissulaires implantables (micro-TENN), qui sont un type d'échafaudage vivant constitué de corps de cellules neuronales restreints à une ou aux deux extrémités d'une micro-colonne ECM d'hydrogel d'agarose , Avec des tracés axiaux alignés s'étendant à travers l'intérieur de cette enceinte tridimensionnelle (3D) 1 , 10 , 31 , 32 . L'une des principales différences entre cette technique et les approches précédentes est que la cytoarchitecture des micro-TENN est créée complètement in vitro et est transplantée ensuite 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . La fabrication in vitro offre un vaste contrôle spatial et temporel du phénotype et de l'orientation cellulaire, des propriétés mécaniques / physiques, des indices biochimiques et des facteurs exogènes, ce qui profite à l'intégration de ces échafaudages avec l'hôte après l'implantation 41 , 42 . Les micro-TENN sont anatomiquement inspirés car ils imitent la neuroanatomie du cerveau, montrant des traces axonales semblables à celles qui relient les différentes régions fonctionnelles du cerveau ( figure 1A ) 1 . Par conséquent, cette stratégie peut être en mesure de remplacer physiquement les trajets de la substance blanche perdue et les neurones après l'implantation dans une région lésée. Cette technique s'inspire également des mécanismes de développement dans lesquels les «échafaudages naturels» formés par les cellules de gliale radiales et les axones pionniers agissent comme guides de guidage de cellulesMigration de la zone subventriculaire et croissance axonale, respectivement 43 . Ces mécanismes sont récapitulés dans les parcelles axonales alignées des micro-TENN, qui peuvent présenter des voies de vie pour la migration des cellules neuronales et la régénération axonale par croissance axonale médiée par l'axone ( Figure 1C ) 43 . En outre, cette stratégie bénéficie de l'intégration synaptique entre les neurones micro-TENN et les circuits natifs, formant de nouveaux relais pouvant contribuer à la récupération fonctionnelle ( Figure 1B ) 43 . La capacité de formation de synapses peut également accorder à cette approche la capacité de moduler le SNC et de répondre au tissu hôte en fonction des commentaires du réseau. Par exemple, les neurones optogénétiquement actifs dans les échafaudages vivants peuvent être stimulés pour moduler les neurones hôtes par des interactions synaptiques ( Figure 1D ).
En outre, la construction tubulaire à base de biomatériauL'utilisation de micro-TENN offre un environnement adéquat pour l'adhésion cellulaire, la croissance, l'extension des neurites et la signalisation, tandis que les dimensions miniatures des constructions permettent une implantation peu invasive et fournissent un micro-environnement partiellement séquestré pour une intégration progressive dans le cerveau. En effet, des publications récentes ont démontré le potentiel des micro-TENN à imiter les voies nerveuses après l'implantation dans le cerveau du rat. À la suite de la micro-injection stéréotaxique, nous avons précédemment signalé des signes de survie neuronale micro-TENN, le maintien de l'architecture des axaux et l'extension des neurites dans le cortex de l'hôte au moins 1 mois in vivo 10 , 31 . En outre, l'étiquetage avec la synapsine a fourni des preuves histologiques de l'intégration synaptique avec le tissu natif 10 , 31 . Dans l'ensemble, les micro-TENN peuvent être particulièrement adaptés pour reconstruire et moduler les dommagesCNS en remplaçant les neurones perdus, en intégrant de manière synaptique les circuits hôtes, en rétablissant la cytoarchitecture axonale perdue et, dans certains cas, en fournissant des axones régénérants avec les indices de détection appropriés.
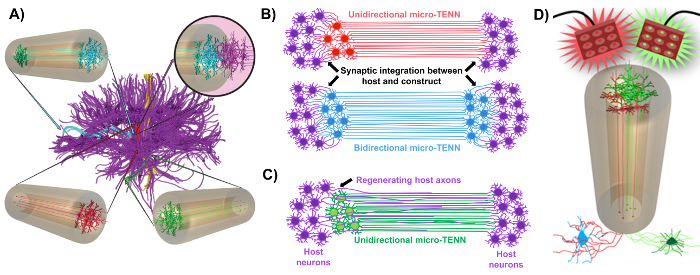
Figure 1: Principes et inspiration liés au développement de réseaux de neurones à micro tissus (micro-TENN). ( A ) Les micro-TENN imitent la cytoarchitecture du connecteur du cerveau (violet), dans lequel les régions fonctionnellement distinctes sont connectées par des trajets axiaux longs et alignés d'une manière unidirectionnelle (rouge, verte) ou bidirectionnelle (bleue). À titre d'exemple, les micro-TENN pourraient reconstituer les connexions perdues dans les voies corticothalamique et nigrostriatale ou dans la voie perforante du cortex entorhinal à l'hippocampe (adapté de Struzyna et al. , 2015) 1 . ( B ) Diagramme d'une unidirectionaL et bidirectionnel micro-TENN (rouge et bleu, respectivement) intégrant de manière synaptique avec le circuit hôte (violet) pour servir de relais fonctionnel entre les deux extrémités d'une lésion. ( C ) Schéma des tracés axonaux d'un micro-TENN (vert) unidirectionnel servant de guide pour la régénération axiale des axones hôtes (violet) vers une cible avec laquelle le micro-TENN interagit. ( D ) Schéma conceptuel de l'utilisation de micro-TENNS optogénétiquement actifs en tant que néodomodulateurs, profitant de l'intégration synaptique avec des neurones excitateurs ou inhibiteurs (en bas). Cliquez ici pour voir une version plus grande de ce chiffre.
Le manuscrit actuel détaille la méthodologie utilisée pour fabriquer des micro-TENN utilisant des neurones corticaux cérébraux dérivés d'embryons. Notamment, les micro-TENN pourraient être fabriqués avec d'autres types de cellules neurales. Pour l'exEn amont, les rapports initiaux du développement réussie de micro-TENN ont comporté des neurones de ganglion de racine dorsale (DRG) 32 . Les micro-colonnes d'hydrogel peuvent être générées ( Figure 2A ) en ajoutant de l'agarose liquide à un réseau de canaux cylindriques sur mesure, coupé au laser ou à des tubes capillaires, tous deux contenant des aiguilles d'acupuncture alignées. L'aiguille forme la lumière et détermine le diamètre intérieur (ID) de la micro-colonne, tandis que l'ID du tube capillaire et le diamètre des cylindres dans l'appareil de coupe au laser dictent le diamètre extérieur (OD) des constructions. Les OD et ID peuvent être choisis en fonction de l'application souhaitée en sélectionnant des diamètres différents pour les tubes périphériques / capillaires et les aiguilles d'acupuncture, respectivement. La longueur des micro colonnes peut également varier; À ce jour, nous avons signalé la construction de micro-TENN jusqu'à 20 mm de longueur 10 et recherchons activement des longueurs encore plus longues. Après les gels d'agarose et l'acupuncture nLes eedles sont éliminés, une solution ECM généralement constituée de collagène de type I et de laminine est ajoutée à la lumière des constructions ( Figure 2C ). Le noyau ECM fournit un échafaudage pour favoriser l'adhérence cellulaire neuronale et la croissance axonale. Au début, les neurones corticaux primaires du rat ont été plaqués dans les micro-colonnes en utilisant des suspensions de cellules dissociées 10 , 31 , 32 . Cependant, cette approche n'a pas produit la cytoarchitecture cible dans tous les cas, qui a été définie comme les corps de cellules neuronales restreints aux extrémités des micro-colonnes, avec la lumière centrale composée de traits axonaux alignés purs. Depuis lors, l'utilisation d'une méthode d'agrégation neuronale forcée (basée sur des protocoles adaptés de Ungrin et al .) A permis une fabrication plus fiable et cohérente de micro-TENN avec la structure idéale ( Figure 2B ) 44 . En plus de décrire le courantMéthodologie, cet article montrera des images représentatives de contraste de phase et confocales de micro-TENN qui démontrent la formation de parcelles axonales au fil du temps, ainsi que la cytoarchitecture ciblée finalisée. Ce manuscrit élargira également les aspects remarquables du protocole et les défis restants et les orientations futures de la technologie micro-TENN.
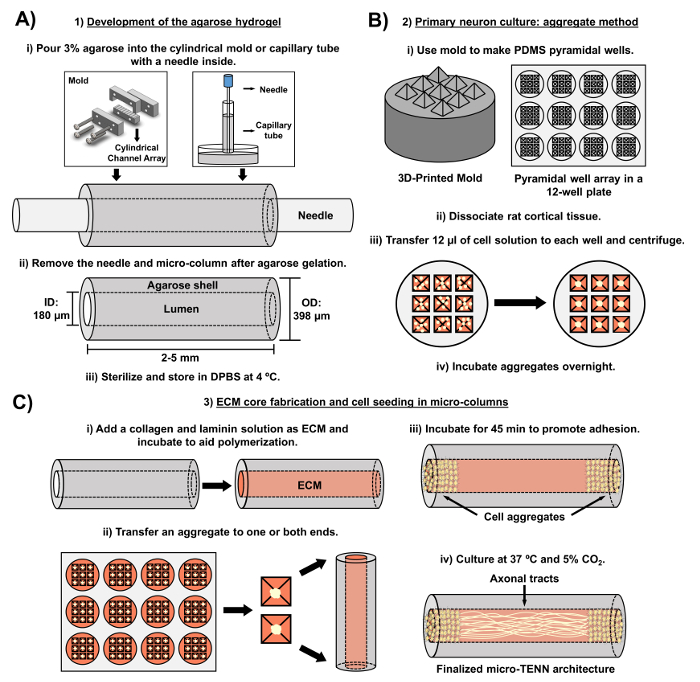
Figure 2: diagramme schématique du processus de fabrication micro-TENN en trois étapes. ( A ) Développement de l'hydrogel d'agarose: (i) Initialement, une petite aiguille d'acupuncture ( par exemple , 180-350 μm de diamètre) est insérée dans les canaux cylindriques d'un moule fabriqué sur mesure, coupé au laser ou un tube capillaire ( p. Ex. , 380-700 μm de diamètre). Dans l'étape suivante, l'agarose liquide dans le DPBS est introduit dans les canaux cylindriques ou les tubes capillaires. (Ii) Après les gels d'agarose, l'aiguille est enlevée etLe moule est démonté pour produire les micro colonnes creuses d'agarose. (Iii) Ces constructions sont ensuite stérilisées et stockées dans DPBS. ( B ) Culture de neurones primaires et méthode globale: (i) L'agrégation neuronale est réalisée dans des réseaux de micro-puits pyramidaux, issus de moules imprimés en 3D, qui s'ajustent dans les puits d'une plaque de culture à 12 puits. (Ii) Les micro-TENN incluent des neurones primaires de rat dissociés des cerveaux fœtaux des rats embryonnaires-jour-18. Après la dissociation tissulaire avec la trypsine-EDTA et la DNase I, on prépare une solution cellulaire avec une densité de 1,0-2,0 x 10 6 cellules / mL. (Iii) 12 μL de cette solution sont transférés à chaque puits dans le réseau de micro-puits pyramidale. La plaque contenant ces micro-puits est centrifugée pour produire des agrégats cellulaires. (Iv) Ils sont ensuite incubés toute la nuit avant le placage dans les micro-colonnes. ( C ) Fabrication de noyau d'ECM et semence cellulaire: (i) Avant l'ensemencement cellulaire, une solution ECM contenant 1 mg / mL de collagène de type I et 1 mg / mLLa laminine est transférée à l'intérieur des micro-TENN et autorisée à la polymériser. (Ii) Selon que des micro-TENN unidirectionnels ou bidirectionnels sont fabriqués, un agrégat est placé à l'un ou à l'autre des extrêmes de la micro-colonne, respectivement. (Iii) Après une période d'incubation pour favoriser l'adhérence, les micro-TENN sont cultivés dans des boîtes de Petri inondées de milieu basal neuronal embryonnaire complété. (Iv) Après 3-5 jours en culture, la structure micro-TENN finale devrait démontrer les agrégats cellulaires aux extrêmes de la micro-colonne, avec des tracés axonaux s'étendant sur sa longueur. Cliquez ici pour voir une version plus grande de ce chiffre.
Protocol
Representative Results
Discussion
La lésion et la maladie du SNC entraînent généralement la perte ou le dysfonctionnement des voies axonales à longue distance qui comprennent le connecteur du cerveau, avec ou sans dégénérescence neuronale concomitante. Ceci est aggravé par la capacité limitée du SNC à favoriser la neurogénèse et la régénération. Malgré la poursuite de stratégies de réparation telles que le facteur de croissance, la cellule et la délivrance de biomatériaux comme approches individuelles ou combinatoires, ces techniqu…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Le soutien financier a été fourni par les National Institutes of Health U01-NS094340 (Cullen), T32-NS043126 (Harris) et F31-NS090746 (Katiyar)), la Fondation Michael J. Fox (Programme thérapeutique sur les pipelines n ° 9998 (Cullen)), Le Prix pilote Penn Medicine Neuroscience Center (Cullen), la Fondation nationale pour la science (bourses de recherche pour les diplômés DGE-1321851 (Struzyna et Adewole)), le ministère des Anciens Combattants (RR et D Merit Review # B1097-I (Cullen)), l'American Association Des chirurgiens neurologiques et du Congrès des chirurgiens neurologiques (2015-2016 Codman Fellowship in Neurotrauma and Critical Care (Petrov)) et le Commandement de la recherche médicale et du matériel de l'armée américaine (# W81XWH-13-207004 (Cullen) et W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

