Anatomiskt inspirerade tredimensionella mikrovävnadsgenererade neurala nätverk för nervsystemet återuppbyggnad, modulering och modellering
Summary
Detta manuskript beskriver tillverkningen av mikrovävnadsmetriska neurala nätverk: tredimensionella mikronstorlekskonstruktioner bestående av långlinjerade axonala kanaler som spänner över aggregerade neuronpopulationer som är inneslutna i en tubulär hydrogel. Dessa levande byggnadsställningar kan fungera som funktionella reläer för att rekonstruera eller modulera neurala kretsar eller som biofideliska testbäddar som efterliknar gråvit substans neuroanatomi.
Abstract
Funktionell återhämtning sker sällan efter skada eller sjukdomsinducerad degenerering inom centrala nervsystemet (CNS) på grund av den inhiberande miljön och den begränsade kapaciteten för neurogenes. Vi utvecklar en strategi för att samtidigt ta itu med neuronal och axonal banaförlust inom det skadade nervsystemet. Detta manuskript presenterar tillverkningsprotokollet för mikrovävnaderstekniska neurala nätverk (mikro-TENN), implanterbara konstruktioner som består av neuroner och inriktade axonala kanaler som spänner över den extracellulära matrisen (ECM) lumen av en förformad hydrogelcylinder hundratals mikron i diameter som kan sträcka sig i centimeter i längd. Neuronala aggregat är avgränsade till ytterdimensionerna av den tredimensionella kåpan och spänns av axonala utsprång. Mikro-TENN är unikt balanserade som en strategi för återuppbyggnad av CNS, emulerande aspekter av cytomarkitektur i hjärnans kontakt och möjligen tillhandahålla medel för nätverksbyte. Den neuRonala aggregat kan synaps med värdvävnad för att bilda nya funktionella reläer för att återställa och / eller modulera saknade eller skadade kretsar. Dessa konstruktioner kan också fungera som proregenerativa "levnadsställare" som kan exploatera utvecklingsmekanismer för cellmigration och axonal pathfinding, vilket ger synergistiska strukturella och lösliga signaler baserat på regenereringsstatus. Mikro-tenn tillverkas genom att hälla flytande hydrogel i en cylindrisk form som innehåller en längsgående centrerad nål. När hydrogelen har gelat, avlägsnas nålen och lämnar en ihålig mikrokolonn. En ECM-lösning läggs till lumenet för att ge en miljö lämplig för neuronadhesion och axonal utväxt. Dissocierade neuroner aggregeras mekaniskt för exakt sådd i en eller båda ändarna av mikrokolonnen. Denna metod ger tillförlitligt självständiga miniatyrkonstruktioner med långprojektiva axonala områden som kan rekapitulera egenskaper hos neuroanatomi i hjärnan. Synaptisk immUnolabeling och genetiskt kodade kalciumindikatorer antyder att mikro-TENN har en omfattande synaptisk fördelning och inneboende elektrisk aktivitet. Följaktligen representerar mikro-tenn en lovande strategi för målinriktad neurokirurgisk rekonstruktion av hjärnvägar och kan även användas som biofideliska modeller för att studera neurobiologiska fenomen in vitro .
Introduction
En vanlig egenskap hos störningar och sjukdomar i centrala nervsystemet (CNS), såsom traumatisk hjärnskada (TBI), ryggmärgsskada (SCI), stroke, Alzheimers sjukdom och Parkinsons sjukdom är avbrytandet av axonala vägar och neuronal cell Förlust 1 , 2 , 3 , 4 , 5 , 6 . När exempelvis en ischemisk stroke går obehandlad uppskattas det att axoner förloras med en hastighet av 7 miles axon per minut 5 . När det gäller TBI, som ungefär 1,7 miljoner människor upplever varje år i USA ensam, kan axonal degeneration fortsätta att inträffa år efter trauma, eftersom den initiala skaden utfäller ett långtids neurodegenerativt tillstånd 4 . Försvårande av dessa skadliga effekter har CNS en kraftigt begränsad capaStad för regenerering 1 , 7 , 8 , 9 . Efter skada utvecklas en hämmande miljö som kännetecknas av brist på riktad vägledning till avlägsna mål, närvaron av myelinhämmande hämmare som hindrar neuritutväxten och bildandet av ett glialär av reaktiva astrocyter 8 , 10 , 11 , 12 . Glialärret tjänar som en biokemisk och fysisk barriär mot regenerering, med molekyler som kondroitinsulfatproteoglykaner som hindrar axonutväxten 8 , 11 . Dessutom, även om neurala stamceller har hittats i vuxna CNS, är produktionen av nya neuroner begränsad, eftersom konsekventa bevis på neurogenes endast har hittats i luktlampan, den hippocampalaSubgranulär zon, periventrikulärt område och ryggmärgs 13 , 14 centrala kanal. Dessa hinder hindrar funktionell återhämtning av förlorade neuroner och vit materia arkitektur efter skada eller sjukdom, vilket resulterar i de ofta livsförändrande och långvariga effekterna av dessa tillstånd.
Trots bristen på regenerativ kapacitet hos vuxna CNS har det visat sig att axonal regenerering är möjlig om adekvata miljöanpassningar presenteras för värdvärdena neuroner 15 , 16 , 17 , 18 . Forskare har försökt leverera och manipulera tillväxtfaktorer ( t.ex. nervtillväxtfaktor, epidermal tillväxtfaktor, glialberoende tillväxtfaktor och neurotrofisk faktor-3) och andra vägledningsmolekyler för att stimulera plasticitet och axonregenerering 14 , </ Sup> 18 , 19 . Trots att dessa studier har bekräftat att vuxna axoner är kapabla att reagera på tillväxtfaktorer begränsas dessa strategier av lågt permeabilitet hos blod-hjärnbarriären och de specifika rumsliga och temporala gradienterna som krävs för att främja regenerering 14 , 18 , 19 . Andra tillvägagångssätt har åberopat hyperaktivering av regenerationsrelaterade transkriptionsfaktorer i CNS-neuroner. Till exempel stimulerade överuttryck av stat3-transkriptionsfaktorn axonal regenerering i optisk nerv 20 . Ändå misslyckas både biomolekylavgivning och överuttryck av transkriptionsfaktorer att ersätta förlorade neuronpopulationer. Cellbaserade strategier har huvudsakligen koncentrerat sig på transplantation av neurala stamceller (NSC) i CNS, med fördel av deras förmåga att ersätta CNS-neuroner, frigöra trofiska faktorer,Och stödja försöken på neurogenes som uppträder efter skada 17 . Trots detta finns det fortfarande pressande utmaningar som hindrar detta tillvägagångssätt, inklusive de transplanterade neurala cellernas hämmade förmåga att överleva, integrera med värden och förbli spatialt begränsad till det skadade området 6 , 14 , 17 , 21 . Dessutom är celltillförsel enbart oförmögen att återinföra cytoarkitekturen av skadade eller förlorade axonala vägar. Ett alternativt tillvägagångssätt som behandlar problemen med cell- och läkemedels- och kemikalieleveransstrategier är att kombinera dessa metoder med användningen av biomaterial 14 , 22 , 23 . Biomaterial som hydrogeler kan emulera de biokemiska och fysikaliska egenskaperna hos den extracellulära matrisen (ECM), som hjälper till vid celltillförsel enD retention inom det skadade området och leverera tillväxtfaktorer och andra bioaktiva molekyler med kontrollerat frisättning 22 . De attraktiva egenskaperna hos dessa biomaterialbaserade strategier har resulterat i bevis på in vivo axonal regenerering efter transplantation av byggnadsställningar till det belastade området 24 , 25 , 26 , 27 , 28 , 29 , 30 . Emellertid ersätter acellulära biomaterialstrategier inte förlorade neuronala populationer; När de används som leveransfordon för neuron-, glial- eller neuronprekursorceller, är biomaterialen inte kapabla att rekonstituera axonala nätverk på lång avstånd. Utmaningen att utveckla ett tillvägagångssätt som tacklar både den axonala vävnadsdegenerationen och neuronförlusten i samband med CNS-skada och sjukdom kvarstår <Sup class = "xref"> 31.
Vår forskningsgrupp rapporterade tidigare utvecklingen av implanterbara mikrovågsmetallerade neurala nätverk (mikro-TENN), som är en typ av "levnadsställare" som består av neuroncellceller som är bundna till en eller båda ändarna av en agaroshydrogel-ECM-mikrokolonn , Med orienterade axonala kanaler som sträcker sig genom det inre av denna tredimensionella (3D) inneslutning 1 , 10 , 31 , 32 . En av de största skillnaderna mellan denna teknik och tidigare tillvägagångssätt är att cytoarkitekturen av mikro-TENN är skapad helt in vitro och transplanteras efteråt 33 , 34 , 35 , 36 , 37 , 38 , <Sup class = "xref"> 39 , 40 , 41 . In vitro- tillverkning erbjuder omfattande rumslig och tidsmässig kontroll av cellulär fenotyp och orientering, mekaniska / fysikaliska egenskaper, biokemiska signaler och exogena faktorer, vilket gynnar integrationen av dessa byggnadsställningar med värden efter implantationen 41 , 42 . Mikro-Tenn är anatomiskt inspirerade eftersom de emulerar neuroanatomi i hjärnan, som visar axonala områden som liknar de som överbryggar distinkta funktionella regioner i hjärnan ( Figur 1A ) 1 . Därför kan denna strategi kunna fysiskt ersätta förlorade vita substansområden och neuroner efter implantation till en belastad region. Denna teknik är också inspirerad av utvecklingsmekanismer där "naturliga levnadsställningar" som bildas av radiella glialceller och banbrytande axoner fungerar som vägleder guider för cellMigration från subventrikulär zon och axonal utväxt, respektive 43 . Dessa mekanismer återfinns i de anpassade axonala områdena av mikro-TENN, som kan presentera levande vägar för neural cellmigration och axonal regenerering genom axonmedierad axonal utväxt ( Figur 1C ) 43 . Vidare utnyttjar denna strategi synaptisk integration mellan mikro-TENN-neuronerna och de inhemska kretsarna, som bildar nya reläer som kan bidra till funktionell återhämtning ( Figur 1B ) 43 . Kapaciteten för synapsbildning kan också ge detta tillvägagångssätt förmågan att modulera CNS och reagera på värdvävnad enligt nätverksåterkoppling. Till exempel kan optogenetiskt aktiva neuroner i de levande ställningarna stimuleras för att modulera värdneuroner genom synaptiska interaktioner ( Figur 1D ).
Dessutom är den biomaterialbaserade rörformigaUgn av mikro-TENN erbjuder en lämplig miljö för celladhesion, tillväxt, neuritillägg och signalering, medan konstruktionens miniatyrdimensioner möjliggör minimalt invasiv implantering och ger en delvis sekvestrerad mikromiljö för gradvis integration i hjärnan. Faktum är att senaste publikationer har visat potentialen hos mikro-tenn att efterlikna neurala vägar efter implantation i råtthjärnan. Efter stereotaxisk mikroinjektion rapporterade vi tidigare bevis på mikro-TENN-neuronal överlevnad, underhåll av axonaltraktionsarkitektur och neuritillförsel i värdcortexen till minst 1 månad in vivo 10 , 31 . Vidare gav märkning med synapsin histologiska bevis på synaptisk integration med nativ vävnad 10 , 31 . Sammantaget kan mikro-tenn vara unikt anpassade för att rekonstruera och modulera skadadeCNS genom att ersätta förlorade neuroner, synaptiskt integrera med värdkretsen, återställa förlorad axonal cytoarkitektur och, i vissa fall, tillhandahålla regenererande axoner med lämpliga sökvägsljus.
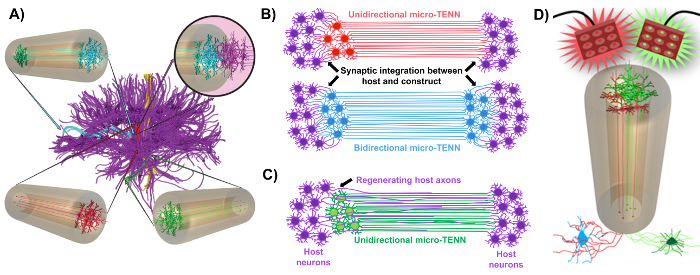
Figur 1: Principer och inspiration bakom utvecklingen av mikrovävnadstekniska neurala nätverk (mikro-TENN). ( A ) Micro-TENNs efterliknar cytoarkitekturen i hjärnans anslutning (lila), i vilken funktionellt distinkta regioner är kopplade med långa, inriktade axonala områden i enriktad (röd, grön) eller dubbelriktad (blå) väg. Till exempel kan mikro-tenn rekonstruera förlorade förbindelser i kortikotalamiska och nigrostriatala vägar eller i perforantvägen från entorhinal cortex till hippocampus (anpassad från Struzyna et al. , 2015) 1 . ( B ) Diagram över en enhetlig riktningL och dubbelriktad mikro-TENN (röd respektive blå) synaptiskt integrera med värdkretsen (lila) för att fungera som ett funktionellt relä mellan båda ändarna av en lesion. ( C ) Schematisk av axonaltraktionerna i en enriktad mikro-TENN (grön) som tjänar som en vägledning för axon-underlättad regenerering av värdaxoner (lila) mot ett mål som mikro-TENN interagerar med. ( D ) Konceptuellt diagram över användningen av optogenetiskt aktiva mikro-TENNS som neuromodulatorer, utnyttja synaptisk integration med excitatoriska eller hämmande neuroner (botten). Vänligen klicka här för att se en större version av denna figur.
Det nuvarande manuskriptet beskriver den metod som används för att tillverka mikro-TENN med användning av embryonellt härledda cerebrala kortikala nervceller. Speciellt kan mikro-tenn tillverkas med andra typer av neurala celler. För exRiklig, de första rapporterna om framgångsrik mikro-TENN-utveckling presenterade dorsala root ganglion (DRG) neuroner 32 . Hydrogelmikrokolumnerna kan alstras ( Figur 2A ) genom att tillsätta flytande agaros till en skräddarsydd, laserskärd cylindrisk kanalgrupp eller till kapillärrör, vilka båda innehåller inriktade akupunkturnålor. Nålen bildar lumen och bestämmer mikrokolonnens innerdiameter (ID), medan kapillärrörets ID och diametern hos cylindrarna i den laserskärda anordningen dikterar konstrukternas ytterdiameter (OD). OD och ID kan väljas enligt önskad applikation genom att välja olika diametrar för anordning / kapillärrör respektive akupunkturnålar. Längden på mikrokolumnerna kan också varieras; Hittills har vi rapporterat konstruktionen av mikro-tenn upp till 20 mm i längd 10 och arbetar aktivt med längre längder. Efter agarosgelerna och akupunkturen nEedlar avlägsnas, en ECM-lösning som i allmänhet består av kollagen av typ I och laminin tillsätts till konstruktionens lumen ( figur 2C ). ECM-kärnan ger en byggnadsställning som stödjer neuronal celladhesion och axonal utväxt. Ursprungligen pläterades primära råtta-kortikala neuroner i mikrokolonnerna med användning av dissocierade cellsuspensioner 10 , 31 , 32 . Detta tillvägagångssätt producerade emellertid inte målcytoarkitekturen i alla fall, som definierades som neuroncellcellerna begränsade till ändarna av mikrokolumnerna, varvid den centrala lumen bestod av rena inriktade axonala kanaler. Sedan dess har användningen av en tvungen neuronal aggregeringsmetod (baserat på protokoll anpassade från Ungrin et al .) Möjliggjort en mer pålitlig och konsekvent tillverkning av mikro-TENN med den ideala strukturen ( Figur 2B ) 44 . Förutom att beskriva strömmenMetodik, kommer denna artikel att visa representativa faskontrast och konfokala bilder av mikro-TENN som visar bildandet av axonala kanaler över tiden, såväl som den slutliga målcytokarchitecturen. Detta manuskript kommer också att expandera på anmärkningsvärda aspekter av protokollet och återstående utmaningar och framtida riktningar för mikro-TENN-tekniken.
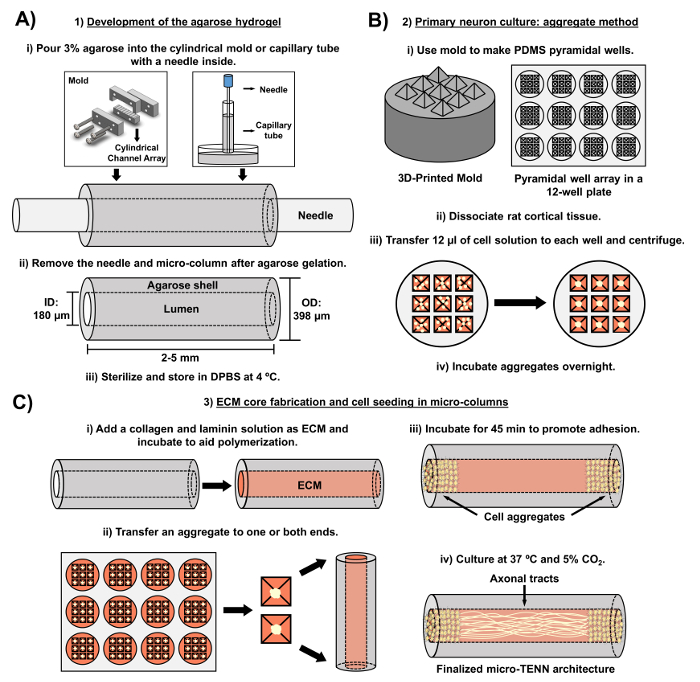
Figur 2: Schematiskt diagram över tre-stegs mikro-TENN-tillverkningsprocessen. ( A ) Utveckling av agaroshydrogelen: (i) Initialt införs en liten akupunkturnål ( t.ex. 180-350 um diameter) i de cylindriska kanalerna av en skräddarsydd, laserskärd form eller ett kapillärrör ( t.ex. , 380-700 pm i diameter). I nästa steg införs flytande agaros i DPBS i de cylindriska kanalerna eller kapillärrören. (Ii) Efter agarosgelerna avlägsnas nålen ochFormen avmonteras för att ge de ihåliga agarosmikolonnerna. (Iii) Dessa konstruktioner steriliseras sedan och lagras i DPBS. ( B ) Primär neuronkultur och aggregatmetoden: (i) Neuronal aggregering utförs i pyramidala mikrobrunnsarrayer, gjutna av 3D-tryckta formar, som passar in i brunnarna i en 12-brunns odlingsplatta. (Ii) Mikro-TENN inkluderar primära råttneuroner dissocierade från fostrets hjärnor av embryonala-18-råttor. Efter vävsdissociation med trypsin-EDTA och DNas I framställs en celllösning med en densitet av 1,0-2,0 x 106 celler / ml. (Iii) 12 | il av denna lösning överförs till varje brunn i den pyramidala mikrobrunnmatrisen. Plattan innehållande dessa mikrobrunnar centrifugeras för framställning av cellaggregat. (Iv) Dessa inkuberas sedan över natten före plätering i mikrokolonnerna. ( C ) ECM-kärntillverkning och cellsåning: (i) Före cellsåkning fick en ECM-lösning innehållande 1 mg / ml typ I-kollagen och 1 mg / mlLaminin överförs till det inre av mikro-tenn och tillåts polymerisera. (Ii) Beroende på huruvida enriktad eller dubbelriktad mikro-TENN tillverkas, placeras ett aggregat vid respektive ena eller båda extremiteterna av mikrokolonnen. (Iii) Efter en inkubationsperiod för att främja vidhäftning odlas mikro-TENN i petriskålar som översvämmas med kompletterat embryonalt neuronalt basalt medium. Iv) Efter 3-5 dagar i odling bör den slutliga mikro-TENN-strukturen demonstrera cellaggregat vid ytterkolumnerna, med axonala kanaler som sträcker sig över längden. Vänligen klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
CNS-skada och sjukdom resulterar typiskt i förlust eller dysfunktion hos de långväga axonala vägarna som innefattar hjärnans anslutning, med eller utan samtidig neuronal degenerering. Detta förhöjs av den begränsade kapaciteten hos CNS för att främja neurogenes och regenerering. Trots strävan efter reparationsstrategier, såsom tillväxtfaktor, cell- och biomaterialleverans som individuella eller kombinatoriska tillvägagångssätt, misslyckas dessa tekniker samtidigt för att ta hänsyn till både degenerati…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Finansiellt stöd tillhandahölls av National Institute of Health U01-NS094340 (Cullen), T32-NS043126 (Harris) och F31-NS090746 (Katiyar)), Michael J. Fox Foundation (Therapeutic Pipeline Program # 9998 (Cullen) Penny Medicine Neuroscience Center Pilot Award (Cullen), National Science Foundation (forskarutbildning stipendier DGE-1321851 (Struzyna och Adewole)), Veteransfrågor (RR & D Merit Review # B1097-I (Cullen)), American Association Neurologiska kirurger och kongress för neurologiska kirurger (Codman Society of Neurotrauma och Critical Care, 2015-2016) och US Army Medical Research and Materials Command (# W81XWH-13-207004 (Cullen) och W81XWH-15-1- 0466 (Cullen)).
Materials
| Laser cutter | Universal Laser Systems | PLS4.75 | Used to fabricate the laser-cut micro-channel mold. |
| Laser-cut micro-column fabrication device | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Screws | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Nuts | ————– | ————– | #4-40 with a thread diameter of 3.05 mm |
| Acupuncture needle (180 µm diameter) | Lhasa Medical | sj.16X40 | The diameter may be varied according to the desired size for the micro-column lumen. |
| Petri dish | Fisher | 08772B | |
| Dulbecco's phosphate buffered saline (DPBS) | Invitrogen | 14200075 | |
| Polystyrene disposable serological pipet | Fisher | 13-678-11D | |
| Agarose | Sigma | A9539-50G | |
| Capillary tube (398 µm diameter) | Fisher | 21170D | The diameter may be varied according to the desired size for the micro-column shell. |
| Hot plate | Fisher | SP88857200 | |
| Magnetic bar | Fisher | 1451352 | |
| Micropipette | Sigma | Z683884-1EA | |
| 25 mm gauge needle | Fisher | 14-826-49 | |
| Microscalpel | Roboz Surgical | RS-6270 | |
| Scissors | Fine Science Tools | 14081-09 | |
| Forceps | World Precision Instruments | 501985 | |
| Hot bead sterilizer | Sigma | Z378550-1EA | |
| Stereoscope | Nikon | SMZ800N | Used for all dissection steps and for micro-TENN fabrication. |
| Rat tail type I collagen | Corning | 354236 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Microcentrifuge tube | Fisher | 02-681-256 | |
| Mouse laminin | Corning | 354232 | Maintain at 4 ºC and remove only when needed. Use ice to preserve its temperature when in use. |
| Neurobasal medium | Invitrogen | 21103049 | Basal medium for the culture of pre-natal and embryonic neuronal cells. Store at 4ºC and warm at 37 ºC before use. |
| Sodium hydroxide (NaOH) | Fisher | SS2661 | |
| Hydrochloric acid (HCl) | Fisher | SA48-1 | |
| Litmus paper | Fisher | 09-876-18 | |
| Hank's balanced salt solution (HBSS) | Invitrogen | 14170112 | Store at 4 ºC. |
| 0.25% Trypsin-EDTA | Invitrogen | 25200056 | Store at -20 ºC and warm at 37 ºC before use. |
| Bovine pancreatic deoxyribonuclease (DNase) I | Sigma | 10104159001 | Store at -20 ºC and warm at 37 ºC before use. |
| B-27 Supplement | Invitrogen | 12587010 | Supplement added to Neurobasal medium for the culture of hippocampal and cortical neurons. Store at -20 ºC and warm at 37 ºC before use. |
| L-glutamine | Invitrogen | 35050061 | Store at -20 ºC and warm at 37 ºC before use. |
| Sprague Dawley embryonic day 18 rats | Charles River | Strain 001 | |
| Pasteur pipette | Fisher | 22-042816 | |
| 15 mL centrifuge tube | EMESCO | 1194-352099 | |
| Vortex | Fisher | 02-215-414 | |
| Centrifuge | Fisher | 05-413-115 | |
| Hemocytometer | Fisher | 02-671-6 | |
| Objet30 3D-Printer | Stratasys | ————– | Used to fabricate the pyramidal micro-well molds. |
| 3D-printed pyramidal well mold | Custom-made | ————– | Contact our research group if interested. Dimensions and blueprints provided in the manuscript. |
| Polydimethylsiloxane (PDMS) and curing agent | Fisher | NC9285739 | Comes as kit with elastomer and curing agent. Use inside a chemical fume hood. |
| Funnel | Fisher | 10-348C | |
| 1 ml pipette bulb | Sigma | Z509035 | |
| Micro-spatula | Fisher | S50821 | |
| 12-well culture plate | EMESCO | 1194-353043 | |
| Oven | Fisher | 11-475-154 | |
| Incubator | Fisher | 13 998 076 | |
| AAV1.Syn.GCaMP6f.WPRE.SV40 | UPenn Vector Core | 36373 | Store at -80ºC. Commercially available adeno-associated virus (AAV) with the GCaMP6f calcium indicator. |
| Formaldehyde 40% | Fisher | F77P-4 | Formaldehyde is a toxic compound known to be carcinogenic, and must be disposed of in a separate container. |
| Triton X-100 | Sigma | T8787 | Non-ionic surfactant used to permeabilize cell membranes. |
| Horse serum | Gibco | 16050-122 | |
| Mouse anti-Tuj-1/beta-III tubulin primary antibody | Sigma | T8578-200UL | Store at -20ºC. |
| Rabbit anti-synapsin 1 primary antibody | Synaptic Systems | 106-001 | Store at -20ºC. |
| Donkey anti-mouse 568 secondary antibody | Invitrogen | A10037 | Store at 4ºC. |
| Donkey anti-rabbit 488 secondary antibody | Invitrogen | A21206 | Store at 4ºC. |
| Hoechst 33342, Trihydrochloride | Invitrogen | H3570 | Store at 4ºC. Hoechst is a known mutagen that should be treated as a carcinogen. Therefore, it must be disposed of in a separate container. |
| A1RSI Laser Scanning Confocal Microscope | Nikon | ————– | Used for taking the confocal reconstructions of immunolabeled constructs. |
| Eclipse Ti-S Microscope | Nikon | ————– | Used for taking the phase-contrast images. With digital image acquisition using a QiClick camera interfaced with Nikon Elements Basic Research software (4.10.01). |
| High-speed Fluorescence Microscope | Nikon | ————– | Nikon Eclipse Ti microscope paired with an ANDOR Neo/Zyla camera for calcium imaging. |
| NIS Elements AR 4.50.00 Software | Nikon Instruments | ————– | Used to identify calcium transients from the recordings taken with the high-speed fluorescence microscope. |
References
- Struzyna, L. A., Harris, J. P., Katiyar, K. S., Chen, H. I., Cullen, D. K. Restoring nervous system structure and function using tissue engineered living scaffolds. Neural Regen. Res. 10 (5), 679-685 (2015).
- Tallantyre, E. C., Bø, L., et al. Clinico-pathological evidence that axonal loss underlies disability in progressive multiple sclerosis. Mult. Scler. 16 (4), 406-411 (2010).
- Cheng, H. C., Ulane, C. M., Burke, R. E. Clinical Progression in Parkinson Disease and the Neurobiology of Axons. Ann. Neurol. 67 (6), 715-725 (2010).
- Johnson, V. E., Stewart, W., Smith, D. H. Axonal pathology in traumatic brain injury. Exp. Neurol. 246, 35-43 (2013).
- Hinman, J. D. The back and forth of axonal injury and repair after stroke. Curr. Opin. Neurol. 27 (6), 615-623 (2014).
- Li, X., Katsanevakis, E., Liu, X., Zhang, N., Wen, X. Engineering neural stem cell fates with hydrogel design for central nervous system regeneration. Prog. Polym. Sci. 37 (8), 1105-1129 (2012).
- Horner, P. J., Gage, F. H. Regenerating the damaged central nervous system. Nature. 407 (6807), 963-970 (2000).
- Yiu, G., He, Z. Glial inhibition of CNS axon regeneration. Nat. Rev. Neurosci. 7 (8), 617-627 (2006).
- Montani, L., Petrinovic, M. M. Targeting Axonal Regeneration: The Growth Cone Takes the Lead. J. Neurosci. 34 (13), 4443-4444 (2014).
- Struzyna, L. A., Wolf, J. A., et al. Rebuilding Brain Circuitry with Living Micro-Tissue Engineered Neural Networks. Tissue Eng. Part A. 21 (21-22), 2744-2756 (2015).
- Huebner, E. a., Strittmatter, S. M. Axon Regeneration in the Peripheral and Central Nervous Systems. Results Probl. Cell Differ. 48, 339-351 (2009).
- Benowitz, L. I., Yin, Y. Combinatorial Treatments for Promoting Axon Regeneration in the CNS: Strategies for Overcoming Inhibitory Signals and Activating Neurons’ Intrinsic Growth State. Dev. Neurobiol. 67 (9), 1148-1165 (2007).
- Lie, D. C., Song, H., Colamarino, S. A., Ming, G., Gage, F. H. Neurogenesis in the Adult Brain: New Strategies for Central Nervous System Diseases. Annu. Rev. Pharmacol. Toxicol. 44, 399-421 (2004).
- Gao, Y., Yang, Z., Li, X. Regeneration strategies after the adult mammalian central nervous system injury-biomaterials. Regen. Biomater. 3 (2), 115-122 (2016).
- Benfey, M., Aguayo, A. J. Extensive elongation of axons from rat brain into peripheral nerve grafts. Nature. 296 (11), 150-152 (1982).
- David, S., Aguayo, A. J. Axonal Elongation into Peripheral Nervous System “Bridges” after Central Nervous System Injury in Adult Rats. Science. 214 (4523), 931-933 (1981).
- Shoichet, M. S., Tate, C. C., Baumann, M. D., LaPlaca, M. C. Strategies for Regeneration and Repair in the Injured Central Nervous System. Indwelling Neural Implant. Strateg. Contend. with Vivo Environ. , (2008).
- Lu, P., Tuszynski, M. H. Growth factors and combinatorial therapies for CNS regeneration. Exp. Neurol. 209 (2), 313-320 (2008).
- Curinga, G., Smith, G. M. Molecular/genetic manipulation of extrinsic axon guidance factors for CNS repair and regeneration. Exp. Neurol. 209 (2), 333-342 (2008).
- Mehta, S. T., Luo, X., Park, K. K., Bixby, J. L., Lemmon, V. P. Hyperactivated Stat3 boosts axon regeneration in the CNS. Exp. Neurol. 280, 115-120 (2016).
- Elliott Donaghue, I., Tam, R., Sefton, M. V., Shoichet, M. S. Cell and biomolecule delivery for tissue repair and regeneration in the central nervous system. J. Control. Release. 190, 219-227 (2014).
- Tam, R. Y., Fuehrmann, T., Mitrousis, N., Shoichet, M. S. Regenerative therapies for central nervous system diseases: a biomaterials approach. Neuropsychopharmacology. 39 (1), 169-188 (2014).
- Cullen, D. K., Wolf, J. A., Smith, D. H., Pfister, B. J. Neural Tissue Engineering for Neuroregeneration and Biohybridized Interface Microsystems In vivo (Part 2). Crit. Rev. Biomed. Eng. 39 (3), 243-262 (2011).
- Han, Q., Jin, W., et al. The promotion of neural regeneration in an extreme rat spinal cord injury model using a collagen scaffold containing a collagen binding neuroprotective protein and an EGFR neutralizing antibody. Biomaterials. 31 (35), 9212-9220 (2010).
- Suzuki, H., Kanchiku, T., et al. Artificial collagen-filament scaffold promotes axon regeneration and long tract reconstruction in a rat model of spinal cord transection. Med. Mol. Morphol. 48 (4), 214-224 (2015).
- Silva, N. A., Salgado, A. J., et al. Development and Characterization of a Novel Hybrid Tissue Engineering-Based Scaffold for Spinal Cord Injury Repair. Tissue Eng. Part A. 16 (1), 45-54 (2009).
- Moore, M. J., Friedman, J. A., et al. Multiple-channel scaffolds to promote spinal cord axon regeneration. Biomaterials. 27 (3), 419-429 (2006).
- Tsai, E. C., Dalton, P. D., Shoichet, M. S., Tator, C. H. Synthetic hydrogel guidance channels facilitate regeneration of adult rat brainstem motor axons after complete spinal cord transection. J. Neurotrauma. 21 (6), 789-804 (2004).
- Chen, B. K., Knight, A. M., et al. Axon regeneration through scaffold into distal spinal cord after transection. J. Neurotrauma. 26 (10), 1759-1771 (2009).
- Jain, A., Kim, Y. -. T., McKeon, R. J., Bellamkonda, R. V. In situ gelling hydrogels for conformal repair of spinal cord defects, and local delivery of BDNF after spinal cord injury. Biomaterials. 27 (3), 497-504 (2006).
- Harris, J. P., Struzyna, L. A., Murphy, P. L., Adewole, D. O., Kuo, E., Cullen, D. K. Advanced biomaterial strategies to transplant preformed micro-tissue engineered neural networks into the brain. J. Neural Eng. 13 (1), 16019-16037 (2016).
- Cullen, D. K., Tang-Schomer, M. D., et al. Microtissue engineered constructs with living axons for targeted nervous system reconstruction. Tissue Eng. Part A. 18 (21-22), 2280-2289 (2012).
- Tate, M. C., Shear, D. A., Hoffman, S. W., Stein, D. G., Archer, D. R., LaPlaca, M. C. Fibronectin promotes survival and migration of primary neural stem cells transplanted into the traumatically injured mouse brain. Cell Transplant. 11 (3), 283-295 (2002).
- Denham, M., Parish, C. L., et al. Neurons derived from human embryonic stem cells extend long-distance axonal projections through growth along host white matter tracts after intra-cerebral transplantation. Front. Cell. Neurosci. 6 (11), (2012).
- Fawcett, J. W., Barker, R. A., Dunnet, S. B. Dopaminergic neuronal survival and the effects of bFGF in explant, three dimensional and monolayer cultures of embryonic rat ventral mesencephalon. Exp. Brain Res. 106 (2), 275-282 (1995).
- Mine, Y., Tatarishvili, J., Oki, K., Monni, E., Kokaia, Z., Lindvall, O. Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats. Neurobiol. Dis. 52, 191-203 (2013).
- Ren, H., Chen, J., Wang, Y., Zhang, S., Zhang, B. Intracerebral neural stem cell transplantation improved the auditory of mice with presbycusis. Int. J. Clin. Exp. Pathol. 6 (2), 230-241 (2013).
- Sinclair, S. R., Fawcett, J. W., Dunnett, S. B. Dopamine cells in nigral grafts differentiate prior to implantation. Eur. J. Neurosci. 11 (12), 4341-4348 (1999).
- Tate, C. C., Shear, D. A., Stein, D. G., Tate, M., LaPlaca, M. C., Archer, D. R. Laminin and fibronectin scaffolds enhance neural stem cell transplantation into the injured brain. J. Tissue Eng. Regen. Med. 3 (3), 208-217 (2009).
- Yoo, S. J., Kim, J., Lee, C. -. S., Nam, Y. Simple and novel three dimensional neuronal cell culture using a micro mesh scaffold. Exp. Neurobiol. 20 (2), 110-115 (2011).
- Chen, H. I., Jgamadze, D., Serruya, M. D., Cullen, D. K., Wolf, J. A., Smith, D. H. Neural Substrate Expansion for the Restoration of Brain Function. Front. Syst. Neurosci. 10, (2016).
- Cullen, D. K., Wolf, J. A., Vernekar, V. N., Vukasinovic, J., LaPlaca, M. C. Neural tissue engineering and biohybridized microsystems for neurobiological investigation in vitro (Part 1). Crit. Rev. Biomed. Eng. 39 (3), 201-240 (2011).
- Struzyna, L. A., Katiyar, K., Cullen, D. K. Living scaffolds for neuroregeneration. Curr. Opin. Solid State Mater. Sci. 18 (6), 308-318 (2014).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), (2008).
- Dahotre, N. B., Harimkar, S. . Laser fabrication and machining of materials. , (2008).
- Kutter, J. P., Klank, H., Snakenborg, D. Microstructure fabrication with a CO2 laser system. J. Micromechanics Microengineering. 14 (2), (2004).
- Spicar-Mihalic, P., Houghtaling, J., Fu, E., Yager, P., Liang, T., Toley, B. CO2 laser cutting and ablative etching for the fabrication of paper-based devices. J. Micromechanics Microengineering. 23 (6), (2013).
- Pacifici, M., Peruzzi, F. Isolation and culture of rat embryonic neural cells: a quick protocol. J. Vis. Exp. (63), (2012).
- Cullen, D. K., Gilroy, M. E., Irons, H. R., Laplaca, M. C. Synapse-to-neuron ratio is inversely related to neuronal density in mature neuronal cultures. Brain Res. 1359, 44-55 (2010).
- Huang, J. H., Cullen, D. K., et al. Long-Term Survival and Integration of Transplanted Engineered Nervous Tissue Constructs Promotes Peripheral Nerve Regeneration. Tissue Eng. Part A. 15 (7), 1677-1685 (2009).
- Katiyar, K. S., Winter, C. C., Struzyna, L., Harris, J. P., Cullen, D. K. Mechanical elongation of astrocyte processes to create living scaffolds for nervous system regeneration. J. Tissue Eng. Regan. Med. , (2016).
- Howard, M. A., Baraban, S. C. Synaptic integration of transplanted interneuron progenitor cells into native cortical networks. J. Neurophysiol. 116 (2), 472-478 (2016).
- Wernig, M., Benninger, F., et al. Functional Integration of Embryonic Stem Cell-Derived Neurons In Vivo. J. Neurosci. 24 (22), 5258-5268 (2004).
- Ganguly, K., Poo, M. Activity-dependent neural plasticity from bench to bedside. Neuron. 80 (3), 729-741 (2013).
- Dancause, N. Extensive Cortical Rewiring after Brain Injury. J. Neurosci. 25 (44), 10167-10179 (2005).
- Winter, C. C., Katiyar, K. S., et al. Transplantable living scaffolds comprised of micro-tissue engineered aligned astrocyte networks to facilitate central nervous system regeneration. Acta Biomater. 38, 44-58 (2016).
- Adewole, D. O., Serruya, M. D., et al. The Evolution of Neuroprosthetic Interfaces. Crit. Rev. Biomed. Eng. 44 (1-2), 123-152 (2016).
- Cullen, D. K., Patel, A., Doorish, J. F., Smith, D. H., Pfister, B. J. Developing a tissue-engineered neural-electrical relay using encapsulated neuronal constructs on conducting polymer fibers. J. Neural Eng. 5 (4), 374-384 (2008).
- Cullen, D. K., Stabenfeldt, S. E., Simon, C. M., Tate, C. C., LaPlaca, M. C. In Vitro Neural Injury Model for Optimization of Tissue-Engineered Constructs. J. Neurosci. Res. 85, 3642-3651 (2007).
- Irons, H. R., Cullen, D. K., Shapiro, N. P., Lambert, N. A., Lee, R. H., Laplaca, M. C. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. J. Neural Eng. 5 (3), 333-341 (2008).
- Morrison, B. I., Cullen, D. K., LaPlaca, M. In Vitro Models for Biomechanical Studies of Neural Tissues. Stud. Mechanobiol. Tissue Eng. Biomater. 3, 247-285 (2011).
- Vukasinovic, J., Cullen, D. K., Laplaca, M. C., Glezer, A. A microperfused incubator for tissue mimetic 3D cultures. Biomed. Microdevices. 11 (6), 1155-1165 (2009).
- Cullen, D. K., Lessing, M. C., Laplaca, M. C. Collagen-dependent neurite outgrowth and response to dynamic deformation in three-dimensional neuronal cultures. Ann. Biomed. Eng. 35 (5), 835-846 (2007).
- LaPlaca, M. C., Vernekar, V. N., Shoemaker, J. T., Cullen, D. K. Three-dimensional neuronal cultures. Methods Bioeng. 3D Tissue Eng. , (2010).
- Chwalek, K., Tang-Schomer, M. D., Omenetto, F. G., Kaplan, D. L. In vitro bioengineered model of cortical brain. Nat. Protoc. 10 (9), 1362-1373 (2015).

