Une méthode standardisée pour mesurer la surface interne du poumon par la pneumonie et la prothèse
Summary
La zone de surface pulmonaire interne (ISA) est un critère critique pour évaluer la morphologie pulmonaire et la physiologie dans les maladies pulmonaires et la régénération alvéolaire induite par les blessures. Nous décrivons ici une méthode standardisée qui peut minimiser le biais de mesure pour ISA dans les modèles de la pneumonectomie pulmonaire et de la souris implantation de la prothèse.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
La fonction fondamentale du poumon est l'échange d'oxygène et de dioxyde de carbone entre les vaisseaux sanguins et l'atmosphère. Les maladies pulmonaires telles que la dysplasie bronchopulmonaire (BPD), la maladie pulmonaire obstructive chronique (MPOC) et les infections respiratoires aiguës entraînent une diminution de l'ISA 2 . Les chercheurs qui étudient la maladie pulmonaire ont développé plusieurs méthodes quantitatives pour évaluer les changements morphologiques dans les poumons, y compris MLI, ILV, nombre d'unités d'échange de gaz, ISA et compliance tissulaire pulmonaire 2 , 3 . Études pionnières par Weibel et al. 4 et Duguid et al. 5 établissent ensemble que l'ISA peut être utilisé comme mesure directe de la capacité d'échange de gaz pulmonaire dans les poumons humains et peut être utilisé comme critère pour déterminer la gravité de l'emphysème. Un certain nombre d'études publiées au cours des cinq dernières années ont utilisé des paramètres morphologiques pulmonaires ( p. Ex. </eM> ISA et MLI) pour évaluer les changements morphologiques et fonctionnels dans les poumons de la souris pendant le développement 6 et pendant la récupération de la lésion PNX 1 , 7 . ISA est calculé en utilisant l' équation 1 8 , 9 :
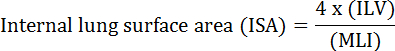
, Où ILV est le volume pulmonaire interne et MLI est un paramètre intermédiaire qui représente l'espace périphérique pulmonaire taille 10 .
PNX, l'ablation chirurgicale d'un ou plusieurs lobes de poumon, a été largement rapportés pour induire la régénération alvéolaire chez de nombreuses espèces, y compris les humains, les souris 11 1, 12 les chiens, les rats et les lapins 13, 14, 15. Un goujonY des poumons de souris à quatorze jours après la PNX a montré que l'expansion des alvéoles préexistants et la formation de novo des alvéoles contribuent à la restauration de l'ISA, de l'ILV et du nombre d'alvéoles dans les tissus pulmonaires restants 1 . Nous et d'autres ont montré que l'insertion de matériaux tels que l'éponge, la cire ou une prothèse sur mesure dans la cavité thoracique vide suivant la PNX ( c'est -à- dire l' implantation de la prothèse) entrave la régénération alvéolaire. Il est maintenant établi que la force mécanique fonctionne comme l'un des facteurs les plus importants pour l'initiation de la régénération alvéolaire 1 , 16 , 17 . De telles études ont mis en évidence l'efficacité de l'utilisation des valeurs ISA des poumons traités par la PNX et de la prothèse comme critère pour évaluer quantitativement la régénération alvéolaire.
Le biais d'observateur est connu pour influencer de manière significative les valeurs mesuréesLues pour les paramètres morphologiques pulmonaires ( p . Ex. , MIL et ILV). Des protocoles standardisés peuvent être utilisés pour éviter ce biais en déterminant à la fois ILV et MLI, qui sont les deux paramètres utilisés dans le calcul de l'ISA. Ici, nous fournissons des protocoles hautement détaillés et standardisés pour mesurer ces paramètres pulmonaires. Fait important, la capacité de quantifier avec précision l'ISA promet d'améliorer la fiabilité et la reproductibilité des études de la fonction pulmonaire dans les modèles de régénération alvéolaire induite par les blessures et devrait faciliter les découvertes mécanistes dans de multiples maladies pulmonaires.
Protocol
Representative Results
Discussion
Dans ce protocole, nous fournissons des descriptions détaillées sur la mesure des paramètres pulmonaires après le PNX du poumon gauche et l'implantation de la prothèse. L'ISA est maintenant considérée comme une mesure clé pour l'évaluation de la fonction respiratoire dans de nombreuses maladies pulmonaires et dans la régénération alvéolaire induite par une blessure. Cependant, bien que la communauté de recherche pulmonaire soit d'accord sur l'utilité de l'ISA comme mesure utile, à…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Les auteurs souhaitent remercier l'Institut national des sciences biologiques de Beijing pour l'assistance. Ce travail a été soutenu par la Fondation municipale des sciences naturelles de Beijing (n ° Z17110200040000).
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
References
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

