Disección señalización complejos por purificación de la afinidad de complementación Bimolecular (BiCAP)
Summary
Este manuscrito describe el protocolo para la purificación de afinidad de complementación Bimolecular (BiCAP). Este novedoso método facilita el aislamiento específico y la caracterización proteómica aguas abajo de cualquier dos proteínas obran recíprocamente, mientras que excluyendo un complejado proteínas individuales como complejos formados con competidores socios de enlace.
Abstract
El ensamblaje de complejos de proteínas es un mecanismo central subyacente a la regulación de muchas vías de señalización de la célula. Un enfoque principal de la investigación biomédica es descifrar cómo estos complejos proteína dinámica actúan para integrar señales de varias fuentes para dirigir una respuesta biológica específica, y cómo esto se convierte en liberalizado en muchos contextos de la enfermedad. A pesar de la importancia de este mecanismo bioquímico clave, hay una falta de técnicas experimentales que pueden facilitar la deconvolución específico y sensible de estos complejos multi moleculares de señalización.
Esta carencia se dirige aquí a través de la combinación de un ensayo de complementación de proteínas con un nanobody específicos de conformación, que hemos llamado purificación de afinidad de complementación Bimolecular (BiCAP). Esta nueva técnica facilita el aislamiento específico y la caracterización proteómica aguas abajo de cualquier par de interacción de proteínas, a la exclusión de un complejo proteínas individuales y complejos formados con competidores socios de enlace.
La técnica del BiCAP es adaptable a una amplia gama de ensayos experimentales aguas abajo, y el alto grado de especificidad de esta técnica permite más matizada las investigaciones sobre la mecánica del conjunto complejo de proteínas que es actualmente posible utilizar técnicas de purificación de afinidad estándar.
Introduction
Conjunto complejo de proteínas es un proceso clave en el mantenimiento de la especificidad espaciotemporal de muchos señalización vías1,2. Mientras que la naturaleza crítica de esta función reguladora es ampliamente reconocida, hay una falta de técnicas experimentales para estudiar estos complejos. La mayoría interactómica estudios se centran en las interacciones con las proteínas individuales, o el enriquecimiento secuencial de componentes complejos. Presentamos aquí una técnica para el aislamiento de un dímero de la proteína específica mientras que excluyendo las moléculas individuales de la componente de proteínas así como complejos formados con competencia vinculante socios3. Hemos llamado a esta técnica de purificación de afinidad de complementación Bimolecular (BiCAP), ya que es una combinación de un ensayo de complementación de fragmento de previamente existente proteína, complementación Bimolecular de la fluorescencia (centro), con el uso nuevo de un conformación específica nanobody recombinante GFP y sus derivados (ver tabla de materiales).
Un ensayo de complementación de fragmento de proteína típica se basa en la expresión de proteínas “presa” y el “cebo” fundido para dividir fragmentos de reporteros como luciferase4, β-galactosidasa5o proteína fluorescente verde (GFP)6 ( Figura 1A). A través de la interacción de las proteínas cebo y presa, los dominios de reportero de split se anima a doblar en una estructura funcional, que permiten la interacción del cebo y presa de proteínas para ser visualizado o cuantificado. BiCAP fue adaptado de una versión de esta técnica que hace uso de fragmentos de la variante de la GFP Venus. Ensayos de complementación de proteínas fluorescentes son un método popular para la visualización de las interacciones proteína-proteína en una célula viva, pero hasta ahora se han limitado a esta un función7. BiCAP representa un avance significativo en este sentido, esta técnica permite no sólo para visualización, pero también el aislamiento y el interrogatorio de la interacción proteína-proteína resultante.
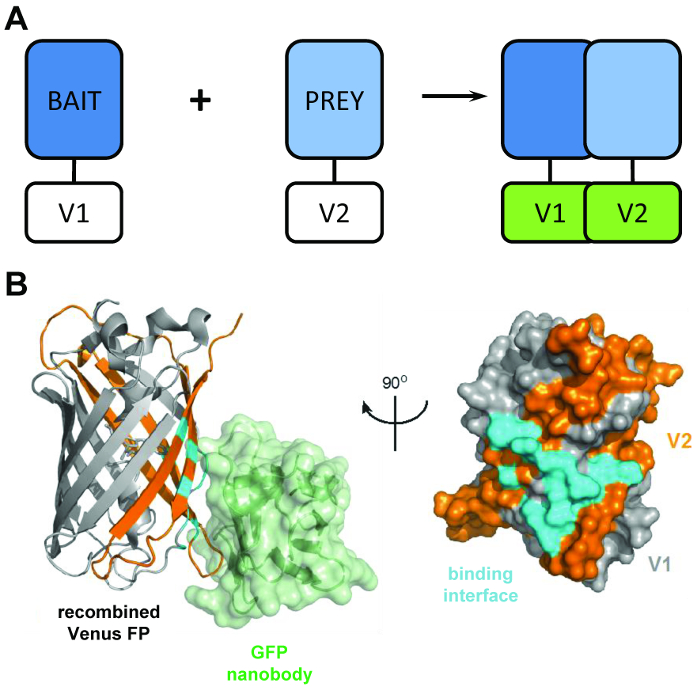
Figura 1: la estructural principal detrás de la técnica del BiCAP. (A) un esquema que al Director detrás de muestra de complementación bimolecular de la fluorescencia las proteínas ‘bait’ y ‘presa’ con la etiqueta el N-terminal V1 o V2 C-terminal fragmentos de la proteína integral de Venus. (B) análisis estructural de la interfaz de interacción (cian) entre la GFP nanobody (verde) y Venus recombinada, mostrando la posición de la V1 (gris) y fragmentos de V2 (naranja) (PDB 3OGO de adhesión). Esta cifra es republicado fromCroucher et al.3 reimpreso con permiso de la AAAS. Haga clic aquí para ver una versión más grande de esta figura.
El BiCAP técnica hace uso de dos fragmentos no fluorescente de Venus (llamado V1 y V2) que asocian con un bajo grado de afinidad, a menos que una interacción se produce entre sus socios de fusión. En este caso, los dominios de dos split doblarle en la estructura funcional del β-barril del fluoróforo (figura 1B)6. La innovación clave del BiCAP proviene de la introducción de la recombinante GFP nanobody, que reconoce un epitopo tridimensional en el β-barril de GFP (y variantes como Venus) que sólo está presente en el fluoróforo correctamente recombinado y doblado ( Figura 1B)8. Crucial, la GFP nanobody no enlazar a cualquiera de los fragmentos individuales de Venus. Esto facilita el aislamiento de dímeros de proteínas sólo después de las dos proteínas forman un complejo de su propia voluntad, llevando a resultados más representativos que los adquirió de los métodos que hacen uso de interacciones químicamente inducida, forzada9.
BiCAP es una técnica poderosa que se centra específicamente en los complejos, que potencialmente pueden combinarse con un número de aplicaciones posteriores para mejorar el nivel de detalle de nuestra comprensión de estos complejos de papel en la transducción de señal . También incluye la característica importante de permitir la visualización de las interacciones de proteínas in situ. Hasta la fecha, BiCAP se ha demostrado como un método eficaz de analizar el interactoma de receptores tirosina quinasa (RTK) dímeros3, pero la capacidad de adaptación de este método significa que pueden adoptarse en casi cualquier contexto de interacción de proteínas.
Protocol
Representative Results
Discussion
BiCAP es un método eficaz para aislar dímeros de la proteína específica mientras que excluyendo los componentes individuales y su competencia vinculante socios3. BiCAP se basa en la adaptación de un ensayo de complementación de proteínas de fluorescencia llamado Centro6. Los métodos existentes, incluyendo análisis de ligadura centro y proximidad, se han utilizado extensivamente para visualizar y cuantificar las interacciones de proteínas en células vivas<sup clas…
Disclosures
The authors have nothing to disclose.
Acknowledgements
D.R.C es un cáncer Instituto de NSW y D.N.S era previamente un cáncer Instituto de Nueva Gales del sur. Los resultados de la investigación presentados en este manuscrito fueron financiados por el cáncer Instituto de Nueva Gales del Sur (13/FRL/1-02 y 09/FCD/2-39), NHMRC (proyecto Grant GNT1052963), Fundación de Ciencias de España (11/GRIC/B2157), oficina de ciencia de Nueva Gales del sur e investigación médica de la familia de los Beca y Fundación de la familia Mostyn. J.F.H. y R.S. recibieron una concesión australiana del postgrado.
Materials
| LR Clonase II Plus enzyme | Thermo Fisher Scientific | 12538120 | Recombinase enzyme required for Gateway cloning (Step 1) into pDEST BiFC destination vectors |
| Proteinase K, recombinant, PCR grade | Thermo Fisher Scientific | EO0491 | |
| 14 mL round-bottomed polypropylene tube | Corning | 352059 | |
| Ampicillin | Roche Diagnostics Australia | 10835242001 | Stock solution prepared at 100 μg/mL in distilled water. |
| Miniprep kit | Promega Corporation | A1330 | |
| Maxiprep kit | Life Technologies Australia | K2100-07 | |
| DMEM | Gibco | 11995-073 | |
| FBS | Life Technologies Australia | 10099-141 | |
| Penicillin/Streptomycin | Life Technologies Australia | 15070-063 | |
| jetPRIME transfection buffer | Polyplus | 114-15 | |
| jetPRIME transfection reagent | Polyplus | 114-15 | |
| PhosSTOP (Phosphatase inhibitor) | Sigma-Aldrich | 4906837001 | |
| cOmplete, Mini, EDTA-free Protease inhibitor cocktail | Roche | 11873580001 | |
| Cell Scraper | Sarstedt | 83.1832 | |
| GFP-Trap_A | Chromotek Gmbh | gta-100 | GFP nanobody coupled to agarose beads |
| N-terminal GFP monoclonal antibody | Covance | MMS-118P | Will detect the V1 tag within the BiFC vectors |
| C-terminal GFP monoclonal antibody | Roche | 11814460001 | Will detect the V2 tag within the BiFC vectors |
| Sample buffer | Invitrogen | NP0008 | Supplemented with 1 mL β-mercaptoethanol. |
| Sequencing grade modified trypsin | Promega Corporation | V5117h | |
| LoBind microcentrifuge tubes | Point of Care Diagnostics | 0030 108 116 | |
| Iodoacetamide | Sigma-Aldrich | I1149-5G | Prepared at 5 mg/mL in ultrapure water |
| Trifluoroacetic Acid – Sequanal Grade | Thermo Fisher | 10628494 | |
| 3M Empore solid phase extraction C18 disks (octadecyl) – 4.7 cm | Thermo Fisher | 14-386-2 | To prepare stage tips, cut 1 mm disks using an appropriately sized hole punch. Alternatively, pre-prepared stage tips can also be purchased, see below. |
| C18 Stage Tips, 10 µL bed | Thermo Fisher | 87782 | |
| Formic acid OPTIMA for LC/MS grade 50mL | Thermo Fisher | FSBA117-50 | |
| 1.9 μm C18 ReproSil particles | Dr. Maisch GmbH | r119.aq. | Stationary phase particles |
| Acetonitrile OPTIMA LC/MS grade | Thermo Fisher | FSBA955-4 | |
| Easy-nLC HPLC | Thermo Fisher | ||
| LTQ Orbitrap Velos Pro | Thermo Fisher | ||
| Triton X-100 | Sigma-Aldrich | T8787 | Non-ionic detergent (100%) |
| DH5α cells | Thermo Fisher | Heat-shock-competent cells |
References
- Kolch, W., Pitt, A. Functional proteomics to dissect tyrosine kinase signalling pathways in cancer. Nat Rev Cancer. 10 (9), 618-629 (2010).
- Pawson, T., Kofler, M. Kinome signaling through regulated protein-protein interactions in normal and cancer cells. Curr Opin Cell Biol. 21 (2), 147-153 (2009).
- Croucher, D. R., et al. Bimolecular complementation affinity purification (BiCAP) reveals dimer-specific protein interactions for ERBB2 dimers. Sci Signal. 9 (436), ra69 (2016).
- Cassonnet, P., et al. Benchmarking a luciferase complementation assay for detecting protein complexes. Nat Methods. 8 (12), 990-992 (2011).
- Rossi, F., Charlton, C. A., Blau, H. M. Monitoring protein-protein interactions in intact eukaryotic cells by beta-galactosidase complementation. Proc Natl Acad Sci U S A. 94 (16), 8405-8410 (1997).
- Magliery, T. J., et al. Detecting protein-protein interactions with a green fluorescent protein fragment reassembly trap: scope and mechanism. J Am Chem Soc. 127 (1), 146-157 (2005).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nat Biotechnol. 21 (5), 539-545 (2003).
- Kubala, M. H., Kovtun, O., Alexandrov, K., Collins, B. M. Structural and thermodynamic analysis of the GFP:GFP-nanobody complex. Protein Sci. 19 (12), 2389-2401 (2010).
- Fegan, A., White, B., Carlson, J. C., Wagner, C. R. Chemically controlled protein assembly: techniques and applications. Chem Rev. 110 (6), 3315-3336 (2010).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. plasmid purification. J Vis Exp. , (2017).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Shearer, R. F., et al. The E3 ubiquitin ligase UBR5 regulates centriolar satellite stability and primary cilia formation via ubiquitylation of CSPP-L. Mol Biol Cell. , (2018).
- Shannon, P., et al. Cytoscape: A software environment for integrated models of biomolecular interaction networks. Genome Res. 13 (11), 2498-2504 (2003).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, 15690 (2017).

