Тензометрический датчик монитора (СВП) для непрерывных измерений зияют клапан в двустворчатых моллюсков в ответ на Велоспорт Лаборатория индуцированного Diel гипоксии и рН
Summary
Понимание поведенческие реакции двустворчатых подвеска питатели на переменные среды, например растворенного кислорода, может объяснить некоторые экосистемные процессы. Мы разработали недорогой, лабораторная, Тензодатчики монитор (СГМ) для измерения клапан зияют ответы устриц, виргинская Crassostrea, Велоспорт diel гипоксии и циклические рН.
Abstract
Недорогой, лабораторная, Тензодатчики клапан зияют монитор (СГМ) был разработан для контролировать поведение зияют клапан двустворчатых моллюсков в ответ на Велоспорт diel гипоксии. Мост Уитстона был подключен к тензодатчиков, которые были прикреплены к раковины устриц (Crassostrea виргинская). Для открытия и закрытия двустворчатые записанных сигналов разрешено регистрироваться непрерывно в течение двух дневный периоды экспериментально индуцированной diel Велоспорт гипоксии и Велоспорт diel изменения рН. Здесь мы опишем протокол для разработки недорогих Тензометрический датчик монитора и описания, в примере лаборатории эксперимента, как мы использовали его для измерения поведение зияют клапан Восточной устрицы (C. виргинская), в ответ на Велоспорт diel гипоксии и циклические изменения рН. Клапан зияют была измерена на устриц, подвергается циклическим тяжелой гипоксии (0,6 мг/Л) растворенного кислорода условий с и без циклические изменения в рН, условиях циклические мягкая гипоксической (1,7 мг/Л) и нормоксические (7,3 мг/Л) условиях. Мы демонстрируем, что, когда устрицы сталкиваются неоднократные diel циклов, они быстро закрыть их оболочек в ответ на тяжелой гипоксии и закрыть с временным лагом к легкой гипоксии. Когда восстанавливается normoxia, они быстро открыть снова. Устрицы не реагировать циклический рН условий, наложенных на diel Велоспорт тяжелой гипоксии. В условиях сокращения кислородная более чем одна треть устрицы закрыты одновременно. Мы демонстрируем, что устриц реагировать diel Велоспорт гипоксии, которые необходимо учитывать при оценке поведения двустворчатых моллюсков для растворенного кислорода. Клапан SGM может использоваться для оценки реакции двустворчатых моллюсков на изменения в растворенного кислорода или загрязняющих веществ. Уплотнительная методов для лучшего уплотнения клапана зияют тензодатчиков от морской воды нужно дальнейшего совершенствования для повышения долговечности датчиков.
Introduction
Гипоксия, т.е., растворенного концентрации кислорода достаточно низкий негативно скажется на биологических и экологических процессов, но часто функционально определяется как [делать] < 2 мг / Л1и аноксии (функционально определяется как [делать] 0.0-0,2 мг/Л) в в мире прибрежных вод, устьев рек и глубоководных2,3 происходят более часто и сильно и часто усугубляются увеличения эвтрофикации4,5. Во все большей степени площадной гипоксии и гипоксия макрофауны отрицательно сказывается и потерять Хабитат масштабы и качество среды обитания. Изменение климата прогнозируется ухудшаться гипоксии и аноксии6.
В многих стратифицированная, обогащенная питательными веществами лиманы как Чесапик-Бэй, США сезонно стойких гипоксия может преобладать и может произойти с каждым годом2. Кроме того Велоспорт diel гипоксии частые в устьях рек, таких как Чесапик-Бэй и в других местах и происходит поздно во время ночью или рано утром часов в7,летом8.
Большинство исследований были сосредоточены на эффект непрерывного воздействия организмов низкой [делать] и на их терпимости к гипоксии и аноксии9,10,11,12,13,14 . Кроме того исследования посмотрел на крупный сдвиг в видовом составе дистрибутивов, распространённость и видов в ответ на расширенный низкий [делать]4,15. Часто виды, которые очень чувствительны к низкой умирают в массах,16 ветра остальных видов к младшим, меньшего размера, недолго фауны, как, например, на экосистемы Луизиана-Техас полки4.
Поведенческие изменения обычно предшествуют сообщества крах17 и исследования сообщили на поведенческие реакции организмов к расширенной низкой [делать]4,16,,1718,19 ,20,21,,2223,24,25. Эти исследования, однако, не сосредоточиться на реакции организмов diel Велоспорт воздействия гипоксии и колебания характер [делать] наличие в лиманах.
Diel Велоспорт гипоксии в мелководных лиманах получил повышение осведомленности как исследования монитор [делать] более часто в течение дней с зонды в эстуарии16,26. Вода может оставаться гипоксических для часов в конце ночью или рано утром часов в летнее время когда нет никакого фотосинтеза, генерации кислорода во время ночи, но высокое потребление кислорода аэробном дыхании7,16. Было также установлено, что приливы пострадавших diel Велоспорт низких условий ДУ с самых экстремальных минимумы наблюдается, когда отливы совпал с окончанием ночью27. Только после нескольких часов гипоксии, [делать] вернуться к normoxia7,,1628 в день цикла.
Для определения поведенческие реакции C. виргинская diel Велоспорт гипоксии и рН мы контролировать открытие и закрытие клапанов устриц, подвергается Лаборатория индуцированного diel Велоспорт [делать] и циклические рН. Зияют реакции двустворчатых моллюсков были использованы для выявления неблагоприятных экологических условий. Закрытие клапана двустворчатых моллюсков в ответ на загрязнители29,30,31, токсичных водорослей32,,3334, тепловое загрязнение35,36 , 37, количество пищи уменьшить38,,3940, кормление режим39,41, встраивание37,42, фотопериода43 , 44,45,рН46и комбинированный pH и растворенного кислорода47 были измерены. Зияют методы например, включены прямых наблюдений48,49,13, непрерывных измерений с помощью герконовых выключателей и магниты (Дрейссены монитор)50или волоконно оптические датчики 51 , требуется чистая вода. Кроме того датчики Холла сила магнита и магнитного поля были использованы для изучения мидий зияют угол52,53,,5455и системы высокой частоты электромагнитной индукции что можно измерить различной расстояние между двух электрических катушек, которые приклеиваются на клапанах был использован56,,5758,59. Для системы электромагнитной индукции требуется источник высокого напряжения и мощности должен быть доставлен к обеим сторонам корпуса52. Эта система также доступен коммерчески «MOSSELMONITOR» (http://mosselmonitor.nl/).
На бюджет жесткой исследований, мы построили монитор с недорогой Тензодатчики (СГМ) непрерывно измерять Ойстер зияют над лаборатории индуцированной diel Велоспорт [делать] и рН, в условиях низкой видимости. Наша система также намного проще, чем конкурирующие системы, позволяя многих животных инструментируемой во время эксперимента. Мы хотели определить поведенческие ответы C. виргинская diel Велоспорт тяжелой (= 0,6 мг/Л) гипоксии с контроля pH (pH = 7,8) и Велоспорт pH (рН = 7,8-7.0), соответственно и зияют ответы на мягкой (= 1,7 мг/Л) гипоксии. Кроме того мы хотели, чтобы определить, если устрицы способны быстро реагировать на изменения в над diel цикла и как они реагируют, когда normoxia возвращается после гипоксического события. Возможно устрицы оптимально адаптированы к быстро изменяющимся окружающей среды, найденный в многих устьях16,27 , где они живут. В то время как более сложные клапан зияют мониторы доступны, СГМ предлагает недорогой метод, который позволяет непрерывных измерений клапан зияют в водах даже в условиях низкой видимости.
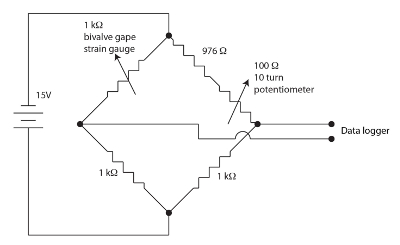
Рисунок 1. Мост Уитстона аппарат клапан зияют. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Тензометрические датчики, используемые для мониторинга двустворчатых зияют являются резистивные фильмы в меандр узор на водоплавающих бэк. Небольшое количество штамм модулировать сопротивление датчика. Двустворчатые сгибает штамм Гейдж, когда он зевает, вызывая изменения в датчик сопротивления. Мы использовали обнуления, сбалансированный, мост Уитстона для каждого двустворчатых канала, как показано на рисунке 1 для измерения изменений в датчик сопротивления. Мост Уитстона обнуляется, потенциометр, позволяя довольно высокий коэффициент усиления работает регистратор. Мост Уитстона — это стандартный метод для точного измерения неизвестных сопротивления, с использованием коэффициента известный сопротивления стандартных и вольтметр. История этой очень старый метод рассматривается в Ekelof (2001)60. Мы интегрировали 12 каналов, каждый с собственным мост Уитстона и обнуления потенциометра, в подразделение Тензометрический датчик монитора (СГМ).
Protocol
Representative Results
Discussion
Типичные исследования фокус на непрерывной, расширенных периодов времени низким содержанием кислорода условий и ответ, часто измеряется как выживание, животных. Однако в настоящее время, наше понимание поведенческих реакций животных к гипоксии diel Велоспорт является минимальным<sup class…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Мелинда Форсет для фотографирования устриц и измерения их ширина зияют в ImageJ. Мы благодарим Брейтбург Дениз для доступа к аквариумов с diel Велоспорт гипоксии и циклические рН условий. Мы благодарим Смитсоновский институт окружающей среды исследовательский центр, Edgewater, штат Мэриленд, пространство для экспериментов. Гипоксия эксперименты финансируются национального управления океанических и атмосферных – центр под эгидой прибрежные морские исследовательский грант нет NA10NOS4780138 и Смитсоновский Hunterdon фонд Дениз Брейтбург. Клапан зияют измерений при гипоксии, что эксперименты финансируются факультет повышения Грант в Вашингтоне колледж Elka т. Портер.
Materials
| Campbell CR 10x data logger | Campbell Scientific, Logan, Utah | Or other data logger. At Campbell the CR 10X has been replaced with the CR 1000 | |
| Campbell CR 10x multiplexer | Campbell Scientific, Logan, Utah | Data logger needs to have space for 12 channels | |
| Dsub connector male crimp pins | TE Connectivity | 205089-1 | pins for gape sensor leads |
| PCA tape | Micro Measurements Corp, NC | To seal the strain gauge | |
| Duro Quick Gel | Ace Hardware | Superglue | |
| SG13/1000-LY43 or LY41 | Omega Engineering Inc., Stanford, CT | Strain gauges | |
| 32 AWG (7/40) teflon Alpha wires | AlphaWire, Elizabeth, NJ | 2840/7 | Sensor cables, different colors are available |
| 1/16" heat shrink tubing | Qualtek | B01A3QKKO6 | To seal the leads of the sensor cable |
| Weller WES51 Analog Soldering Station | Amazon | Lots of soldering, need a good soldering iron. https://www.amazon.com/Weller-WES51-Analog-Soldering-Station/dp/B000BRC2XU/ref=sr_1_23?s=hi&ie=UTF8&qid=1505654295 &sr=1-23&keywords=soldering+iron |
|
| Rosin Soldering Flux Paste | Amazon | Needed for soldering | |
| 60-40 Tin Lead Rosin Core Solder Wire | Amazon | Needed for soldering | |
| Aquarium sealant | Home Depot | Attach sensors to bivalve | |
| PC Laptop | Any old PC to run Campbell gape program | ||
| heat gun | Amazon | shrink shrink tubing | |
| Drill | Hardware store, Amazon | for twisting wires to make sensor cables | |
| AC to DC power module | Acopian | DB15-30 | Wheatstone bridge power supply |
| Poteniometer | Clarostat | 733A | Wheatsone bridge nulling |
| isolating BNC connector | Sterren Electronics | "200-148 | Wheatstone bridge output for multimeter |
| Fused AC receptical panel module | Adam technologies | IEC-GS-1-200 | Wheatstone bridge power supply connector |
| 976 ohm 1% resistor | Vishay Dale | CMF50976R00FHEB | Wheatstone bridge resistor |
| 1 kohm 1% resistor | Vishay Dale | CMF501K0000FHEB | Wheatstone bridge resistor |
| Potentiometer scale dial | Kilo International | 462 | 10 turn dial for nulling potentiometer |
| DB25 male panel connector | TE connectivity | 1757819-8 | Data logger connector on Wheatstone bridge |
| DB25 female panel connector | TE connectivity | 1757819-8 | Sensor connector to Wheatstone bridge |
| perforated circuit board | Vector electronics | 64P44WE | circuit board for mounting of bridge components |
| enclosure | Hammond Manufacturing | 1444-29 | Enclosure for sensor readout electronics |
References
- Vaquer-Sunyer, R., Duarte, C. M. Thresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences of the United States of America. 105 (40), 15452-15457 (2008).
- Diaz, R. J., Rosenberg, R. Spreading dead zones and consequences for marine ecosystems. Science. 321, 926-929 (2008).
- Levin, L. A., Breitburg, D. L. Linking coasts and seas to address ocean deoxygenation. Nature Climate Change. 5, 401-403 (2015).
- Diaz, R. J., Rosenberg, R. Marine benthic hypoxia: A review of its ecological effects and the behavioural responses of benthic macrofauna. Oceanography and Marine Biology: An annual Review. 33, 245-303 (1995).
- Patterson, H. K., Boettcher, A., Carmichael, R. H. Biomarkers of dissolved oxygen stress in oysters: a tool for restoration and management efforts. PLoS One. 9 (8), 104440 (2014).
- Altieri, A. H., Gedan, K. B. Climate change and dead zones. Global Change Biology. 21 (4), 1395-1406 (2015).
- Tyler, R. M., Brady, D. C., Targett, T. E. Temporal and spatial dynamics of diel-cycling hypoxia in estuarine tributaries. Estuaries and Coasts. 32 (1), 123-145 (2009).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- Stickle, W. B., Kapper, M. A., Liu, L. -. L., Gnaiger, E., Wang, S. Y. Metabolic adaptations of several species of crustaceans and molluscs to hypoxia: toterance and microcalometric studies. Biological Bulletin. 177 (2), 303-312 (1989).
- Gamenick, I., Jahn, A., Vopel, K., Guiere, O. Hypoxia and sulphide as structuring factors in a macrozoobenthic community on the Baltic Sea shore: colonization studies and tolerance experiments. Marine Ecology Progress Series. , 73-85 (1996).
- Modig, H., Olafsson, E. Responses of Baltic benthic invertebrates to hypoxic events. Journal of Experimental Marine Biology and Ecology. 229 (1), 133-148 (1998).
- Riedel, B., Zuschin, M., Stachowitsch, M. Tolerance of benthic macrofauna to hypoxia and anoxia in shallow coastal seas: a realistic scenario. Marine Ecology Progress Series. 458, 39-52 (2012).
- Lombardi, S. A., Harlan, N. P., Paynter, K. T. Survival, acid-base balance, and gaping responses of the Asian Oyster C. ariakensis and the Eastern Oyster C. virginica during clamped emersion and hypoxic immersion. Journal of Shellfish Research. 32 (2), 409-415 (2013).
- Jansson, A., Norkko, J., Dupont, S., Norkko, A. Growth and survival in a changing environment: Combined effects of moderate hypoxia and low pH on juvenile bivalve Macoma balthica. Journal of Sea Research. 102, 41-47 (2015).
- Gooday, A. J., et al. Faunal responses to oxygen gradients on the Pakistan margin: A comparison of foraminiferans, macrofauna and megafauna. Deep Sea Research Part II: Topical Studies in Oceanography. 56 (6-7), 488-502 (2009).
- Montagna, P. A., Ritter, C. Direct and indirect effects of hypoxia on benthos in Corpus Christi Bay, Texas, U.S.A. Journal of Experimental Marine Biology and Ecology. 330 (1), 119-131 (2006).
- Villnas, A., Norkko, J., Lukkari, K., Hewitt, J., Norkko, A. Consequences of increasing hypoxic disturbance on benthic communities and ecosystem functioning. PLoS One. 7 (10), 44920 (2012).
- Breitburg, D. Effects of hypoxia, and the balance between hypoxia and enrichment on coastal fishes and fisheries. Estuaries. 25 (4), 767-781 (2002).
- Costantini, M., et al. Effect of hypoxia on habitat quality of striped bass (Morone saxatilis) in Chesapeake Bay. Canadian Journal of Fisheries and Aquatic Sciences. 65 (5), 989-1002 (2008).
- Ludsin, S. A., et al. Hypoxia-avoidance by planktivorous fish in Chesapeake Bay: Implications for food web interactions and fish recruitment. Journal of Experimental Marine Biology and Ecology. 381, 121-131 (2009).
- Zhang, H., et al. Hypoxia-driven changes in the behavior and spatial distribution of pelagic fish and mesozooplankton in the northern Gulf of Mexico. Journal of Experimental Marine Biology and Ecology. 381, 80-91 (2009).
- Sparks, B. L., Strayer, D. L. Effects of low dissolved oxygen on juvenile Elliptio complanata (Bivalvia:Unionidae). Journal of the Norther American Benthological Society. 17, 129-134 (1998).
- Llanso, R. J. Effects of hypoxia on estuarine benthos: the lower Rappahannock River (Chesapeake Bay), a case study. Estuarine, Coastal and Shelf Science. 35 (5), 491-515 (1992).
- Riedel, B., Zuschin, M., Haselmair, A., Stachowitsch, M. Oxygen depletion under glass: Behavioural responses of benthic macrofauna to induced anoxia in the Northern Adriatic. Journal of Experimental Marine Biology and Ecology. 367 (1), 17-27 (2008).
- Riedel, B., et al. Effect of hypoxia and anoxia on invertebrate behaviour: Ecological perspectives from species to community level. Biogeosciences. 11 (6), 1491-1518 (2014).
- Breitburg, D. L. Near-shore hypoxia in the Chesapeake Bay: Patterns and relationships among physical factors. Estuarine Coastal and Shelf Science. 30, 593-609 (1990).
- Baumann, H., Wallace, R. B., Tagliaferri, T., Gobler, C. J. Large natural pH, CO2 and O2 fluctuations in a temperate tidal salt marsh on diel, seasonal, and interannual time scales. Estuaries and Coasts. 38, 220-231 (2015).
- Breitburg, D. L., et al. Landscape-level variation in disease susceptibility related to shallow-water hypoxia. PLoS One. 10 (2), 0116223 (2015).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Kadar, E., et al. Avoidance responses to aluminum in the freshwater bivalve Anodonta cygnea. Aquatic Toxicology. 55, 137-148 (2001).
- Soliman, M. F. M., El-Shenawy, N. S., Tadros, M. M., Abd El-Azeez, A. A. Impaired behavior and changes in some biochemical markers of bivalve (Ruditapes decussatus) due to zinc toxicity. Toxicological & Environmental Chemistry. 97 (5), 674-686 (2015).
- Shumway, S. E., Cucci, T. L. The effects of the toxic dinoflagellate Protogonyaulax tamarensis on the feeding and behaviour of bivalve molluscs. Aquatic Toxicology. 10, 9-27 (1987).
- Basti, L., et al. Effects of the toxic dinoflagellate Heterocapsa circularisquama on the valve movement behaviour of the Manila clam Ruditapes philippinarum. Aquaculture. 291 (1-2), 41-47 (2009).
- Tran, D., Haberkorn, H., Soudant, P., Ciret, P., Massabuau, J. -. C. Behavioral responses of Crassostrea gigas exposed to the harmful algae Alexandrium minutum. Aquaculture. 298 (3-4), 338-345 (2010).
- Shumway, S. E., Koehn, R. K. Oxygen consumption in the American oyster Crassostrea virginica. Marine Ecology Progress Series. 9, 59-68 (1982).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Pearson, G. A., Serrao, E. A. Love thy neighbour: group properties of gaping behaviour in mussel aggregations. PLoS One. 7 (10), (2012).
- Dowd, W. W., Somero, G. N. Behavior and survival of Mytilus. congeners following episodes of elevated body temperature in air and seawater. Journal of Experimental Biology. 216 (3), 502-514 (2013).
- Higgins, P. J. Effects of food availability on the valve movements and feeding behavior of juvenile Crassostrea virginica (Gmelin). I. Valve movements and periodic activity. Journal of Experimental and Experimental Marine Biology and Ecology. 45, 229-244 (1980).
- Riisgård, H. U., Lassen, J., Kittner, C. Valve-gape response times in mussels (Mytilus edulis)-Effects of laboratory preceding-feeding conditions and in situ tidally induced variation in phytoplankton biomass. Journal of Shellfish Research. 25, 901-911 (2006).
- Robson, A. A., De Leaniz, C. G., Wilson, R. P., Halsey, L. G. Behavioural adaptations of mussels to varying levels of food availability and predation risk. Journal of Molluscan Studies. 76, 348-353 (2010).
- Robson, A. A., de Leaniz, C. G., Wilson, R. P., Halsey, L. G. Effect of anthropogenic feeding regimes on activity rhythms of laboratory mussels exposed to natural light. Hydrobiologia. 655, 197-204 (2010).
- Nicastro, K. R., Zardi, G. I., McQuaid, C. D., Stephens, L., Radloff, S., Blatch, G. L. The role of gaping behaviour in habitat partitioning between coexisting intertidal mussels. BMC Ecology. 10, 17 (2010).
- Loosanoff, V. S., Nomejko, C. A. Feeding of oysters in relation to tidal stages and to periods of light and darkness. Biological Bulletin. 90 (3), 244-264 (1946).
- Comeau, L. A., Mayrand, E., Mallet, A. Winter quiescence and spring awakening of the Eastern oyster Crassostrea virginica at its northernmost distribution limit. Marine Biology. 159 (10), 2269-2279 (2012).
- Pynonnen, K. S., Huebner, J. Effects of episodic low pH exposure on the valve movements of the freshwater bivalve Anodonta cygnea L. Water Research. 29 (11), 2579-2582 (1995).
- Jakubowska, M., Normant-Saremba, M. The effect of CO2-induced seawater acidification on the behaviour and metabolic rate of the baltic clam Macoma balthica. Annales Zoologici Fennici. 52 (5-6), 353-367 (2015).
- Jakubowska, M., Normant, M. Metabolic rate and activity of blue mussel Mytilus edulis trossulus.under short-term exposure to carbon dioxide-induced water acidification and oxygen deficiency. Marine and Freshwater Behaviour and Physiology. 48 (1), 25-39 (2015).
- Newell, C. R., Wildish, D. J., MacDonald, B. A. The effects of velocity and seston concentration on the exhalent siphon area, valve gape and filtration rate of the mussel Mytilus edulis. Journal of Experimental Marine Biology and Ecology. 262, 91-111 (2001).
- Maire, O., Amouroux, J. -. M., Duchene, J. -. C., Gremare, A. Relationship between filtration activity and food availability in the Mediterranean mussel Mytilus galloprovincialis. Marine Biology. 152 (6), 1293-1307 (2007).
- Borcherding, J. Ten years of practical experience with the Dreissena-monitor, a biological early warning system for continuous water quality monitoring. Hydrobiologia. 556 (1), 417-426 (2006).
- Frank, D. M., Hamilton, J. F., Ward, E. E., Shumway, S. E. A fiber optic sensor for high resolution measurement and continuous monitoring of valve gape in bivalve molluscs. Journal of Shellfish Research. 26 (2), 575-580 (2007).
- Wilson, R., Reuter, P., Wahl, M. Muscling in on mussels: New insights into bivalve behaviour using vertebrate remote-sensing technology. Marine Biology. 147 (5), 1165-1172 (2005).
- Nagai, K., Honjo, T., Go, J., Yamashita, H., Seok Jin, O. Detecting the shellfish killer Heterocapsa circularisquama (Dinophyceae) by measuring bivalve valve activity with a Hall element sensor. Aquaculture. 255 (1-4), 395-401 (2006).
- Robson, A., Wilson, R., de Leaniz, C. G. Mussels flexing their muscles: a new method for quantifying bivalve behaviour. Marine Biology. 151 (3), 1195-1204 (2007).
- Robson, A. A., Thomas, G. R., de Leaniz, C. G., Wilson, R. P. Valve gape and exhalant pumping in bivalves: optimization of measurement. Aquatic Biology. 6 (1-3), 191-200 (2009).
- de Zwart, D., Kramer, J. M., Jenner, H. A. Practical experiences with the biological early warning system “mosselmonitor”. Environmental Toxicology and Water Quality. 10 (4), 237-247 (1995).
- Jou, L. -. J., Lin, S. -. C., Chen, B. -. C., Chen, W. -. Y., Liao, C. -. M. Synthesis and measurement of valve activities by an improved online clam-based behavioral monitoring system. Computers and Electronics in Agriculture. 90, 106-118 (2013).
- Barile, N. B., Scopa, M., Recchi, S., Nerone, E. Biomonitoring of coastal marine waters subject to anthropogenic use: development and application of the biosensor Mosselmonitor. Ovidius University Annals of Chemistry. 27 (2), 81-86 (2016).
- Ballesta-Artero, I., Witbaard, R., Carroll, M. L., van der Meer, J. Environmental factors regulating gaping activity of the bivalve Arctica islandica in Northern Norway. Marine Biology. 164 (5), 116 (2017).
- Ekelof, S. The genesis of the Wheatstone bridge. Engineering Science and Education Journal. 10, 37-40 (2001).
- Keppel, A. G., Breitburg, D. L., Wikfors, G. H., Burrell, R. B., Clark, V. M. Effects of co-varying diel-cycling hypoxia and pH on disease susceptibility in the eastern oyster Crassostrea virginica. Marine Ecology Progress Series. 538, 169-183 (2015).
- Burrell, R. B., Keppel, A. G., Clark, V. M., Breitburg, D. L. An automated monitoring and control system for flow-through co-cycling hypoxia and pH experiments. Limnology and Oceanography: Methods. 14, 168-185 (2015).
- Porter, E. T., Breitburg, D. L. Eastern oyster Crassostrea virginica, valve gape behavior under diel-cycling hypoxia. Marine Biology. 163 (218), (2016).
- Bergeron, C. M. . The impact of sediment resuspension on mercury cycling and the bioaccumulation of methylmercury into benthic and pelagic organisms. , (2005).

