Protocole facile pour la synthèse d’auto-assemblage axée sur les polyamines peptides Amphiphiles (AAE) et des biomatériaux
Summary
La synthèse de peptide axée sur les polyamines amphiphiles (AAE) est un défi significatif en raison de la présence de plusieurs atomes d’azote aminé, qui nécessite une utilisation judicieuse de la protection des groupes afin de masquer ces fonctionnalités réactives. Dans cet article, nous décrivons une méthode facile pour la préparation de ces nouvelle classe de molécules d’auto-assemblage.
Abstract
Axée sur les polyamines peptides Amphiphiles (AAE) sont une nouvelle classe d’auto-assemblage amphiphiles biomatériaux liées aux peptides amphiphiles (Fe). PAs traditionnels possèdent des acides aminés chargés comme des groupes (lysine, arginine), qui sont directement reliés à un segment de lipides ou peuvent contenir une région d’éditeur de liens faite des acides aminés neutres de solubilisation. Réglage de la séquence peptidique de PAs peut produire diverses morphologies. De même, l’AAE possède un segment hydrophobe et acides aminés neutres, mais contiennent aussi des molécules de polyamines comme l’eau (hydrophiles) groupes de solubilisation. Comme c’est le cas avec un FE, AAE peut également s’auto-assembler en diverses morphologies, y compris les petites tiges, nano-rubans torsadés et fondus nano-feuilles, dissous dans l’eau. Toutefois, la présence d’amines primaires et secondaires sur une molécule unique polyamine pose un défi de taille quand synthèse AAE. Dans cet article, nous montrons un protocole simple, basé sur des précédents de littérature, d’atteindre une synthèse facile des AAE à l’aide de la synthèse des peptides en phase solide (SPPS). Ce protocole peut être étendu à la synthèse de PAs et autres systèmes similaires. Nous illustrons également les mesures qui sont nécessaires pour le clivage de la résine, l’identification et la purification.
Introduction
Auto-assemblage peptides amphiphiles (PAs) sont une classe des biomatériaux se compose habituellement des segments suivants : tête a hydrophile, région de l’éditeur de liens (b) et queue c hydrophobe. La plupart PAs décrits dans la littérature possèdent une tête hydrophile constitué de résidus d’acides aminés polaires ou chargées1,2,3,4. PAs ont trouvé un large éventail d’applications en biomédecine, y compris la délivrance de médicaments, diagnostic de la maladie, médecine régénérative, etc.5. Selon leur ordre d’acide aminé, PAs peut former une grande variété de nanostructures, y compris les micelles sphériques et nano-les filaments. Nous avons récemment rapporté une catégorie d’hybride axée sur les polyamines peptides amphiphiles, appelé PPAs6. Les morphologies, cinétique de l’auto-assemblage et dégradation métabolique, de ces biomatériaux, trouvées liées à leur solubilisation groupe de tête. En outre, les nanostructures PPA ne présentent pas de toxicité vers les cellules de mammifères (lignes MiaPaCa2 et des cellules HeLa) aux concentrations testées. Nanocarriers axée sur les PPA sont vecteurs de drogue attrayante parce que : (1) polyamine absorption et le métabolisme a été démontré pour être augmentés dans les cellules cancéreuses, nanostructures (2) cationiques peut atteindre endosomale évasion7,8, ce qui conduit à plus de circulation et de résidence au sein d’une cellule et (3), ils doivent avoir un profil métabolique distinct par rapport à la PA ; par exemple, ils seront plus stables vers protéases trouvés dans le corps humain (bien qu’ils peut-être sensible aux autres enzymes, telles que des oxydases amine)9,10. En outre, AAE ont ont des morphologies diverses, propriétés physico-chimiques, rigidité des nanoparticules et cinétique Assemblée selon la longueur et la charge individuelle PPA molécule6. Ici, les auteurs décrivent un protocole détaillé pour la synthèse, l’identification et la purification de l’AAE qui peut également être appliquée à la préparation des PAs ou des molécules peptidiques hybrides similaires.
Car polyamines ne sont pas couramment disponibles dans le commerce dans leurs formes protégées, et protégeant les amines primaires et secondaires des polyamines est d’une importance capitale pour leur conjugaison avec les acides aminés et d’autres molécules, que nous présentons le étapes pour obtenir leur protection. L’objectif général du présent protocole est de fournir une méthode simple pour la conjugaison des polyamines aux acides aminés. Polyamines manquent un groupe carboxylique ; ainsi, ils ne peuvent pas être couplés au patinoire Amide ou résines Wang. Au lieu de cela, résines comme le chlorure de 2-chlorotrityl sont recommandés pour le protocole synthétique. Le principal défi pour la synthèse de la PPA est la présence de groupements fonctionnels des amines primaires et secondaires. Pour nos besoins, nous avons protégé tous les amines secondaires dans les polyamines tout en gardant le groupement aminé primaire sur les polyamines libre pour permettre la réaction de couplage. La réaction a été faite sur un support solide, suivant les principes de la synthèse de peptide de phase solide (RCR) pour faciliter la marche à suivre après chaque étape de l’accouplement et la déprotection. Le protocole suivant est pour les deux la synthèse manuelle et automatisée des AAE (bien que la vérification de certaines étapes sera difficile dans un système automatisé). La synthèse de ces molécules peut aussi se faire sur un synthétiseur automatisé ou à l’aide d’un réacteur de micro-ondes (automatisés ou semi-automatisés). Le schéma réactionnel a été résumé dans la Figure 1.
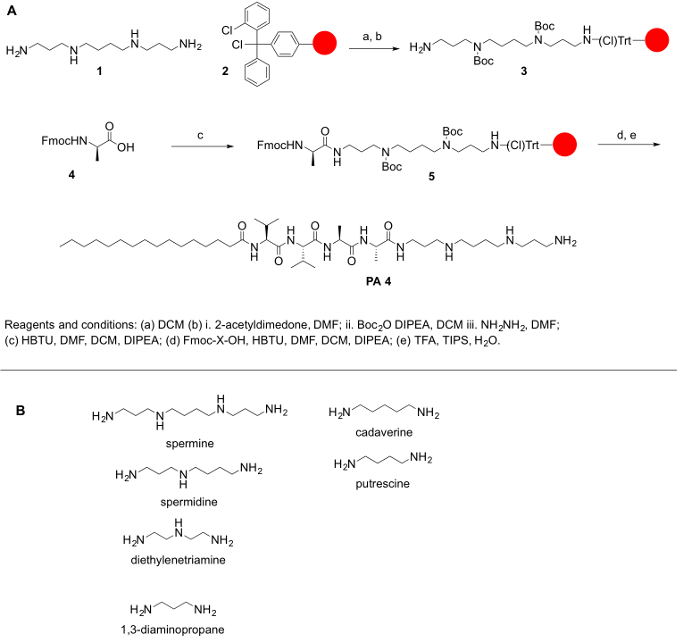
Figure 1 : (A) A schéma de réaction générale pour la synthèse de l’AAE. (B) les polyamines représentatif qui peuvent être utilisés pour synthétisé AAE décrite ici. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
Les protocoles décrits ici peuvent être utilisés pour synthétiser les PPAs comme PAs de puits et des molécules peptidique (comme hybride PA-peptoids). Bien que la synthèse de peptides utilisant un RCR est une procédure simple et directe, la synthèse des peptides contenant des molécules biologiques de guidage peut être particulièrement difficile. Polyamines comme la spermine, spermidine, diethyelenetriamine, etc., peuvent fonctionner comme molécules autoguidage pour le ciblage de cellules de cancer du…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce projet a été financé par l’University of Nebraska Medical Center (fonds d’amorçage, MC-S) ; NIH-COBRE, 5P20GM103480 (T. Bronich) et l’American Chemical Society, PRF # 57434-DNI7(MC-S).
Materials
| 2-Chlorotrityl chloride resin | AappTec | RTZ001 | |
| SynthwareTM synthesis vessel | Aldrich | SYNP120050M | |
| Dichloromethane | Acros | AC406920250 | Fisher Sci. Catalogue # |
| Wrist Shaker | Boekel Scientific | 401000-2 | |
| Kaiser test kit | Sigma-Aldrich | 60017 | |
| 2-[(4,4-dimethyl-2,6-dioxocyclohex-1-ylidene)ethyl-amino]-ethanol | Sigma-Aldrich | CDS004772 | |
| Anhydrous Methanol | Acros | AC610981000 | Fisher Sci. Catalogue # |
| Chloranil test kit | TCI | TCC1771-KIT | VWR Catalogue # |
| Di-tert butyl di-carbonate | Acros | AC194670250 | Fisher Sci. Catalogue # |
| Dimethylformamide | Fisher Scientific | BP1160-4 | |
| Hydrazine | Acros | AC296815000 | FIsher Sci. Catalogue # |
| (2-(1H-benzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphate) | p3biosystems | 31001 | |
| 4-methyl piperidine | Acros | AC127515000 | FIsher Sci. Catalogue # |
| Trifluoroacetic Acid | AappTec | CXZ035 | |
| Triisopropyl Silane | Sigma-Aldrich | 233781 | |
| Ether | Fisher Scientific | E138-1 | |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | C8982 | |
| 9-Aminoacridine | Sigma-Aldrich | 92817 | |
| Fisherbrand Syringe Filters: PTFE Membrane | Fisher Scientific | 09-730-21 |
References
- Cui, H., Pashuck, E. T., Velichko, Y. S., Weigand, S. J., Cheetham, A. G., Newcomb, C. J., Stupp, S. I. Spontaneous and x-ray-triggered crystallization at long range in self-assembling filament networks. Science. 327, 555-559 (2010).
- Pashuck, E. T., Cui, H., Stupp, S. I. Tuning supramolecular rigidity of peptide fibers through molecular structure. Journal of the American Chemical Society. 132, 6041-6046 (2010).
- Stupp, S. I., Zha, R. H., Palmer, L. C., Cui, H., Bitton, R. Self-assembly of biomolecular soft matter. Faraday Discussions. 166, 9-30 (2013).
- Conda-Sheridan, M., Lee, S. S., Preslar, A. T., Stupp, S. I. Esterase-activated release of naproxen from supramolecular nanofibres. Chemical Communications. 50, 13757-13760 (2014).
- Mata, A., Palmer, L., Tejeda-Montes, E., Stupp, S. I. Design of biomolecules for nanoengineered biomaterials for regenerative medicine. Nanotechnology in Regenerative Medicine. , 39-49 (2012).
- Samad, M. B., Chhonker, Y. S., Contreras, J. I., McCarthy, A., McClanahan, M. M., Murry, D. J., Conda-Sheridan, M. Developing Polyamine-Based Peptide Amphiphiles with Tunable Morphology and Physicochemical Properties. Macromolecular bioscience. 17, (2017).
- Nel, A. E., Mädler, L., Velegol, D., Xia, T., Hoek, E. M., Somasundaran, P., Klaessig, F., Castranova, V., Thompson, M. Understanding biophysicochemical interactions at the nano-bio interface. Nature Materials. 8, 543 (2009).
- Gujrati, M., Malamas, A., Shin, T., Jin, E., Sun, Y., Lu, Z. -. R. Multifunctional cationic lipid-based nanoparticles facilitate endosomal escape and reduction-triggered cytosolic siRNA release. Molecular Pharmaceutics. 11, 2734-2744 (2014).
- Zhu, Y., Li, J., Kanvinde, S., Lin, Z., Hazeldine, S., Singh, R. K., Oupický, D. Self-immolative polycations as gene delivery vectors and prodrugs targeting polyamine metabolism in cancer. Molecular Pharmaceutics. 12, 332-341 (2014).
- Planas-Portell, J., Gallart, M., Tiburcio, A. F., Altabella, T. Copper-containing amine oxidases contribute to terminal polyamine oxidation in peroxisomes and apoplast of Arabidopsis thaliana. BMC Plant Biology. 13, 109 (2013).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde – A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Letters. 37, 2625-2628 (1996).
- Ralhan, K., KrishnaKumar, V. G., Gupta, S. Piperazine and DBU: a safer alternative for rapid and efficient Fmoc deprotection in solid phase peptide synthesis. RSC Advances. 5, 104417-104425 (2015).
- Casero, R. A., Marton, L. J. Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases. Nature Reviews Drug Discovery. 6, 373 (2007).
- Wuts, P. G. M., Greene, T. W. . Protection for the Amino Group. In Greene’s Protective Groups in Organic Synthesis. , 696-926 (2006).
- Palasek, S. A., Cox, Z. J., Collins, J. M. Limiting racemization and aspartimide formation in microwave-enhanced Fmoc solid phase peptide synthesis. Journal of Peptide Science. 13, 143-148 (2007).

